洼地绵羊MHC-DRB1基因PCR-RFLP多态性分析
2011-03-07任艳玲董文艳沈志强
肖 娜,任艳玲,李 敏,董文艳,沈志强*
(1.山东省滨州畜牧兽医研究院,山东滨州256600;2.山东省洼地绵羊繁育技术研究推广中心,山东滨州256600;3.山东绿都生物科技有限公司,山东滨州256600)
主要组织相容性复合物(major histocompatibility complex,MHC)是由紧密连锁、高度多态的基因位点所组成的复合物。哺乳动物主要的组织相容复合物包括两个亚家族,即或Ⅰ型和Ⅱ型。MHC的表达产物是细胞表面的糖蛋白,MHCⅠ是由α微球蛋白和β2微球蛋白两条多态链组成;MHCⅡ分子是异源二聚体,是由α和β链组成,在抗原细胞表面表达[1]。MHCⅠ、Ⅱ结构上很类似,但是它们的功能却不尽相同。MHCⅠ主要作为一种内源抗体来应答细胞毒T淋巴细胞,而MHCⅡ分子主要与外来抗原相结合并将这些抗原递呈给T淋巴细胞,最终引起机体的免疫反应[2]。
不同物种之间MHC连锁群包含的基因座位种类以及核苷酸序列的同源性非常高,绵羊的MHC称为OLA(ovine lymphocyte antigen),位于绵羊第20号染色体上。MHC抗原由多肽结合区、类免疫球蛋白区、跨膜区和胞质区组成,其中的多肽结合区是决定其抗原递呈功能的结构域,由MHC基因的第2外显子编码。研究表明,虽然MHC抗原的种类很多,只有DR抗原和DQ抗原主要发挥作用[3]。因此,有关MHC的报道多集中于DR基因和DQ基因的第2外显子。
随着长期自然选择和人工选择,洼地绵羊形成了独特的优势,如繁殖力高、抗逆性强。然而,由于近年来外来商业绵羊品种以及具有优良性状的遗传育种绵羊的引入,纯种洼地绵羊的数目也在逐渐减少。如果群体数目继续减少,将导致一些在免疫过程中起重要作用的基因的遗传变异丢失,从而使该群体抗疾病能力减弱,面临灭绝的危险[4]。本研究对洼地绵羊群体中MHC-DRB1基因位点的多态性进行了初步的研究,为未来研究MHC基因对微生物引起的绵羊疾病感染的影响奠定了基础[5]。
1 材料与方法
1.1 材料
1.1.1 样品采集 洼地绵羊样品来自山东省洼地绵羊原种场,共82只,颈静脉采血,ACD抗凝,全血基因组试剂盒为宝生物工程(大连)有限公司产品。(Code D9081),提取基因组DNA,置—20℃保存备用。
1.2 方法
1.2.1 引物合成及PCR-RFLP 引物合成参照文献[6],引物序列如下:

根据文献[6]的试验条件为基础进行套式PCR。反应体系为:第一轮(20 μ L)10×buffer 2.0 μ L,MgCl2(25 mmol/L)1.2 μ L,dNTP(2 mmol/L)1.2 μ L,HL031(1 μ mol/L)2.0 μ L,OLA-ERB1(1μ mol/L)2.0μ L,Taq 3 μ L(1.5 U),最后加ddH2O至20 μ L。PCR反应条件为:94℃5 min;94℃30 s,50℃30 s,72℃60 s 5个循环;72℃10 min,4℃终止反应。
第二轮(20 μ L):10×buffer 2.0 μ,MgC12(25 mmol/L)1.2 μ L,dNTP(2 mmol/L)1.2 μ L,OLA-XRBI(1 μ mol/L)4.0 μ L,OLA-ERB1(1 μ mol/L)4.0 μ L,Taq 3 μ L(1.5 U);最后加ddH2O至20 μ L。PCR反应条件为:94℃5 min;94℃30 s,63℃30 s,72℃60 s 30个循环;72℃10 min,4℃终止反应。PCR产物经10 g/L琼脂糖凝胶电泳,凝胶成像仪观察结果。
通过RFLP分析来检测多态性位点。PCR扩增产物通过SacⅠ、HaeⅢ限制性内切酶进行酶切,然后经20 g/L的琼脂糖凝胶电泳进行分离。
1.2.2 MHC-DRB1基因克隆与序列分析 选取不同基因型的检测样品,PCR扩增产物经12 g/L琼脂糖凝胶电泳后,利用DNA凝胶回收试剂盒回收纯化后,连接pGEM-T载体,转化到感受态细胞DH5α中,挑选阳性克隆,提取质粒DNA,由上海生工生物工程技术服务有限公司完成测序。
1.2.3 等位基因测序及遗传多样性分析 测序后,在NCBI数据库(http://www.ncbi.nlm.nih.gov/)进行Standard nucleotide-nucleotide Blast搜索。各序列经过DNA Star 5.03软件包中的Editseq、Seqman和Megalign软件并结合排序分析,比较序列的同源性。序列间的核苷酸、氨基酸差异数、转换、颠换、各序列的碱基含量均由MEGA 3.0软件进行计算。分析该物种的遗传多样性。基因频率、基因型频率、χ2适合性检验以及基因杂合度的计算均用Popgene32软件进行。
2 结果
2.1 MHC-DRB1基因PCR扩增
应用套式PCR扩增了洼地绵羊MHC-DRB1的第2外显子,扩增产物为296 bp(图1)。
2.2 PCR-RFLP结果
参照Konnai S等[6]报道的绵羊酶切图谱和等位基因命名方法对绵羊MHC-DRB1基因PCRRFLP的电泳检测结果进行判型。
在SacⅠ酶切位点上,洼地绵羊表现出多态性,出现有(296 bp)、BB(208 bp和88 bp)和AB(296、208、88 bp)3种表型,SacⅠ酶切位点受A和B两个共显性基因控制(图2)。82个洼地绵羊个体MHC-DRB1经SacⅠ酶切后的基因频率和基因型频率见表1。
在HaeⅢ酶切位点上,82个洼地绵羊个体上出现了12种基因型,即AA、CC、DD、BB、EE、BC、BE、DE、CD、AD、AE、AC,有5种复等位基因,即A(159 bp/137 bp)、B(159 bp/123 bp/14 bp)、C(159 bp/71 bp/52 bp/14 bp)、D(225 bp/71 bp)、E(159 bp/66 bp/71 bp)控制(图3)。5种等位基因中A、B、C、E与Konnai S等[6]报道的绵羊酶切图谱中6种等位基因中的4种相同,分别是等位基因c(159/137)、d(159 bp/123bp/14 bp)、e(159 bp/66 bp/71 bp)、f(159 bp/71 bp/52 bp/14 bp)。同时确定了12个基因型,5个纯合型和7个杂合型。82个洼地绵羊个体MHC-DRB1经HaeⅢ酶切后的基因频率和基因型频率见表1。此外,本研究发现的5种等位基因中,D等位基因是一种新的等位基因,在以前的研究中并未发现[7-9]。

图1 套式PCR扩增产物的检测结果Fig.1 Detecting results of nested PCR products

图3 DRB1基因的HaeⅢ酶切鉴定Fig.3 Identificationn of DRB1 gene digested with HaeⅢ

表1 洼地绵羊M HC-DRB1外显子2SacⅠ、HaeⅢ酶切位点的基因型和等位基因及其频率Table1 Genotypes and alleles frequencies at the loci digested withHaeⅢandSacⅠof MHC-DRB1 gene exon 2 in Wadi sheep
2.3 χ2适合性检验结果
采用χ2适合性检验法分析了洼地绵羊MHCDRB1基因外显子2是否处于平衡状态。适合性检验结果表明,洼地绵羊在限制性内切酶SacⅠ、HaeⅢ的χ2值分别是4.608(P<0.05)、41.286(P<0.01),均未达到Hardy-Weiberg平衡状态。
2.4 HaeⅢ酶切目的DNA的测序及序列分析结果
目的DNA测序及序列分析得到5个等位基因(图4)。在82只洼地绵羊MHC-DRB1 exon 2序列长度为296 bp中,共发现41(14%)个变异位点,不包括同一位点出现多种碱基的位点,未发现插入或缺失位点。4种碱基的含量分别为A 22.2%,C 24.4%,G 34.6%,T 18.9%,其中(G+C)为59%,高于(A+T)41.1%。
本研究所获得目的序列编码98个氨基酸(图5),其中69个位点为保守区,29个位点为可变区。20种氨基酸中没有酪氨酸,其他19中氨基酸虽然有使用,但是使用频率差异很大,如丝氨酸使用频率高达19.836,而天冬酰胺的使用频率仅为0.204 5%。丙氨酸、半胱氨酸、天冬氨酸、谷氨酸、苯丙氨酸、甘氨酸、组氨酸、异亮氨酸、赖氨酸、蛋氨酸、亮氨酸、天冬酰胺、脯氨酸、谷氨酰胺、精氨酸、丝氨酸、苏氨酸、缬氨酸、色氨酸的含量分别是7.98%、3.48%、2.05%、2.66%、1.02%、11.24%、1.02%、3.48%、1.43%、3.68%、1.63%、0.20%、5.93%、1.02%、10.63%、19.83%、14.31%、2.86%、5.52%。
利用最大简约法[10],非同义替换率远远大于同义替换率(dn∶ds=5∶1)。

图4 洼地绵羊M HC-DRB1外显子2等位基因核苷酸序列比对结果Fig.4 An alignment of nucleotide sequences among the alleles of MHC-DRB1 exon 2 of Wadi sheep populations.
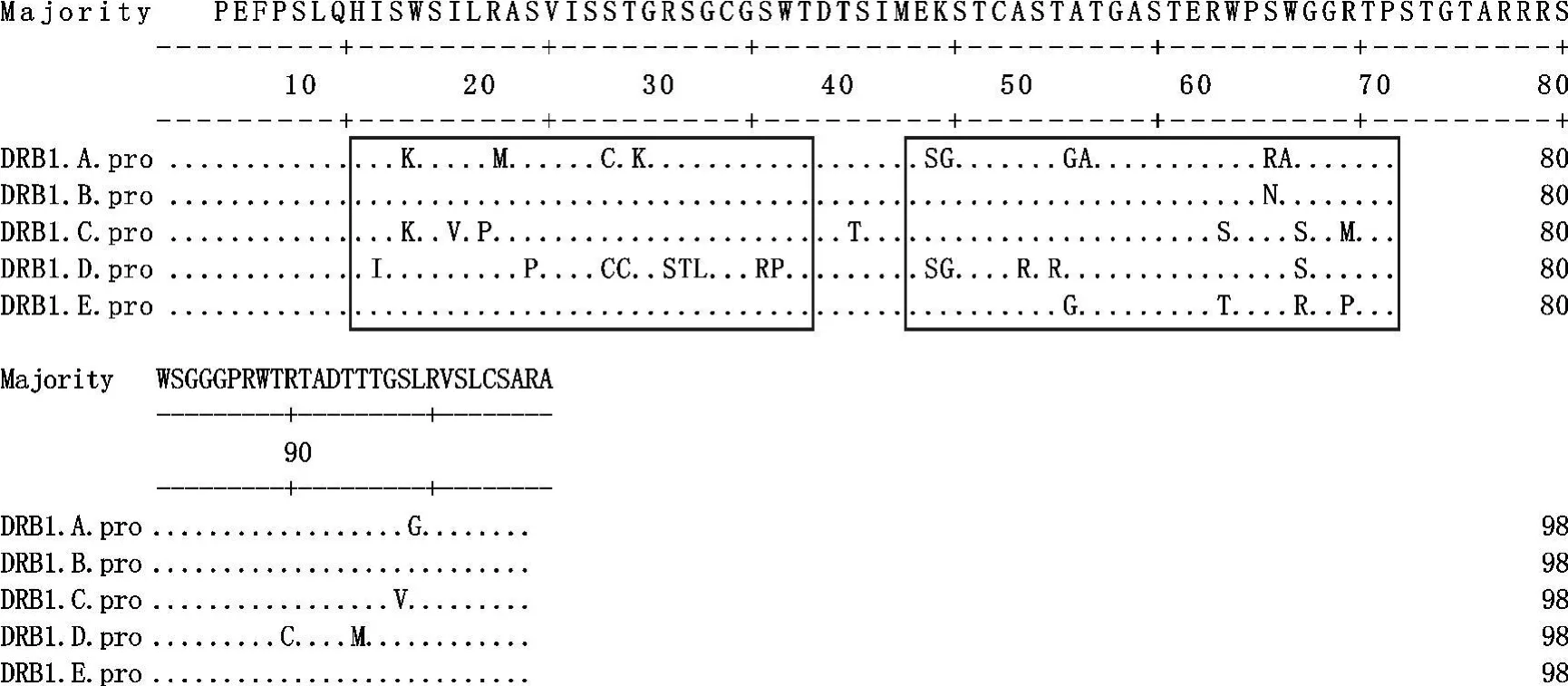
图5 洼地绵羊M HC-DRB1外显子2等位基因氨基酸序列比对结果Fig.5 An alignment of nucleotide sequences among the alleles of MHC-DRB1 exon 2 of Wadi sheep
3 讨论
通过RFLP-PCR技术及序列测序分析了DRB1基因外显子2存在高度多态性。序列测序发现了多种等位基因,等位基因序列比对分析存在丰富的碱基以及氨基酸替代[11]。基因座位上基因的多态性使得基因产物的多样性增加,从而使机体能够在内或外界抗原引起的免疫应答中发挥作用,这一现象在Nino-Vasquez J J等[12]的研究中也有报道。洼地绵羊MHC-DRB1基因外显子2等位基因及基因型χ2适合性检验结果说明,在SacⅠ和HaeⅢ的酶切位点未达到HardyWeinbery(P<0.05)平衡状态。酶切位点的非平衡状态可能是由于基础群体的选择以及研究所选择的绵羊群体中个体数目较少的原因。也可能是由于长期进化过程中一些控制重要生产性状的基因发生了遗传漂移或遗传选择的原因。
在本研究的洼地绵羊群体中发现的一种新的等位基因DRB1.D与萨福克羊群、多浪羊[13]群体中的DRB1基因的等位基因不同。本文提供了一种新抗病的等位基因,该种群特异性的等位基因可能是由于自然选择的结果。但是,MHC-DRB1等位基因与绵羊抗某种疾病的相关性还需要进一步研究。而本文洼地绵羊群体MHC-DRB1基因中另外4种等位基因与萨福克羊群[2]、多浪羊[13]群体中的DRB1基因的等位基因是相同的,然而基因型却不尽相同,这可能是由于绵羊群体生存的微环境相同或类似,如气候、生态环境、地理环境等因素,而这些因素可能都会对其产生影响。
一般认为,自然选择主要在蛋白质水平上起作用,同义突变不造成氨基酸顺序的任何变化,因而,同义突变被当作选择上呈中性突变的侯选者。本研究计算了dn/ds,远高于1。这说明非同义位点的进化速度要高于同义位点,这一特点也可能使得新的基因变异产生和多态性增加,也为MHC基因适应同样不断变化的抗原创造了条件[14]。
[1] Klein J.Natural history of the major histocompatihility complex[M].New York:John Wiley&Sons,1986.
[2] Li M H,Li K,Kantanen J,et al.Allelic variations in exon 2 of caprine MHC classⅡDRB3 gene in Chinese indigenous goats[J].Small Ruminant Res,2006,66:236-243.
[3] Zhao T M.Principle and application of HLA typing[M].Shanghai:Shanghai Science and Technology Press,1984.
[4] Garrigan D,Hedrick P W.ClassI MHC polymorphism and evolution in endangered California Chinook and other Pacific salmon[J].Immunogenetics,2001,53(6):483-489.
[5] Gruszczy nska J,Brokowska K,Charon K M,et al.Restriction fragment length polymorphism of exon 2 Ovar-DRB1 gene in polish heath sheep and polish low land sheep[J].J Appl Genet,2005,46(3):311-314.
[6] Konnai S,Nagaoka Y,Nagaoka S,et al.Technical note:DNA typing for ovine MHC DRBI using polymerase chain reaction fragment length polymo rphlsm(PCR-RFLP)[J].J Dairy Sci,2003,86(10):3362-3365.
[7] 贾 斌,申 红,余智勇,等.多浪羊和中国美利奴羊MHCDRB1基因多态性与包虫病的遗传易感性[J].中国人兽共患病学报,2007,23(10):1004-1012.
[8] Larruskain A,Minguijón E,García-Etxebarria K,et al.MHC class II DRB1 gene polymorphism in the pathogenesis of Maedi-Visna and pulmonary adenocarcinoma viral diseases in sheep[J].Immunogenetics,2010,62(2):75-83.
[9] Sayers G,Good B,Hanrahan J P,et al.Major histocompatibility complex DRB1 gene:its role in nematode resistance in Suffolk and T exel sheep breeds[J].Parasitology,2005,131(3):403-409.
[10] Nei M,Gojobori T.Simple methods for estimating the numbers of synonymous and nonsynonymous nucleotide substitutions[J].Mol Biol,1986,3(5):418-426.
[11] 蒋 梅,杨 勇,杨仕标,等.猪PLTP基因的PCR扩增及多态性检测[J].动物医学进展,2009,30(6):50-53.
[12] Nino-Vasquez J J,Vogel D,Redriguez R.Sequence and diversity of DRB genes of Aotus nancymaae,a primate model for human malaria parasites[J].Immunogenetizcs,2000,51(3):219-230.
[13] 彭林泽,袁其彬,郭玉强,等.多浪羊M HC-DRB1基因的HaeⅢ酶切多态性[J].石河子大学学报:自然科学版,2007,25(2):177-179.
[14] Ballingall K T,Fardoe K,McKeever D J.Genomic organisation and allelic diversity within coding and non-coding regions of the Ovar-DRB1 locus[J].Immunogenetics,2008,60(2):95-103.
