青蒿琥酯对人卵巢癌细胞诱导血管新生的抑制效应
2011-03-06杨素梅刘可玲王立敏高建宏李华高玉霞
杨素梅 刘可玲 王立敏 高建宏 李华 高玉霞
卵巢癌患者病死率在女性生殖道肿瘤中居首位。高转移率和复发率导致卵巢癌患者5年生存率长期徘徊在30%左右。肿瘤的侵袭与转移依赖于肿瘤新生血管形成。血管新生(angiogenesis)是指在原有血管基础上形成新的微小血管,是大多数恶性肿瘤生长和转移的前提[1]。本实验通过研究青蒿琥酯(artesunate,ART)对人卵巢癌CAOV3细胞促血管新生效应的影响及其机制,以进一步明确ART抗卵巢癌作用机制,探索卵巢癌治疗新途径。
1 材料与方法
1.1 药物与试剂 人卵巢癌CAOV3细胞由上海细胞生物研究所提供。ART购于桂林南药股份有限公司(批号:090902;批准文号,国H:10930187),使用前5%碳酸氢钠注射液溶解。血管内皮生长因子(VEGF)、酶联免疫吸附法(ELISA)检测试剂盒购于深圳晶美生物技术有限公司。
1.2 细胞培养 人卵巢癌CAOV3细胞在含10%胎牛血清、青霉素100 U/ml、链霉素100 μg/ml的RPMI-1640中37℃、5% CO2培养箱常规培养。取处于对数生长期的卵巢癌CAOV3细胞,分别给予不同浓度ART处理(ART处理组)。单纯RPMI-1640培养基为阴性对照,无药物作用的卵巢癌CAOV3细胞为阳性对照。
1.3 条件培养液收集 按照Kini等[2]的方法,首先将卵巢癌CAOV3细胞放入RPMI-1640不加或加入不同浓度的ART中培养48 h,然后用RPMI-1640将RPMI-8226细胞冲洗3次,并在无血清1640液中孵育4 h;收集细胞后用无血清1640液稀释至1×106个/ml,继续培养24 h。台盼兰排除试验检测卵巢癌CAOV3细胞的活力 >95%。无菌条件下 1 200 r/min和12 000 r/min分别离心10 min,制条件培养液,保存于-80℃。
1.4 主动脉环体外生长实验 取大鼠胸主动脉,切成1 mm长的主动脉环。首先将1.2 mg纤维蛋白原和0.5 U牛凝血酶溶于无血清培养液MCDB-131,加于24孔板,待形成凝胶后,放入主动脉环,再加入纤维蛋白原和牛凝血酶,使成凝胶,以固定新生血管,加入培养液MCDB-131 1 ml,放入37°C、5%CO2培养箱里培养。在前 3 d,培养基中还需加入 ε-氨基己酸(300 μg/ml)以抑制纤维蛋白溶解。3 d后,加入已经准备好的条件培养液,与主动脉环一起孵育。另单独加同容量RPMI-1640作为阴性对照。每天在倒置显微镜下观察新生血管生长情况,直到第15天血管生成达到高峰。每组取6个主动脉环,计数新生血管数。
1.5 鸡胚绒毛尿囊膜(CAM)体内血管生长实验 将孵化4 d的鸡胚,在近气室处开0.5 cm×1.0 cm窗,暴露接种部位(CAMs)。置孵箱内稳定24 h后,按如下方式分组处理:(1)阴性对照组:浸有RPMI-1640约1 mm3大小的可吸收明胶海绵,无菌置于鸡胚CAM,作为阴性对照组。(2)单纯CAOV3细胞组:在第6天,将浸有100 μl CAOV3细胞悬液(CAOV3细胞含量为5×106)的可吸收明胶海绵,无菌置于鸡胚CAM。(3) ART处理组:将阴性对照组鸡胚额外孵育1 d后,在第8天取出部分鸡胚,给予不同浓度的ART。所有接种后的鸡胚用消毒的半透明封口膜封口,窗垂直向上,送回孵箱中孵育。每天检查CAM直到第12天,小心剥离各鸡胚CAM,用固定液(甲醇、丙酮等比混合液)固定后拍照。
1.6 ELISA测定 终浓度为0、3、6和12 μmol/L ART处理CAOV3细胞48 h后,收集条件培养液。按照人VEGF ELISA检测试剂盒说明书操作,测定条件培养液中VEGF含量。最小检测限度为30 pg/L。所有实验重复3次。
1.7 统计学分析 采用SPSS 10.0统计软件计量资料以¯x±s表示,采用Dunnett’st检验,P<0.05为差异有统计学意义。
2 结果
2.1 ART对大鼠主动脉环血管生成的影响 单纯CAOV3细胞组第3天起镜下可见有新生血管生成,第7~13天新生血管迅速增多,第14天后血管生成减慢并逐渐减少。ART预处理组新生血管形成以时间依赖方式减少,且形成时间明显滞后,于第7~10天镜下才观察到有新生血管出现。同时ART处理组血管萌芽密度明显降低。至第14天,阴性对照组新生血管数为(61.2±6.3);3、6和12 μmol/L ART预处理组新生血管数分别为(53.2±3.9)、(32.8±4.1)和(12.6±2.8)μmol/L,与单纯CAOV3细胞组新生血管数(129.5±8.9)μmol/L比较差异有统计学意义(P<0.01)。
2.2 ART对CAOV3细胞诱导的CAM血管新生的影响 与阴性对照组比较,单纯CAOV3细胞组表现出很强的刺激血管新生能力,众多新生微血管呈放射状排列于海绵周围,血管密度、分支明显增多,管径增粗。而ART处理组刺激血管新生能力明显减弱,血管密度、分支减少,管径变细。3、6和12 μmol/L ART处理组与单纯RPMI-8226细胞组比较,微血管数目分别减少21.9%,38.24%,76.9%(P<0.01)。见图1,表1。
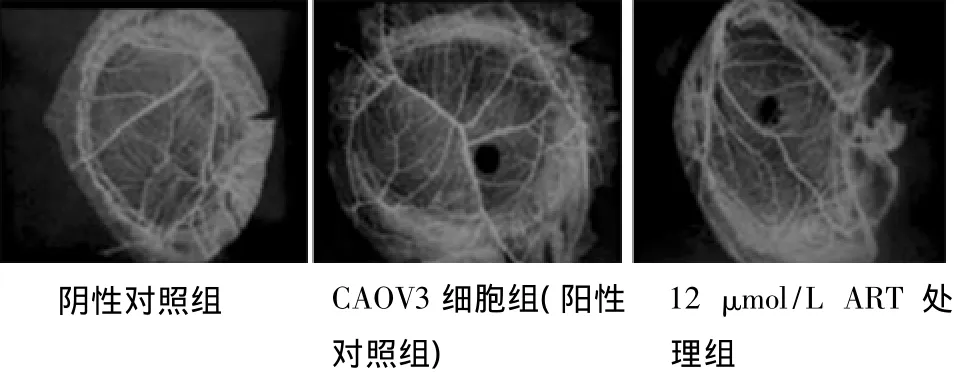
图1 ART对鸡胚绒毛尿囊膜血管生成试验中CAOV3细胞诱导血管新生的影响

表1 各ART处理组鸡胚绒毛尿囊膜血管数
2.3 ART对CAOV3细胞条件培养液中VEGF含量的影响单纯CAOV3细胞组中VEGF含量为(587±62)pg/ml。与单纯CAOV3组相比,经3、6、12 μmol/L ART处理的RPMI-8226细胞条件培养液中VEGF含量以剂量依赖方式下降,分别为(462± 72)、(232±44)和(151±14)pg/ml,差异有统计学意义(P<0.05)。
3 讨论
卵巢癌是致死率最高的女性生殖系统恶性肿瘤,易于转移和复发是其致死的主要原因,肿瘤浸润和转移依赖大量肿瘤新生血管形成。研究发现:癌组织中存在显著血管生成现象[3];多项卵巢癌病例回顾性研究亦提示,卵巢癌组织微血管密度与临床分期有关,是该疾病生存和复发的独立预后因素[4]。在本研究血管生成实验中,与对照组、药物干预组相比,卵巢癌细胞组的主动脉环血管萌芽数和鸡胚尿囊膜血管密度均显著增加,进一步提示卵巢癌细胞具有极强促血管生成能力。
ARI是半合成的青蒿素衍生物,其高效低毒的抗疟效应得到肯定,同时其对多种实体肿瘤细胞表现出的生长抑制作用也越来越引起国内外学者注意[5]。汪向红等[6]用不同浓度ART处理体外培养的人卵巢癌CAOV3细胞,结果显示ART可显著抑制CAOV3细胞增殖。近年来有报道认为ART具有抗肿瘤血管新生的作用[7]。体外研究显示ART可通过减少VEGF表达,抑制白血病K562细胞诱导的血管新生;体内实验亦发现ART可强烈抑制Kaposi肉瘤鼠模型肿瘤组织内血管的发生发展[8]。但ART对人卵巢癌细胞诱导血管新生的影响作者尚未见报道。本研究选用3个较低浓度ART(3、6、12 μmol/L,胎盘蓝拒染实验证实细胞活力 >95%)[9],观察其对人卵巢癌CAOV3细胞诱导血管新生的影响。体外主动脉环培养实验结果显示:与单纯CAOV3细胞组相比,ART处理组主动脉环上血管萌芽形成明显推迟,密度显著减少。提示ART对人卵巢癌CAOV3细胞条件培养液诱导的血管新生具有抑制作用。体内CAM血管生长实验结果亦支持上述结论:与单纯CAOV3细胞组相比,ART处理组血管分支明显减少,密度显著下降。进一步表明ART具有抗人卵巢癌CAOV3细胞诱导血管新生的能力。结合汪向红等[6]发表的实验数据,本研究认为ART具有抑制人卵巢癌细胞增殖分化、干扰卵巢癌血管新生的双重作用。其抗血管新生作用机制一方面与ART直接抑制血管萌芽形成等血管新生过程有关,另一方面还可能与ART间接影响促血管新生调控因子表达有关[10]。
VEGF是血管形成过程中最强有力的调控因子,其与内皮细胞表面受体特异性结合,促进内皮细胞增殖、迁移,并最终形成新生血管。许多卵巢癌患者血浆VEGF水平明显高于正常人,是判断卵巢癌进展、转移等临床过程的重要标记物[10]。本研究发现,较低浓度ART即可抑制人卵巢癌CAOV3细胞分泌VEGF。VEGF表达减少一方面可能加强ART抑制肿瘤血管新生的效应;另一方面还可能减弱VEGF对卵巢癌细胞自分泌增殖促进作用[11],抑制癌细胞增殖和转移,发挥抗肿瘤效应。由此可见,ART很可能为卵巢癌临床治疗提供一条新途径。
1 Bertolini F,Mancuso P,Shaked Y,et al.Molecular and cellular biomarkers for angiogenesis in clinical oncology.Drug Discov Today,2007,12: 806-812.
2 Kini AR,Peterson LA,Tallman MS,et al.Angiogenesis in acute promyelocytic leukemia:induction by vascular endothelial growth factor and inhibition by all-trans retinoic acid.Blood,2001,97:3919-3924.
3 王前,李新国,张怡,等.卵巢癌组织中EVEC的表达及其生物学意义.中华肿瘤杂志,2010,32:676-680.
4 Raspollini MR,Amunni G,Villanucci A,et al.Prognostic significance of microvessel density and vascular endothelial growth factor expression in advanced ovarian serous carcinoma.Int J Cynecol Cacer,2004,14:815-823.
5 He RR,Zhou HJ.Progress in research on the ant-tumor effect of artesunate.Chin J Inteqr Med,2008,14:312-316.
6 汪向红,蒋依玲,范妮娜,等.青蒿琥酯对人卵巢癌细胞株增殖及p38通路的影响.中国医院药学杂志,2010,30:214-217.
7 Zhou HJ,Wang WQ,Wu GD,et al.Artesunate inhibits angiogenesis and downregulates vascular endothelial growth factor expression in chronic myeloid leukemia K562 cells.Vascul Pharmacol,2007,47:131-138.
8 Dell'Eva R,Pfeffer U,Vene R,et al.Inhibition of angiogenesis in vivo and growth of Kaposi's sarcoma xenograft tumors by the anti-malarial artesu-nate.Biochem Pharmacol,2004,68:2359-2366.
9 Chen H,Shi L,Yang XY,et al.Overexpression of Ang-1 in multiple myeloma cells and supression of angiogenesis by artesunate through inhibtion of Ang-1 and VEGF expression.Int J Hematol,2010,92:587-597.
10 Chen HH,Zhou HJ,Wu GD,et al.Inhibitory effects of artesunate on angiogenesis and on expressions of vascular endothelial growth factor and VEGF receptor KDR/flk-1.Pharmacology,2004,71:1-9.
11 胡元晶,曲凡凡.VEGF及其受体在上皮性卵巢癌中的表达及与血管生成的关系.中国肿瘤临床,2006,33:1346-1349.
