花椒多酚类化合物对慢性应激抑郁大鼠的治疗作用机制研究
2011-03-06木海鸥
周 皎 ,木海鸥 ,王 玮
(1.浙江省温州市第三人民医院,浙江 温州 325000; 2.温州医学院附属第二医院,浙江 温州 325027)
抑郁症是一种情感障碍性精神疾病,其终生患病率为5.2% ~16.2%,女性高达25%[1]。抑郁症的发生机制涉及到交感神经系统、内分泌系统和免疫系统等多个方面[2]。慢性应激较好地模拟了人类抑郁样症状,其主要特征为机体受到内外环境刺激后发生下丘脑-垂体-肾上腺轴功能失调及免疫系统功能紊乱,由此引发各种行为和功能的改变[3-4]。花椒多酚类化合物(ZPPC)为芸香科植物青椒 Zanthoxylum schinifolium Sieb.et Zucc.或花椒 Zanthoxylum bungeanum Maxim.的干燥成熟果皮,具有温中止痛、驱虫、外用燥湿、杀虫止痒的功效[5],主要化学成分为生物碱、酰胺、木脂素、香豆素、挥发油和脂肪酸等。笔者以四川汉源花椒为研究对象,研究了花椒总多酚类化合物的抗抑郁作用,现报道如下。
1 材料与方法
1.1 实验材料
动物:雄性SD大鼠,二级,体重200~220 g。饲养条件为每笼4只,温度(24±1)℃,相对湿度(50±10)%,自然光照,昼夜节律,自由摄食饮水。所有动物适应环境3 d后开始试验,试验前禁食10 h,饮水自由。
试药:花椒购自四川九襄;粉碎后用丙酮-水溶液(7∶3)浸提,减压除去浸提液中丙酮,然后过滤残留水液,将滤液经醋酸乙酯萃取分离,脱水干燥,得到ZPPC总粗提取物(得率为0.033%),为黄棕色粉末,试验前用双蒸水配成所需浓度。丙咪嗪、皮质酮和白细胞介素1β(IL-1β)酶联免疫吸附试剂盒均购自美国RD公司。其他常规试剂均为分析纯。
仪器:DigBehv动物行为分析系统(上海吉量软件科技有限公司);BS110S型分析天平(北京赛多利斯仪器公司);医用离心机(金坛市医疗器械厂);DMSL型轮转式切片机(金华科迪仪器设备有限公司);550型全自动酶标仪(美国Bio-Rad公司)。
1.2 实验方法
1.2.1 大鼠慢性应激模型的建立与分组
按文献[6]方法制作大鼠模型。每日测定体重,按体重连续给药21 d,第21天进行行为测试,断头杀鼠。将40只慢性应激模型大鼠随机均分为5组,即应激模型组,低、中、高剂量ZPPC组和丙咪嗪组。低、中、高剂量ZPPC组分别于测试前60 min按体重灌胃给予50,100,200 mg/kg的ZPPC;丙咪嗪组于测试前30 min按体重腹腔注射以双蒸水溶解为10 mg/kg的丙咪嗪。另取8只正常大鼠,设为正常对照组,正常对照组和应激模型组均灌胃给予等体积双蒸水。
1.2.2 开野试验[7]
在给予慢性应激21 d后,各组大鼠均开始本试验。正方形开野实验箱为80 cm×80 cm×75 cm,底板用笔画成10 cm×10 cm的方格,其正上方距离底板90 cm高处放一只60 W白炽灯泡。将大鼠放于开野箱中央测试10 min,观察后5 min内大鼠的活动情况,包括自主活动次数(方格间穿行次数)、竖起及探究次数(两前肢离地1 cm以上的次数)。
1.2.3 大鼠强迫游泳试验[8]
在连续给予ZPPC 14 d后进行试验。正式测试前24 h,将大鼠置水深23 cm的玻璃圆缸(高 40 cm,直径 18 cm)内,水温(24±1)℃,作强迫游泳训练15 min。在末次给药后60 min(ZPPC,灌胃给药)或30 min(丙咪嗪,腹腔注射给药),再次将大鼠置水深23 cm的玻璃圆缸内强迫游泳5 min,观察并记录5 min内大鼠的不动时间。当大鼠停止挣扎,浮在水中保持不动,或仅做一些必要的轻微动作保持头部浮在水面上的时间视为不动时间。
1.2.4 血清皮质酮和IL-1β水平测定
取全血5~10 mL,室温放置20 min后以1 000 r/min转速离心10 min,分离血清,-20℃冻存备用。用酶联免疫吸附试验双抗体夹心法测定大鼠血清中皮质酮和IL-1β的含量,严格按照试剂盒使用说明操作。
1.2.5 肾上腺皮质厚度测定
大鼠处死后摘取肾上腺,放入10%甲醛溶液固定,经脱水、透明、包埋后切片,HE染色镜检、照相。采用图像分析软件测定肾上腺皮质厚度。
1.3 统计学方法
采用SPSS 13.0统计软件包进行统计学处理,数据以均数±标准误(±s)表示,药物作用以单向方差分析方法进行分析,组间差异(P <0.05)采用 Dunnett’s t检验。
2 结果
2.1 对开野箱中活动性的影响
如表1所示,与正常大鼠相比,慢性应激模型大鼠爬行格数、竖立及探究次数均明显减少(P<0.001);而在给予不同剂量(50,100,200 mg/kg)ZPPC后,应激大鼠行为明显改善,爬行格数、竖立及探究次数均出现不同程度的增加。
表1 ZPPC对慢性应激大鼠活动性的影响(± s,n=8)

表1 ZPPC对慢性应激大鼠活动性的影响(± s,n=8)
注:与正常对照组比较,#P<0.001;与应激模型组比较,*P<0.01,▲P <0.001。
正常对照组应激模型组低剂量ZPPC组中剂量ZPPC组高剂量ZPPC组丙咪嗪组50 100 200 10 54.4 ±8.8 26.1 ±7.6#32.8 ±4.5*41.0 ±4.8▲52.9 ±5.2▲4.3 ±0.7▲20.0 ± 3.5 7.1 ± 4.0#11.1 ± 4.0*15.6 ± 3.4▲20.3 ± 2.9▲4.6 ± 0.8*
2.2 对强迫游泳不动时间的影响
与正常大鼠相比,慢性应激模型大鼠在强迫游泳中的不动时间大幅增加,差异有显著性(P<0.001);ZPPC能剂量依赖性地减少应激大鼠的强迫游泳不动时间(P<0.05,P<0.01,P<0.001)。结果见图1。

图1 ZPPC对慢性应激大鼠强迫游泳不动时间的影响(± s,n=8)
2.3 对肾上腺皮质厚度及血清皮质酮水平的影响
与正常大鼠相比,应激大鼠肾上腺皮质厚度明显增加(P<0.001),而给药组大鼠的肾上腺皮质厚度较应激模型组均有所减少(P<0.01)。同时,应激模型组大鼠血清皮质酮含量明显高于正常对照组大鼠(P<0.001),各给药组皮质酮含量明显下降,与应激模型组相比差异有显著性(P <0.05,P <0.01,P <0.001)。结果见表 2。
表2 ZPPC对慢性应激大鼠肾上腺皮质厚度和血清皮质酮质量浓度的影响(± s,n=8)

表2 ZPPC对慢性应激大鼠肾上腺皮质厚度和血清皮质酮质量浓度的影响(± s,n=8)
注:与正常对照组比较,#P<0.001;与应激模型组比较,*P<0.05,△P <0.01,▲P <0.001。
组别正常对照组应激模型组低剂量ZPPC组中剂量ZPPC组高剂量ZPPC组丙咪嗪组剂量(mg/kg)50 100 200 10肾上腺皮质厚度(μm)693.1 ± 5.8 959.6 ± 3.7#756.6 ±6.2△725.3 ±6.0△715.4 ±3.6△699.3 ±9.0▲皮质酮质量浓度(ng/mL)64.4 ±9.3 101.1 ±6.9#93.5 ±10.3*83.5 ±6.7△75.4 ±4.5▲70.1 ±7.8▲
2.4 对血清IL-1β水平的影响
如图2所示,应激模型组大鼠血清IL-1β水平显著高于正常对照组(P<0.001),50,100,200 mg/kg ZPPC 组和丙咪嗪 10 mg/kg组对慢性应激所致IL-1β水平上升具有明显的抑制作用,与应激模型组相比差异有显著性(P <0.05,P <0.01,P <0.001)。
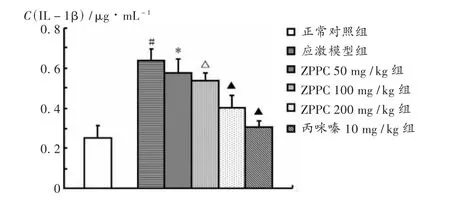
图2 ZPPC对慢性应激大鼠血清IL-1β水平的影响(± s,n=8)
3 讨论
抑郁症的病因尚不能彻底阐明,目前认为长期慢性、低水平的应激源是促进抑郁发生、发展的主要原因。慢性不可预知性大鼠应激模型就是根据此理论建立的,其特点是应激因子的多变性和不可预知性,这一模型已成为国内外学者探讨抑郁症发病机制和抗抑郁药作用机理时广泛应用的动物模型[9]。
本试验中大鼠经21 d的慢性综合性应激后,在开野试验中5 min内的爬行格数和探究次数明显减少,说明应激模型组大鼠活动能力下降、紧张程度增加且兴趣丧失;本试验用经典的大鼠强迫游泳试验来反映大鼠对绝望的反应程度,游泳不动时间增加提示大鼠对环境的绝望增加。而在给予慢性应激大鼠不同剂量(50,100,200 mg/kg)ZPPC灌胃治疗后,大鼠活动性增强,对外周环境的探究兴趣增加,在强迫游泳中的绝望不动时间也减少,提示ZPPC可以显著改善应激大鼠的抑郁症状,增加抑郁大鼠的活动性及对绝望的抵抗能力。
越来越多的研究显示[10],神经-内分泌-免疫系统之间存在着复杂的相互关系,免疫功能低下是抑郁症的特征之一。ZPPC和经典抗抑郁药丙咪嗪不仅能逆转应激抑郁大鼠行为表现的异常,对抑郁大鼠肾上腺出现的病理改变,如皮质增生、肥厚等也有明显改善作用。本试验中慢性应激模型大鼠血清IL-1β水平显著升高,说明抑郁大鼠的免疫功能低下。给予ZPPC治疗后该水平显著下降,提示ZPPC很可能还通过改善免疫功能而减轻抑郁症状。总之,ZPPC可以改善慢性应激导致的肾上腺结构和功能的失衡,调整免疫和内分泌系统的功能,从而具有抗抑郁效果。
[1]刘顺发.我国抑郁症患病情况的流行病学研究现状[J].医学文选,2006,25(4):861-863.
[2]Szelényi J,Selmeczy Z.Immunomodulatory effect of antidepressants[J].Curr Opin Pharmacol,2002,2(4):428-432.
[3]Chrousos GP,Gold PW.The concept of stress and stress system disorders.Overview of physical and behavioral homeostasis[J].JAMA,1992,267(9):1 244-1 252.
[4]Irwin M.Stress-induced immunesuppression:roleoftheautonomic nervous system[J].Ann NY Acad Sci,1993,692(1):203-218.
[5]凌智群,魏居国,程宝宏,等.花椒功效的初步考证[J].陕西中医学院学报,2008,31(4):73.
[6]Molina VA,Volosin M,Cancela L,et al.Effect of chronic variable stress on monoamine receptors: influence of imipramine administration[J].Pharmacol Biochem Behav,1990,35(2):335-340.
[7]Kalynchuk LE,Pinel JP,Treit D,et al.Changes in emotional behavior produced by long-term amygdala kindling in rats[J].Biol Psychiatry,1997,41(4):438.
[8]Porsolt RD,Anton G,Blavet N,et al.Behavioral despair in rats:a new model sensitive to antidepressant treatments[J].Eur J Pharmacol,1978,47(4):379-391.
[9]Pariante GM,Miller AH.Glucocorticoid receptors in major depression:relevance to pathophysiology and treatment[J].Biol Psychiatry,2001,49(5):391-404.
[10]Connor TJ,Leonard BE.Depression,stress and immunological activation:the role of cytokines in depressive disorders[J].Life Sci,1998,62(7):583-606.
