运动减肥对肥胖儿童少年红细胞膜磷脂酰丝氨酸外翻及ATPase酶活性的影响
2011-03-03赖爱萍陈文鹤
赖爱萍,陈文鹤
1 前言
随着全球儿童少年肥胖率的增加,儿童少年期肥胖对健康造成的危害越来越引起重视。儿童少年肥胖特别是儿童期后几年和青春期时的肥胖以及随之而来的健康风险会延续到成年,一些过去认为只有在成人期才会出现的慢性疾病如糖尿病、高血压、高脂血症等已经在肥胖儿童少年中出现,提示了肥胖对儿童少年糖、脂代谢的负面影响,血脂异常和高胰岛素血症是目前在肥胖儿童少年中最常见的糖、脂代谢紊乱表现。然而,在实际观察中,不是所有的肥胖儿童少年特别是年纪较小的儿童中其血脂和脂蛋白水平都会被即时检测出异常,但这并不能说明这些肥胖者脂代谢正常,而可能是因为脂代谢紊乱的早期尚不足以引起血脂的变化。事实上,由于红细胞膜结构和功能特点,在肥胖儿童少年血脂水平尚在正常范围值之时,红细胞膜脂质成分可能已经发生了异常变化。正常红细胞膜脂质双层中脂类分子呈不对称性分布,其外层脂类富含卵磷脂(PC)和鞘磷脂(SM),内层脂类以磷脂酰丝氨酸(PS)和脑磷脂(PE)为主,但异常情况下(如细胞凋亡)PS可从细胞膜的内侧翻转到细胞膜的表面,暴露在细胞外环境中,称为红细胞膜磷脂外翻(PS外翻)。研究显示,膜脂质改变会通过红细胞膜 PS外翻量的变化体现出来[15],而肥胖者所处的高氧化压力可能会诱导其增加[8],对肥胖儿童少年红细胞膜PS外翻的研究迄今为止未见报道,也未见运动减肥所致的体重下降对其影响的报道,本研究通过流式细胞技术研究肥胖儿童少年红细胞膜PS外翻水平及运动减肥干预对其的影响,并结合运动前后膜ATPase酶活性的改变分析红细胞膜氧化压力的变化,为早期监测儿童少年脂代谢紊乱以及探讨运动减肥对脂代谢影响的机制提供理论依据。
2 研究对象与方法
2.1 研究对象
参加2008年上海暑期封闭运动减肥夏令营的肥胖儿童少年64名,均为华东地区汉族人,入营前除了参加各自校内规定的体育课以外均无额外的体育锻炼。年龄14.08 ±3.91岁,BM I 29.34±4.90,其中男性27名,年龄13.41 ±3.62岁,女性37名,年龄14.55±4.08岁。根据生物电阻抗法所测得的体脂百分比将研究对象分为3组:轻度肥胖组(30%~35%)、中度肥胖组(35%~40%)和重度肥胖组(>40%)。入营前均接受专业医生体格检查和病史询问,否认传染病史和重要脏器疾病史,否认曾使用减肥药物疾病史。本研究过程经上海体育学院伦理委员会批准,获受试者本人及家长同意并签署书面同意书。
2.2 研究方法
入营后每位营员的饮食均由专业营养人士根据各自实际情况和儿童少年发育特点进行配餐和分餐,热能供给比例约为糖∶脂肪∶蛋白质=60%~70%∶10%~15%∶20%~25%,每天用盐<6 g,保证营养素供能的均衡合理、热能的充足摄入以及食物来源的多样化并进行每周定期的健康教育。2天饮食适应期后作清晨空腹肘静脉取血共13 ml,3 m l置分离胶促凝管测血脂6项,4 ml置肝素抗凝管,取0.2 ml做流式分析 PS外翻量,其余离心取红细胞膜,取血后由专人对营员做身体形态测试,测试过程均在上海市民体质中心完成。4周有氧运动减肥结束后对上述指标再次检测,第2次的测试安排在有氧运动结束后的第2天清晨(约距前1天运动结束18~20 h),以此避免急性运动的影响。
2.2.1 运动处方
为制定合理的运动处方,每位受试者均先进行递增运动负荷试验:安静心电图描记后受试者在平板跑台进行4 km/h,6 km/h和8 km/h 3个递增定量负荷的运动试验,每级负荷持续2 min后,描记负荷后即刻心电图。若心电图出现明显异常、或心率超过最大心率的80%、或受试者主观无法继续坚持试验时终止试验。运动负荷试验结束后描记运动后1 min的恢复心电图,在此基础上,由运动专家开设个人运动处方。入营后按此运动处方进行为期4周的有氧运动,运动减肥的运动强度大约在心率储备的20%~40%(心率储备=最高心率-安静心率),运动强度的个体差异较大,一般不宜超过40%,即运动减肥的运动强度较小,运动减肥采用中、小强度运动的原因在于减肥运动必须保证充分的氧供应[1]。运动频率为每周6天,包括晨练,每天2次,运动时间持续为4周。每次运动时间为120 min(上午:10:00—12:00;下午:15:00—17:00),包括准备活动、正式运动、整理活动。运动形式选择强度易控制且简单易学的方式如球类、游泳、健身操等。POLAR表用于监测运动中心率并由运动人体科学本科以上背景的人员进行全程运动强度跟踪监控,专业医务人员做运动医务监督。
2.2.2 血脂6项的检测
总胆固醇(TC)用酶反应法、甘油三酯(TG)用乙酰丙酮微量测定法、低密度脂蛋白(LDL-C)用聚乙烯硫酸沉淀法、高密度脂蛋白(HDL-C)用磷钨酸镁测定法、载脂蛋白A(APO-A)和载脂蛋白B(ApoB)用免疫透射比浊法。均在全自动生化分析仪上完成。
2.2.3 红细胞膜 ATPase活性(Na+K+-ATPase和 Ca2+Mg2+-ATPase)的测定
1.红细胞膜制备:肝素抗凝血放4℃离心机以4 000 rpm离心15 min,去除上层白色绒毛状膜成分(即白细胞等)后将压积红细胞用p H为7.4的等渗磷酸盐缓冲液(比例约1∶3)洗涤吹打,重复离心后视红细胞洗涤情况冲洗2~3次,获得压积红细胞。加p H为7.4的低渗tris缓冲液破膜,在4℃冰箱中静置3h后放4℃高速离心机上以12 000 rpm离心30 min,小心吸去暗红色上清液,粉红色沉淀部分再加入低渗tris缓冲液混合均匀后重复离心,可见白色沉淀(红细胞膜),吸上清及离心管底部褐色的纤维蛋白样沉淀斑丢弃,将所制白色血影膜用蒸馏水悬浮,分装于EP管中待测酶活性。
2.酶活性测定:参照南京建成《超微量ATP酶测试盒(Na+K+-ATPase+Ca2+Mg2+-ATPase)测定试剂盒说明书》。所需仪器——722可见分光光度计,SHHW数字显示式恒温水浴箱。
2.2.4 磷脂酰丝氨酸(PS)外翻的检测
Annexin-V是一种分子量为35~36KD的Ca2+依赖性磷脂结合蛋白,能与 PS高亲和力特异性结合。将Annexin-V进行荧光素(FITC)标记,以标记了的Annexin-V作为荧光探针,利用流式细胞仪可检测 PS外翻。本研究使用Beckman Coulter Annexin V-FITC kit试剂盒,采用 Annexin V法进行检测,测定过程参照Beckman Coulter“Annexin VFITC kit说明书”。
2.3 统计学分析
所有数据均在SPSS 16.0统计软件包里完成,所测数据用均数±标准差(±S)表示。数据进行统计分析前先做同质性检验,方差不齐者先经对数转换后取所得的数据进行下一步分析。运动干预前后比较采用配对t检验,运动前各指标相关性分析用 Pearson相关统计法,不同肥胖度人群之间比较用单因素方差分析(ANOVA)。所有的统计检验均采用双侧检验,显著性水平为P≤0.05,非常显著性水平为P≤0.01。
3 结果
3.1 流式细胞技术所测肥胖儿童少年 PS外翻过程(图1、图2)
3.2 不同肥胖度血脂及膜脂水平的ANOVA结果(仅列出有差异性的数据)(表1)
可见不同肥胖度的 PS外翻、HDL有显著差异,而其他指标如 TC、TG等组间均无显著差异(未在表1中显示)。
3.3 肥胖儿童少年运动前血脂、膜PS外翻、形态指标以及酶活性之间的关系(表2)
相关分析发现,TG与BM I及WC、WHR正相关,与以往研究类似。TG与Na+K+-ATPase负相关,而后者与WHR负相关(r=-0.354,P≤0.05,表2中未显示),Ca2+Mg2+-ATPase与Fat%负相关(r=-0.37,P≤0.05,表2中未显示),这些提示了肥胖引起酶活性降低,后者又影响了血脂水平。PS外翻与收缩压相关系数为0.498,但未达显著性意义(P= 0.07,表2中未显示),也并未发现PS外翻与酶活性的直接相关。
3.4 运动干预前后受试者血脂、红细胞膜 PS外翻量及ATP酶活性变化(表3)
图1 获取红细胞示意图
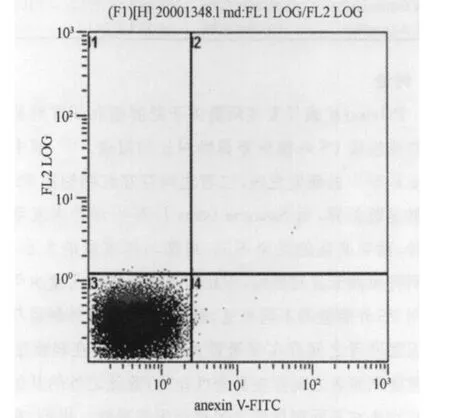
图2 红细胞PS外翻的表达示意图

表1 不同肥胖度儿童少年人群血脂及膜PS外翻ANOVA结果一览表

表2 肥胖儿童少年运动前各指标相关性分析一览表
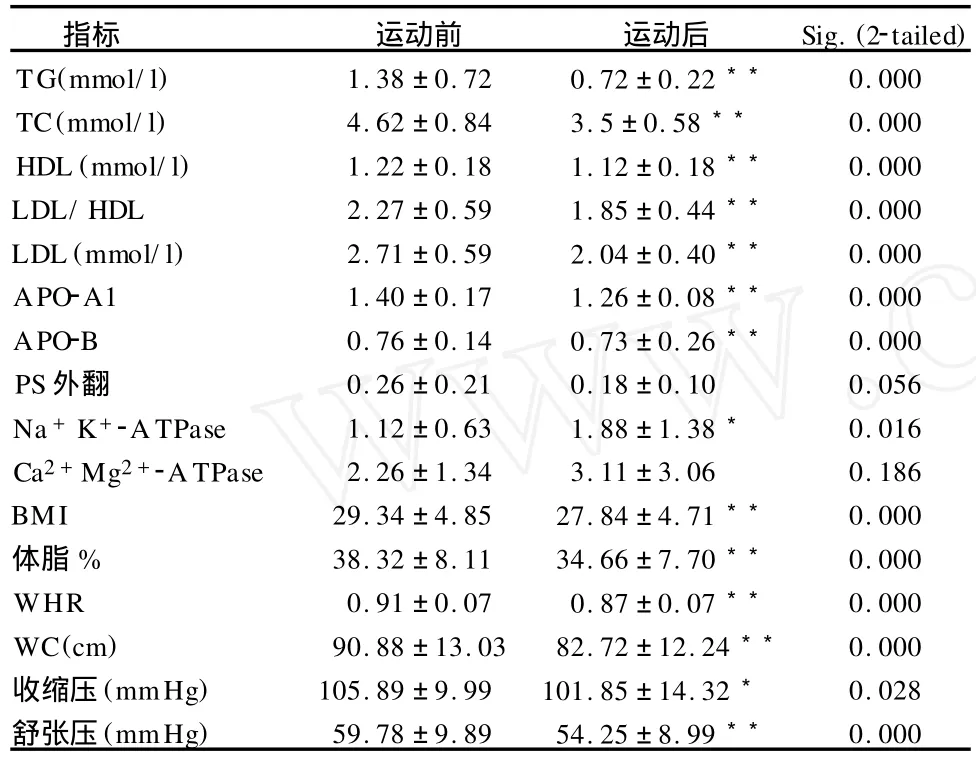
表3 运动干预前后各指标变化一览表
发现4周运动后BM I等形态指标及血压均发生显著变化,Na+K+-ATPase活性显著增加,Ca2+Mg2+-ATPase活性虽有增加,但未呈显著性水平,与运动后血脂指标显著性改善不同的是,运动前后PS外翻量未呈显著性下降,但已经出现下降趋势,提示运动引起的膜脂变化滞后于血脂代谢的改善。
4 讨论
Pubmed检索仅发现两篇关于肥胖组和正常对照组之间红细胞膜 PS外翻量差异性对比的报道[12,13],其中只有SoláE等[13]的研究发现,二者之间存在红细胞膜 PS外翻量的显著差异,而 Samocha-Bonet D等[12]却并未发现组间差异,两项研究的结果不同,可能与样本量的大小有关。本研究虽然未设对照组,但比较不同肥胖度儿童少年各组之间PS外翻量的不同可见,轻度肥胖组PS外翻量与其他两组肥胖者之间存在显著性差异,HDL仅在轻度肥胖者和重度肥胖者之间存在显著性差异,除此之外的其他血脂指标均未在不同肥胖组之间显示出差异性。提示,在儿童少年肥胖的初期,PS外翻量可能比其他血脂指标对儿童少年肥胖的发展更敏感,而 HDL似乎要在肥胖程度较重时才能体现出敏感意义。这一结果说明,在肥胖的发展过程中,当儿童少年血脂水平尚在正常范围之时,红细胞膜脂质成分已经发生了异常变化。这一发现在肥胖儿童少年脂代谢变化的研究中尚属首次,今后有待进一步研究论证。
已有研究分别发现,成年超重肥胖者[7]和儿童超重肥胖者[14]红细胞膜 MDA增加,并与BM I呈正相关(P< 0.05),证实超重肥胖会引起机体红细胞膜氧化应激增加,认为氧化应激的增加是红细胞膜PS外翻增加的一个可能机制[3]。氧化反应中自由基的生成能引起膜脂质过氧化,红细胞膜脂质过氧化连同随后发生的MDA增加,会使翻转酶失活,这反过来会引起红细胞膜 PS外翻的增加。另有研究[9]显示,收缩压和舒张压与膜脂质过氧化反应参数呈正相关而与Na+-K+-ATPase的活性呈负相关,本研究中PS外翻与收缩压相关性虽未达显著性意义(P=0.07,表中未显示)但相关系数为0.498,提示肥胖者PS外翻增加可能的确与氧化状态有关,可能由于肥胖儿童少年血脂代谢的紊乱导致过氧化作用加强,其中间代谢产物作用于红细胞膜磷脂中的磷脂酰丝氨酸(PS),使膜磷脂的量与质变化从而导致膜脂双层结构受到破坏。但本研究未发现PS与酶活性的直接相关,提示肥胖者 PS外翻增加的机制并不仅局限于酶活性的影响。
本研究中4周运动后肥胖儿童少年BM I、体脂%、WC及WHR非常显著性降低(P<0.01),说明本次有氧运动干预对降低肥胖儿童少年全身体脂量、腰腹部脂肪及改善体形效果显著。不仅如此,红细胞膜 Na+K+-ATPase和Ca2+Mg2+-ATPase酶活性增加,其中前者的增高达到显著性水平,这与国内学者[4]对进行不同负荷训练的大鼠红细胞膜ATP酶活性的变化报道结果相似,说明虽然肥胖者和正常人红细胞膜分子水平上对急性运动反应不同[6],但肥胖人群膜Na+K+-ATPase酶活性对运动训练也存在和正常人相似的生理性应激反应,其机制可能与运动引起膜Na+K+-ATPase酶的活化因素——细胞内钠离子增多有关,运动时机体需氧量增加,二氧化碳产量相应增多,红细胞代谢增强导致ATP消耗增多,从而使钠离子流入细胞内,加强了大量钠离子泵出细胞的过程,从而维持了膜内的离子跨膜梯度保持了正常的渗透压。而Ca2+Mg2+-ATPase酶活性的变化对运动干预的反应不显著,可能是因为该酶对运动产生的低氧刺激不敏感所致,也有可能是本次运动干预时间不够长,不足以使其发生显著性变化。
运动对肥胖儿童少年红细胞膜 PS外翻量影响的研究从未有报道,本研究发现,在运动后血压、TC、TG、LDL/ HDL等血脂及脂蛋白指标发生显著性下降的同时,受试者膜PS外翻也呈下降趋势,但与运动后血脂指标非常显著性改善不同,运动前后 PS外翻量差异并未呈显著性(P=0.056),提示,运动引起的膜脂质代谢改善滞后于血浆中脂质变化,今后可以通过增加运动干预结束后一段时间内对被试进行分次红细胞膜抽取,从而对膜中脂质情况跟踪调查来验证。笔者对该状态形成的可能原因做以下推测:1)虽然本次有效的运动减肥干预使肥胖儿童少年降低了体重,从而改善了原本由于肥胖而引起的较高氧化应激状态,但4周的有氧运动干预使肥胖儿童少年又面临着新增加的氧化状态,部分抵消了运动对 PS外翻改善的良好效应。一方面,如上文所述,肥胖引起的机体红细胞膜氧化应激增加是膜 PS外翻增加的原因之一,SoláE等[13]发现,成人肥胖者控制饮食所致的体重下降后 PS外翻量也得到明显改善,同时红细胞膜MDA水平也下降,推测可能体重下降能改善肥胖者膜氧化压力,从而改善了 PS外翻水平。本研究中,运动干预对实验对象的减肥效果非常显著,从而改善了原本由于肥胖而引起的较高氧化应激状态,有利于膜 PS外翻的改善。另一方面,动物实验[5]发现,无论是间歇训练还是持续训练,大鼠 PS外翻量均升高,人体实验[2,3]也证实,无论是长时间递增负荷运动,还是高强度无氧运动,运动后实验对象的红细胞膜 PS外翻量均增加,而膜Na+K+-ATPase酶活性降低,Na+K+-ATPase是广泛存在于真核细胞膜上的内在蛋白,是一种需要磷脂(仅为PS)维持其活性的酶,说明由于疲劳积累和脂质过氧化增加会对红细胞膜破坏增加,加重了红细胞的老化,这与增加机体氧化应激状态有关[10]。说明运动干预会造成新的氧化应激,在一定程度上增加了受试者的膜 PS外翻水平。2)膜脂质对血脂的依赖与血液中可能存在着的特殊蛋白质影响:由于红细胞无脂蛋白受体,所以红细胞膜成分生物合成途径缺乏,膜脂质成分依赖于与循环脂蛋白的交换,膜脂成分与血脂成分处于动态平衡之中,脂蛋白和红细胞之间任何净转移的方向都是由脂质构成决定的。研究发现[11],血浆脂蛋白的组成在血管内代谢过程中是不断变化的,特殊蛋白质、血脂转运蛋白都会影响脂蛋白和细胞之间脂质转移,这也是造成膜脂质变化未及血脂变化显著且迅速的可能原因。3)膜脂质更新所需的ATP供给不够:成熟红细胞没有线粒体氧化途径,糖酵解是其获得能量的基本过程,红细胞生成的ATP一部分维持了红细胞膜上的“钠泵”和“钙泵”运转,一部分维持红细胞膜脂质的不断更新。本研究中运动后膜 Na+K+-ATPase和Ca2+Mg2+-ATPase酶活性的变化提示,肥胖儿童少年能量代谢的提高尚不能及时更新膜脂质变化,可能与运动训练持续时间不够久有关。
5 结论
肥胖儿童少年红细胞膜 PS外翻可能与氧化状态有关,在脂代谢紊乱的初期阶段,PS外翻可能比血脂指标更能体现肥胖的发展。有氧运动干预能显著增加红细胞膜Na+K+-ATPase活性,改善红细胞膜 PS外翻水平,但后者对运动干预的效应滞后于血脂变化。
[1]郭吟,陈文鹤.肥胖症与运动减肥效果的影响因素[J].上海体育学院学报,2010,34(3):64-66.
[2]黄园,陈志庆,邱卓君,等.运动对红细胞老化与生成的影响[J].中国运动医学杂志,2003,22(5):458-461.
[3]金丽,田野,赵杰修,等.运动性贫血及营养干预对大鼠红细胞老化的影响[J].武汉体育学院学报,2007,41(11):43-46.
[4]任海龙,张西平,米战.不同负荷训练对大鼠红细胞膜脂质过氧化水平和ATP酶活性的影响[J].硅谷,2009,12:1-4.
[5]王秋海,黄玉山.不同有氧训练方式对红细胞老化和损伤的影响[J].四川体育科学,2008,28(1):21-22.
[6]辛东,李晖.运动与红细胞膜[J].天津体育学院学报,1996,11(4):1-6.
[7]CAZZOLA R,RONDANELL IM,RUSSO-VOLPE S,etal.Decreased membrane fluidity and altered suscep tibility to peroxidation and lipid composition in overw eight and obese female erythrocytes[J].J Lipid Res,2004,45(10):1846-1851.
[8]EL IZONDO A,ARA YA J,RODRIGO R,etal.Polyunsaturated fatty acid pattern in liver and erythrocyte phospholipids from obese patients[J].Obesity(Silver Sp ring),2007,15(1):24-31.
[9]FERRETTIG,CURA TOLA G,BERTOL IE,etal.Erythrocyte membrane fluidity and changes in plasma lipid composition:A possible relationship in childhood obesity[J].Biochemical Med Metabolic Biology,1991,46(1):1-9.
[10]FISHER-WELLMAN K,BLOOM ER R J.Acute exercise and oxidative stress:a 30 year history[J].Dynamic Med,2009,8 (1):1-25.
[11]RODRIGO R,BÄCHLER J P,ARA YA J,etal.Relationship between(Na+K)-A TPase activity,lipid peroxidation and fatty acid p rofile in erythrocytes of hypertensive and normotensive subjects[J].Mol Cell Biochem,2007,303(1-2):73-81.
[12]SAMOCHA-BONET D,L ICHTENBERGD,TOM ER A,etal. Enhanced erythrocyte adhesiveness/aggregation in obesity corresponds to low-grade inflammation[J].Obes Res,2003,11 (3):403-407.
[13]SOLÁE,VA YÁA,MARTÍNEZ M,etal.Erythrocyte membrane phosphatidylserine exposure in obesity[J].Obesity, 2009,17(2):318-322.
[14]ZHU Y G,ZHANG SM,WANGJ Y,etal.Overweight and obesity-induced oxidative stress in children[J].Biomed Environmental Sci,2006,19(5):353-359.
[15]ZWAAL R F,COM FURIUS P,BEVERS E M.Surface exposure of phosphatidylserine in pathological cells[J].Cell Mol Life Sci,2005,62(9):971-988.
