止喘汤对哮喘大鼠模型气道重构中MMP-9、TIMP-1表达的影响*
2011-03-01霍博雅张占锋
霍博雅,张占锋
哮喘是严重影响人体健康的慢性呼吸道炎症性疾病,其临床特点是慢性进行性和难以根治性。气道重构是气道炎症反复损伤和修复的结果,是造成哮喘患者不可逆气道阻塞的重要原因[1]。目前,对于哮喘气道重构仍缺乏有效的治疗方法。通过对哮喘大鼠模型气道重构的动态观察发现,基质金属蛋白酶-9/基质金属蛋白酶抑制剂-9(MMP-9/TIMP-1)比例可以作为一种显示哮喘气道组织破坏和修复之间平衡的标志,采取措施抑制MMP-9的过度表达,调节MMP-9/TIMP-1的平衡可以干预气道重构[2]。本实验用大鼠哮喘模型观察中药对气道壁结构及MMP-9、TIMP-1表达的影响,探讨中药复方在哮喘气道壁重构中的作用、可能的机制以及存在的优势。
1 材料与方法
1.1 动物及主要试剂、仪器
8周龄SPF级雄性SD大鼠50只,体重200g±20g,由辽宁医学院实验动物中心提供。主要试剂和药品:卵清白蛋白(GradeIII OVA,sigmaA5378),MMP-9、TIMP-1、IV型胶原多克隆抗体、SP试剂盒、DAB试剂盒(北京博奥森生物技术有限公司)。黄芩和止喘汤:各取生药500g,分别加8倍量的水,各提取2次,每次1h,过滤,常压浓缩至500ml(辽宁医学院三附院中药制剂室)。西药:BUD气雾剂(阿斯利康制药有限公司,批号国药准字H20030410,规格5ml:20mg)。JWC–201D超声雾化器(辽宁鞍山市同信医用仪器厂)。
1.2 方法
1.2.1 分组 将上述大鼠置于辽宁医学院基础医学院标准动物实验室内分笼饲养,自由饮水和进食,观察 7d,所有大鼠反应正常,把大鼠随机分为正常组、哮喘组、BUD组、黄芩组和止喘汤组5组,每组10只。
1.2.2 哮喘动物模型的复制 参照Holgate等[1]的方法复制大鼠慢性哮喘模型。第1、8天腹腔注射10%的 OVA混悬液 1ml[内含 OVA100mg、AL(OH)3100mg]致敏,自15d始分别将各组大鼠置于30×30×40cm有进出两口的有机玻璃箱内,1%OVA溶液雾化吸入,0.5ml/min,30min/次,1 次/d,共 6 周。中药组:每次激发前30min中药灌胃(按大鼠体质量1ml/100g);BUD组:激发前30min生理盐水灌胃及5ml:1mgBUD雾化吸入;哮喘组激发前30min生理盐水灌胃;正常组腹腔注射、灌胃及雾化吸入以生理盐水代替。以大鼠呼吸急促、口唇发绀、点头呼吸及站立不稳等表现为模型建立成功的标志。
1.2.3 取材及测定方法 各组动物均于最后1次激发24h内处死并收集肺组织标本。取右肺中叶肺组织标本4%的多聚甲醛固定后,进行脱水、透明、垂直于气道取材,石蜡包埋、切片、片厚 4μm。一部分切片按HE常规染色步骤染色。另一部分切片作免疫组化处理:采用SP法并严格按照试剂盒说明书进行操作,采用微波抗原修复,各组分别滴加1∶200的一抗,阴性对照以PBS代替一抗,其余条件相同。染色判断标准:阴性为不着色,弱阳性呈淡黄色,阳性呈黄色,强阳性呈棕黄色和棕色。
1.2.4 气道形态学参数测量及免疫组化半定量分析 气道形态学参数测量:每组随机抽取10张切片,每张切片选取3支直径为200μm左右完整无斜切的小支气管,参照文献[3]关于气道各层的定义,采用病理图像分析系统测定各支气管基底膜周径(Pbm)、外壁面积(WAo)、内壁面积(WAi)及气道平滑肌面积 (WAm),并用 Pbm将测量值标准化,以消除管径大小、气道状态以及切片方向不同等所造成的差别,分别以 WAo/Pbm、WAi/Pbm、WAm/Pbm表示相应管壁层的厚度。免疫组化半定量分析:随机取10个视野,采用计算机图像处理软件测定各组气道壁 MMP-9、TIMP-1、IV型胶原含量(免疫组织化学染色阳性单位)。
1.3 统计学处理
所有计量资料以珋x±s表示,用SPSS17.0统计软件对统计结果进行分析,各计量数据先进行正态检验和方差齐性检验,凡符合正态分布和方差齐性的数据,采用单因素方差分析,多组间两两比较采用LSD法。对不符合正态分布和方差齐性的计量数据,则进行秩和检验(Kruskal– Wallis法),多组间两两比较采用 Mann–Whitney U法。相关性分析采用Pearson法,以P<0.05为差异有统计学意义。
2 结果
2.1 病理形态学观察结果
表1显示,正常组支气管、肺组织结构正常,各级支气管上皮完整,肺泡间隔正常,无明显炎性细胞浸润。哮喘组气道黏膜水肿,黏膜皱襞增多,黏膜下及管周有大量的炎性细胞浸润,气道上皮细胞脱落,杯状细胞增多,细支气管的气道壁、平滑肌层及基底膜等明显增厚,管腔变窄甚至闭塞。中药组和BUD组较哮喘组上述改变明显减轻。
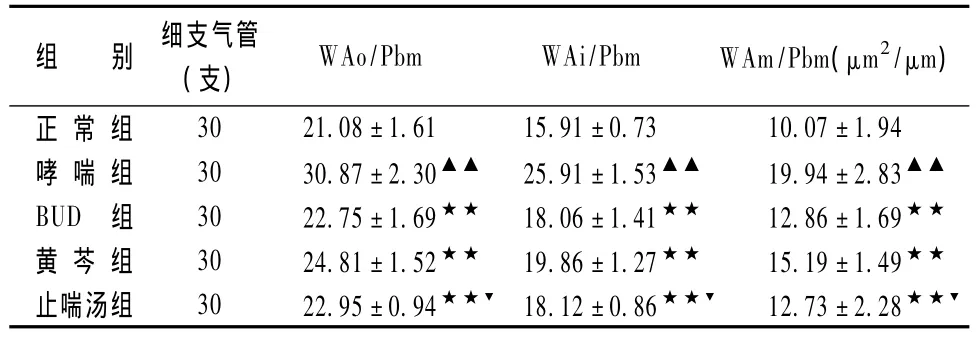
表1 各组大鼠气道形态学指标比较(珋x±s,n=10)
2.2 免疫组织化学染色结果
表2图1显示,正常组气道黏膜上皮细胞、少量的间质细胞及极少量的炎性细胞有微量的MMP-9及TIMP-1表达;模型组气道上皮细胞、气道炎性细胞及气道外壁的成纤维细胞和间质细胞均有表达,部分棕黄色呈强阳性表达;中药组和BUD组较哮喘组颜色变浅,表达明显减弱。IV型胶原在气道壁上的表达情况与MMP-9及TIMP的表达趋势相同。

表2 各组大鼠气道MMP-9、TIMP-1及IV型胶原表达比较(珋x±s,n=10)
3.3 各组大鼠气道壁厚度、IV型胶原与MMP-9、TIMP-1的相关性分析
大鼠气道形态学各指标及IV型胶原含量与MMP-9、TIMP-1呈正相关,与 MMP-9/TIMP-1呈负相关。
3 讨论
细胞外基质(ECM)的降解和沉积失衡是导致呼吸道壁结构异常构建、肺实质破坏及间质增生的重要原因,而MMP则是调节ECM代谢的主要限速酶。气道重构的过程也是MMP在气道壁沉积的过程,MMPs和TIMPs的平衡是维持ECM内环境稳定的决定因素。国内外研究发现,在MMPs中,MMP-9和 TIMP-1与哮喘气道壁重构有密切关系[2、4]。

图1
哮喘气道重构是哮喘气道结构改变的简称,在形态上主要表现为气道壁增厚、上皮细胞损伤、基底膜网状层增厚、黏膜下胶原沉积、支气管平滑肌增生、血管增生及外膜新血管形成[5]。气道重构在哮喘的早期或轻型哮喘即存在,并有研究认为它是哮喘发病过程中的一个原发的病理表现[6]。气道重构导致气道高反应性、促进气道炎症的持续、产生糖皮质激素抵抗及恶化肺功能,有学者认为它可能是顽固性哮喘的病理学基础[7]。气道重构一旦发生即难以逆转,目前认为激素对上皮下纤维化有一定作用,但随着激素抵抗性哮喘增多,激素加重哮喘气道重构被报道[8]以及激素的全身副作用被重视,激素的应用面临挑战。
中医认为,哮喘的基本病机是本虚标实证(宿痰内伏、外邪触发,肺脾肾虚是疾病的关键),止喘汤(党参、白术、茯苓、甘草、桑白皮、杏仁、葶苈子、黄芩、丹参、川芎)是基于哮喘基本病机证型的复方,由定喘汤合四君子汤加减而成。全方具有补益肺脾肾、活血化瘀、清泄肺热、祛痰止咳平喘功效,为根据多年临床经验研制的自拟中药合剂,临床应用效果良好[9]。方中黄芩经实验研究证实,对哮喘气道炎症、气道高反性[5]和气道重构[10]有可靠作用。本实验病理形态学观察中药、BUD组均具有干预气道重构的作用,其中复方组肺纤维化程度要轻于单味组。各组MMP-9、TIMP-1的表达不同,高表达者气道壁增厚明显,且MMP-9、TIMP-1的表达及MMP-9/TIMP-1比值与IV型胶原表达、气道壁厚度之间密切相关。表明中药、BUD组可能通过抑制MMP-9、TIMP-1的过度表达,调节 MMP-9/TIMP-1的平衡而干预哮喘气道重构。本实验研究结果证实,中药具有干预哮喘大鼠模型气道重构的作用,这些作用可能是通过抑制MMP-9、TIMP-1的过度表达、调节MMP-9/TIMP-1的平衡而实现的。在疗效上基于中医基本病机证型的复方优于单味中药,此结果为复方治疗哮喘的中医辨证论治提供了现代实验室理论依据。
[1] Holgate ST,Peters-Golden M,Panettieri RA,et al.Roles of cysteinyl leukotrienes in airway inflammation,smooth muscle function,and remodeling[J].J Allergy Clin Immunol,2003,111(1 Suppl):S18-34.
[2] 王光辉,金发光,楚东岭,等.哮喘豚鼠气道重构中基质金属蛋白酶-9及抑制物TIMP-1的表达[J].第四军医大学学报,2006,27(14):1259-1262.
[3] Tiddens HA,Pare PD,Hogg JC,et al.Cartilaginous airway dimensions and airflow obstruction in human lungs[J].Am J Respir Crit Care Med,1995,152(1):260-266.
[4] Atkinson JJ,Senior RM.Matrix metalloproteinase-9 in lung remodeling[J].Am JRespir Cell Mol Biol,2003,28(1):12-24.
[5] 钟南山.支气管哮喘-基础与临床[M].北京:人民卫生出版社,2006:438-444,891-892.
[6] Beckett PA, Howarth PH. Pharmacotherapy and airway remodelling in asthma[J].Thorax,2003,8(2):163-174.
[7] Homer RJ,Elias JA.Consequences of long-term inflammation Airway remodeling[J].Clin Chest Med,2000,21(2):331-343.
[8] 杨艳娜,陈方方,李 洧,等.RSV感染哮喘小鼠气道炎症及重构与激素抵抗的研究[J].山东大学学报 (医学版),2008,46(4):335-339.
[9] 霍博雅,王 庆.平哮定喘汤联合小剂量糖皮质激素吸入治疗支气管哮喘 142例[J].中医杂志,2004,45(2):87.
[10] 吴世满,武永杰,刘 丽,等.黄芩苷和川芎嗪对哮喘大鼠气道壁重构的影响与机制探讨[J].华中科技大学学报(医学版),2009,38(4):491-494.
