拟南芥体内信号分子水杨酸及H2O2对体内砷积累的响应*
2011-02-27刘云霞孙国新
刘云霞 张 卫 孙国新
(中国科学院生态环境研究中心,北京,100085)
过氧化氢(H2O2)作为一种反应活性氧(Reactive oxygen species,ROS),是细胞有氧代谢的产物[1].因其化学性质相对稳定,寿命较长,较高的跨膜通透性,能在植物细胞间迅速扩散,这些特点使其成为植物体内重要的信号分子[2].当植物受到环境因素如生物胁迫(病虫害,病原菌等)[3],非生物胁迫(干旱,寒冷,盐,重金属等)时[4],过氧化氢的含量会增加,调节植物生理功能,提高自身对环境胁迫的抗性.
强致癌物质砷造成的污染已经引起了世界各地的广泛关注,是当前研究的热点之一.据世界卫生组织公布,目前全球至少有5000多万人口正面临着地方性As中毒的威胁,而中国正是受砷危害最为严重的国家之一[5].由于含砷矿山的开采、冶炼,含砷农药的使用,砷化合物作为养殖业饲料添加剂的广泛利用,造成农田土壤中砷污染[6-7].砷不是植物生长所必须的元素,植物对砷的吸收和积累可以造成生物毒性,降低粮食作物的产量和品质.如水稻中砷积累造成其它营养元素含量降低[8].
植物受到重(类)金属的胁迫,会产生大量的过氧化氢[9].砷的胁迫作用也可以造成植物体内过氧化氢含量增加[4].但植物体内砷的积累和过氧化氢含量的关系,不同浓度的砷对植物体内过氧化氢含量的影响,还缺乏深入研究.
本文采用模式植物野生型和水杨酸含量减少的突变体的两种拟南芥,对在不同砷暴露浓度下过氧化氢的含量及其相互关系进行了研究.
1 材料与方法
1.1 拟南芥及培养方法
本试验以模式植物拟南芥野生型(Wild Type,WT)和水杨酸含量减少的突变体(SA inductiondeficient,sid2)的两种类型作为供试材料[10].两种拟南芥分别在蛭石和花土(1∶1混合)的介质上进行培养.整个培养均在光照培养箱[MLR-351H sanyo,Japan]中进行.培养箱设置条件:16 h光/8 h暗;光照强度250 μE·m-2·s-1;温度22℃;相对湿度70%.
生长一个月后,将拟南芥幼苗移入营养液中[11],营养液中五价砷(Na3AsO4)的浓度分别为0、75、150、300 mmol·L-1.每3 d更换一次营养液,以保证营养液没有明显的其它生物如藻,菌的生长.在培养的第2、4、6天收集拟南芥地上部,用超纯水清洗干净,放入-80℃冰箱冷冻储存待用.
1.2 测定总砷样品的制备及检测
将收获并储存在-80℃冷冻的样品,用去离子水洗净.置于烘箱(70℃)中烘至恒重.烘干的样品称量干重后,置于50 mL尖底塑料离心管中,每个离心管中加入2 mL硝酸(优级纯),放置过夜;用已报道的微波辅助消解法进行消解[5].消解后的样品用双蒸蒸馏水稀释至50 mL,混匀待测.
拟南芥中砷总量采用电感耦合等离子体质谱(ICP-MS)(7500cs型,安捷伦科技有限公司)进行检测[5],铟(In)(m/z 114)作为内标,检测仪器运行中的稳定性.为了确认是否存在生成的Ar40Cl35干扰物,同时检测m/z 77、78、82.在所有检测过程中,未发现存在Cl离子干扰现象.
1.3 拟南芥中水杨酸的检测
将0.5 g新鲜拟南芥样品,在研钵中加液氮并研磨成匀浆,用移液器移入1.5 mL离心管中,之后用1 mL甲醇充分洗涤研钵并转移至同一离心管中,漩涡混合器振荡,充分混匀.将该匀浆在4℃下离心(10000 g)15 min,取上清液置于2 mL离心管中,氮吹仪吹干.加入5%的三氯乙酸(0.25 mL)进行充分溶解.加入乙酸乙酯与环己烷的混合液(1∶1,V/V)萃取2次,每次加入0.8 mL,将2次萃取的上层有机相转移至同一离心管中,氮气吹干,加入0.6 mL的液相流动相进行溶解.过0.45 μm滤膜,置于4℃保存,待测.
下层水相中加入8 mol·L-1盐酸(0.3 mL),摇匀,80℃恒温水浴1 h,使结合态水杨酸转变为游离态水杨酸.加入相同的萃取剂(乙酸乙酯与环己烷的混合液)萃取,氮吹吹干,取0.6 mL液相流动相进行溶解.用0.45 μm膜过滤,置于4℃保存,待测.
采用高效液相色谱法(HPLC)(Waters 1525)检测水杨酸含量[12].色谱柱采用Agilent Zorbax SB-C18(250 mm ×4.6 mm,3.5 μm);流动相为 A:90% 的乙酸钠(0.2 mol·L-1,pH 5.5),B:HPLC 级甲醇(10%),荧光检测器的激发波长294 nm,发射波长426 nm,流速为0.5 mL·min-1,进样体积为10 mL.
1.4 拟南芥中H2O2的检测
根据已报道的方法[13],称取新鲜拟南芥地上部1.5 g,置于研钵中,加入10 mL预冷的丙酮溶液,研磨成匀浆,于10000 g下离心10 min.取1 mL上清液转入干净的离心管,分别加入5%Ti(SO4)2(0.1 mL)和浓氨水(0.2 mL).待沉淀形成后,于10000 g 下离心10 min.弃去上清液,沉淀用 2 mol·L-1的H2SO4(5 mL)溶解,以2 mol·L-1硫酸为空白调零,用紫外可见分光光度计(T6新世纪,北京普析通用仪器有限责任公司),在415 nm处测定分光光度值.用同样方法制作标准曲线,根据H2O2标准曲线计算H2O2的含量.
2 结果与讨论
在As(V)处理下(图1),两种拟南芥WT、sid2地上部对砷的积累随着暴露浓度的提高和暴露时间的延长而逐渐提高.其中野生型中砷的浓度明显高于sid2中砷浓度.最大砷积累浓度为野生型暴露在300 mmol·L-1砷中6 d,地上部砷含量达到53.4 mg·kg-1;而相同条件下 sid2中砷浓度同样达到最大23.4 mg·kg-1,仅为野生型中砷浓度的44%.在相同条件下,野生型中砷的浓度均明显高于相应的sid2中砷的浓度,说明拟南芥对砷的吸收和积累与水杨酸的产生相关.

图1 不同砷暴露浓度及暴露时间下两种拟南芥地上部对砷的积累培养基中砷浓度分别为 0、75、150、300 mmol·L -1;暴露时间为 2、4、6 dFig.1 Arsenic accumulation in two types of Arabidopsis shoots with different As exposure concentrations and different exposure time
在暴露时间相同的情况下,拟南芥地上部的砷浓度和砷暴露浓度呈现很好的线性关系(图1),如在暴露6 d的情况下,在砷暴露浓度范围内(0—300 mmol·L-1),野生型拟南芥体内积累浓度相关性很高R2=0.98;而 sid2中砷积累同样线性相关(R2=0.92).因为在300 mmol·L-1砷浓度时,植物出现中毒症状,鲜重降低,说明生长受到了抑制(数据未显示),所以试验没有研究更高浓度砷对拟南芥的影响.在同一砷暴露浓度下,随着暴露时间的延长(2—6 d),拟南芥地上部中砷的浓度也随之增加.
由于工农业发展,重金属的广泛使用,重(类)金属会在植物体内积累,对植物造成伤害.重金属胁迫已经成为植物主要的非生物胁迫[14].砷不是植物必须元素,高浓度的砷在植物体内积累,是一种环境胁迫.在这种环境胁迫下,作为一种防卫反应,植物会合成较多的水杨酸[15],也会产生大量的H2O2[7,16].在本研究中也观察到类似的现象(表1).在野生型拟南芥中,2 d的砷暴露随砷暴露浓度的提高,H2O2含量19.41—25.22 mg·L-1,无显著差异(p >0.05),而砷暴露 4 d 和 6 d 都出现H2O2降低.Demirevska-Kepova等[17]观察到大麦在Mn暴露5 d后,体内H2O2增加,而Cu没有引起H2O2的提高.在sid2中,体内H2O2没有明显的规律性,但总体含量高于野生型拟南芥.目前,重金属诱导的植物体内H2O2积累的机制仍不清楚,可能与体内茉莉酮酸酯的活性有关[16].

表1 在不同砷暴露浓度和不同暴露时间下拟南芥地上部H2O2浓度(mg·L-1)Table 1 H2O2concentration in the shoots of Arabidopsis with different As exposure concentrations and different time intervals
重金属胁迫造成植物的另一种反应是导致水杨酸(SA)的积累.sid2作为水杨酸合成突变体,即水杨酸合成功能缺失,即使在砷胁迫下,其体内水杨酸的积累也很少,在所有砷暴露情况下,sid2地上部体内水杨酸含量都 <0.5 mg·kg-1(图2).而野生型(WT),体内水杨酸积累皆 >0.5 mg·kg-1(图2),与Krantev等人得到的结果一致[18].
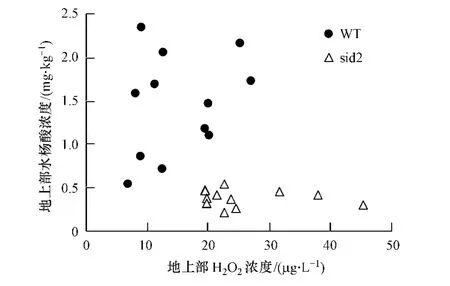
图2 在不同浓度As(V)和不同暴露时间下拟南芥地上部水杨酸的积累营养液中 As(V)浓度为 0、75、150、300 mmol·L -1;在砷暴露第 2、4、6 天采样Fig.2 Accumulation of SA in the shoot of Arabidopsis with the addition of 0,75,150 and 300 mmol·L -1As(V)in the culture medium
拟南芥地上部水杨酸和H2O2的浓度单独看来没有相关性(图2),但SA/H2O2比值与砷暴露浓度存在一定的线性关系(图3),野生型拟南芥SA/H2O2在54.9—257.7范围内.在相同的砷暴露时间内,随着砷暴露浓度的增加而增加,并呈现很好的线性关系,第2、4、6天的 R2分别为0.80、0.96、0.84(p值皆<0.001).而水杨酸突变体sid2中,其SA/H2O2比值没有明显变化,在6.6—24.4范围内,这可能是由于该拟南芥产生的水杨酸含量低所致.

图3 拟南芥地上部SA/H2O2比值及与营养液中砷浓度的相关性Fig.3 SA/H2O2ratio and their correlation in shoots of Arabidopsis(WT and sid2)with the addition of As(V)at 0,75,150,300 mmol·L -1in the medium
越来越多的证据表明,水杨酸与活性氧(ROS)相互作用,控制植物防卫反应基因的表达[19],而H2O2是反应活性氧的一个重要组成.据报道,防卫反应中水杨酸和ROS形成了正向反馈环[20],因为一方面H2O2能够通过基丙酸类合成路径刺激水杨酸合成[21].另一方面,高含量水杨酸不仅通过多种途径产生ROS,而且抑制抗氧化系统酶如过氧化氢酶(CAT)的活性,导致ROS的积累[22].砷胁迫下,野生型拟南芥体内水杨酸和H2O2浓度都增加,可能是这种相互作用的结果,造成其比值随着砷胁迫的提高而呈线性关系,同时导致了体内砷积累.而水杨酸合成功突变体sid2,因其水杨酸合成功能的缺失,只有H2O2浓度调节防卫反应,是该拟南芥体内砷积累低于野生型的主要原因.
3 结论
拟南芥野生型在As(V)胁迫下,地上部体内砷积累随砷暴露浓度的增加而增加,并呈现很好的线性关系;同时其体内SA/H2O2比值同样随砷暴露浓度的增加而增加并有良好的线性关系.可能是水杨酸和H2O2相互作用,调控拟南芥体内防卫反应,造成拟南芥体内砷积累.而水杨酸合成突变体sid2中砷浓度明显低于野生型,可能是因为缺失水杨酸而只有H2O2调控防卫基因,无法和水杨酸形成相互作用,因此体内积累的砷少于野生型.
[1]苗雨晨,董发才,宋纯鹏.过氧化氢——植物体内的一种信号分子[J].生物学杂志,2001,18(2):4-6
[2]Veal E A,Day A M,and Morgan B A.Hydrogen peroxide sensing and signaling[J].Molecular Cell,2007,26(13):1-14
[3]Doke N.Involvement of superoxide anion generation in the hypersensitive response of potato tissues to infection with an incompatible race of Phytophthora infestans and to the hyphal wall components[J].Physiol Plant Pathol,1983,23:345-356
[4]Wang L H,Duan G L,Williams P N,et al.Influences of phosphorus starvation on OsACR2.1 expression and arsenic metabolism in rice seedlings[J].Plant Soil,2008,313:129-139
[5]Sun G X,Williams P N,Zhu Y G,et al.Survey of arsenic and its speciation in rice products such as breakfast cereals,rice crackers and Japanese rice condiments[J].Environ Int,2009,35:473-475
[6]白建峰,林先贵,尹睿,等.砷污染土壤的生物修复研究进展[J].土壤,2007,39(5):692-700.
[7]Reyes S A,Yenal U,Field J A,et al.Anaerobic biotransformation of organoarsenical pesticides monomethylarsonic acid and dimethylarsinic acid[J].J Agric Food Chem,2006,54:3959-3966
[8]Williams P N,Islam S,Islam R,et al.Arsenic limits trace mineral nutrition(selenium,zinc,and nickel)in Bangladesh rice grain[J].Environ Sci Technol,2009,43:8430-8436
[9]Cho U H,Seo N H.Oxidative stress in Arabidopsis thaliana exposed to cadmium is due to hydrogen peroxide accumulation[J].Plant Science,2005,168:113-120
[10]Julia D,Lynne R T,Wildermuth M C,et al.Three unique mutants of Arabidopsis identify eds loci required for limiting growth of a biotrophic fungal pathogen [J].The Plant Journal.2000,24:205-218
[11]Hewitt E J.Sand and water culture methods used in the study of plant nutrition[M].Technical Communication(2nd ed,No.22).London:Commonwealth Agriculture Bureaux,1966:67-69
[12]张卫,孙国新,徐玉新,等.植物体内水杨酸分析方法的探讨及其应用[J].生态毒理学报,2009,4(6):889-897
[13]Brennan T,Frenkel C.Involvement of hydrogen peroxide in the regulation of senescence in pear[J].Plant physiol,1977,59:411-416
[14]Maksymiec W.Signaling responses in plants to heavy metal stress[J].Acta Physiol Plant,2007,29:177-187
[15]Krantev A,Yordanova R,Janda T,et al.Treatment with salicylic acid decreases the effect of cadmium on photosynthesis in maize plants[J].J Plant Physiol,2008,165:920-931
[16]Maksymiec W,Krupa Z.Thein vivoandin vitroinfluence of methyl jasmonate on oxidative processes inArabidopsis thalianaleaves[J].Acta Physiol Plant.2002,24:351-357
[17]Demirevska-Kepova K,Simova-Stoilova L,Stoyanova Z,et al.Biochemical changes in barley plants after excessive supply of copper and manganese[J].Environ Exp Bot,2004,52:253-266
[18]Krantev A,Yordanova R,Janda T,et al.Treatment with salicylic acid decreases the effect of cadmium on photosynthesis in maize plants[J].J Plant Physiol,2008,165:920-931
[19]Durrant W,Dong X.Systemic acquired resistance[J].Annu Rev Phytopath,2004,42:185-209
[20]Holuigue L,Salinas P,Blanco F,et al.Salicylic acid and reactive oxygen species in the activation of stress defense genes.//Hayat S,Ahmad A.(Ed.)Salicylic acid:a plant hormone[M].Netherland:Springer Inc.,2007,197-246
[21]Kawano T.Roles of the reactive oxygen species-generating peroxidase reactions in plant defense and growth induction[J].Plant Cell Rep,2003,21:829-837
[22]Durner J,Klessig D F.Salicylic acid is a modulator of tobacco and mammalian catalases[J].J Biol Chem,1996,271:28492-28501
