硫酸钠溶液降温过程探析
2011-02-27范晓明邹惠玲杜伯会
范晓明,侯 杨 ,刘 宝,邹惠玲 ,杜伯会
(1.山东省产品质量监督检验研究院 食品化工中心,山东 济南 250100;2.东北师范大学 化学学院,吉林 长春 130000)
工业上,通常是采用母液排出法将芒硝或含有芒硝的矿物由淡水溶液经化学处理、重力沉降、过滤等步骤后蒸发或者卤水经过多效蒸发分离得到Na2SO4[1-3],但所得到的Na2SO4纯度有时并不能满足产品质量要求。采用溶解-降温析出的方法来可对Na2SO4进行进一步提纯精制。在降温析出的过程中冷冻温度过低时,Na2SO4溶液可能会出现结冰现象,由此冷凝器可能发生堵塞和冰冻事故,导致生产过程出现中断,甚至对生产设备造成破坏,影响生产的可持续进行。另一方面,冷却温度不够低时,又使Na2SO4的结晶析出率不够高,影响到生产效率。因此,Na2SO4溶液冰点的确定以及合适的降温温度就显得比较重要了。
本文利用外部冷却降温法模拟了Na2SO4溶液降温过程中的发生的变化,并最终确定了Na2SO4溶液的冰点以及合适的冷却温度,为企业的工业化生产的正常控制和安全操作提供了理论指导。
1 实验部分
1.1 仪器及试剂
DSY-019A低温运动粘度测定仪(大连离合仪器有限公司);秒表;AE200电子分析天平;坩埚;烘箱。
Na2SO4、NaCl、NaNO3,以上药品均为分析纯由国药集团化学试剂有限公司提供。
1.2 实验方法
量取70mL配制的Na2SO4溶液置于双层玻璃管中,将玻璃管置于设定好冷却温度的低温运动粘度测定仪中,同时打开机械搅拌装置以保证溶液温度的均匀性并计时。观察Na2SO4溶液温度和状态随时间的变化。
2 结果和讨论
2.1 不同冷却温度下,Na2SO4溶液温度的变化
分别在-10℃和-35℃的冷却温度下对Na2SO4进行降温处理,其温度随时间的变化见图1、2。

图1 -10℃下,100g·L-1Na2SO4溶液温度变化Fig.1 Temperature changes of 100g·L-1Na2SO4solution under-10℃

图2 -35℃下,100g·L-1Na2SO4溶液温度变化Fig.2 Temperature changesof100g·L-1Na2SO4solution under-35℃
由图3可见,升华热、离解热、晶格能均由Na2SO4本身性质决定,而离子水合焓则取决于溶质与溶剂之间的相互作用,将直接影响Na2SO4在水中的溶解度。Na2SO4与水相互作用越大,生成的水和离子越稳定,离子水合焓越大,其溶解度越大。而Na2SO4在水中的溶解度是随着溶液温度的降低而逐渐减小的。
由图1可以看出,溶液温度随时间不断下降。当冷却至23min时,溶液温度降低至9.0℃,溶液开始出现浑浊现象,开始有少量的晶体析出。与此同时,溶液温度随着晶体析出迅速回升至9.7℃。在此过程中,随着温度的降低,Na2SO4在水中的溶解度不断减小,并逐渐达到过饱和状态,溶液中Na+与SO42-浓度积超过了该温度下Na2SO4的溶度积而开始析出[5]。Na2SO4开始逐渐形成小的晶粒,从水溶液中析出,但由于外在搅拌的存在,晶体未能长大,呈无数小晶粒态出现于溶液中。
随着溶液温度进一步降低,有越来越多的Na2SO4晶体析出,并逐渐沉积至试管底部。当温度降低至-2.3℃时,试管中开始出现了大量的冰晶,同时溶液温度迅速上升至-1.0℃,在随后的15min内,溶液温度始终保持在-1.0℃不变。根据SH/T 0090-1991[6]规定,该Na2SO4溶液的冰点为-1.0℃。
从图2可以看出,当冷却温度为-35℃时,Na2SO4溶液温度下降速度明显加快。温度由21℃下降到8.8℃仅用了11min。此时,该Na2SO4溶液开始出现浑浊现象,同时溶液温度开始上升。直至9.4℃后溶液温度重新开始下降,同时有更多的Na2SO4溶液晶体析出,不断沉降至玻璃套管底部。当溶液温度下降至-2.2℃时,Na2SO4溶液中出现冰花,溶液温度迅速回升至-1.0℃,并在随后的15min内始终保持不变。因此,100mg·L-1Na2SO4溶液在-35℃冷凝条件下测得的冰点也为-1.0℃。
由图1、2比较发现,不同降温条件下,溶液降温过程会出现不同,溶液中晶体析出的温度出现不同,但并不会影响最终溶液冰点温度的确定。
可以用玻恩-哈伯循环来讨论水溶液中Na2SO4的离解和水化[4]。其循环过程见图3。

图3 Na2SO4在水中的玻恩-哈伯循环Fig.3 Born-Haber cycle of Na2SO4in water
2.2 不同浓度的Na2SO4溶液降温模拟
在 -10℃冷却温度下,对浓度为 50mg·L-1Na2SO4溶液进行降温处理,其降温过程见图4。
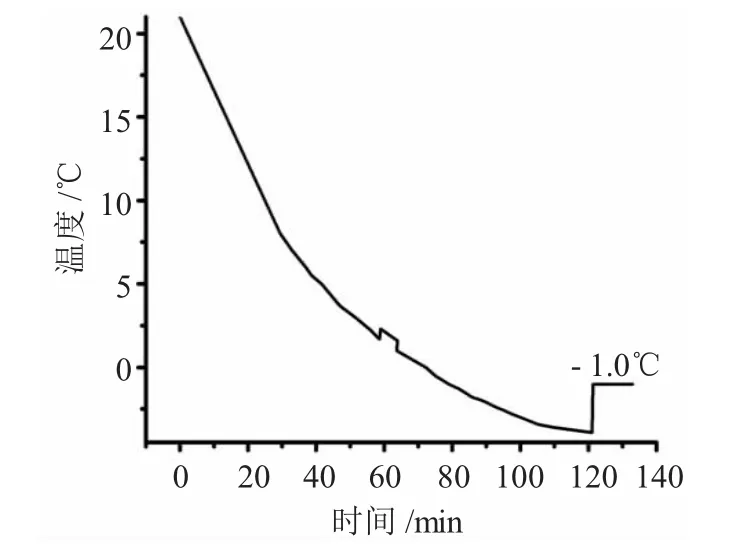
图4 -10℃下,50g·L-1Na2SO4溶液降温过程Fig.4 Temperature changes of 50g·L-1Na2SO4solution under-10℃
由图4可以看出,50mg·L-1的Na2SO4溶液温度随时间不断降低,但当温度降低至1.7℃时,开始有有小晶体开始析出,溶液温度也回升至2.0℃。随后溶液又开始逐渐下降,当溶液温度降至-3.9℃时,溶液开始出现大量冰晶,并伴随着温度回升至-1.0℃,并在随后15min内保持不变。由此,可以得出50mg·L-1Na2SO4溶液的冰点为-1.0℃。
通过 100mg·L-1与 50mg·L-1Na2SO4溶液在-10℃下的降温过程可以推测,在-1.0℃时为过饱和的Na2SO4溶液在降温过程中,均是在一定的温度下达到过饱和后开始析出晶体,当温度降低至-1.0℃后溶液结冰。不同浓度的Na2SO4溶液的冰点相同,仅是开始析出晶体的温度不同。
2.3 NaCl、KCl添加对 Na2SO4溶液冰点的影响
将含 1%NaCl、1%KCl和 10%Na2SO4的混合溶液在-10℃下降温,其溶液温度变化见图5。
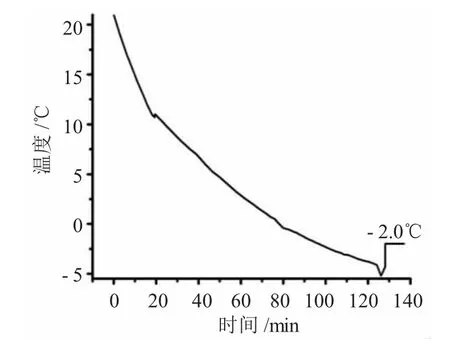
图5 在-10℃下,含 10mg·L-1NaCl、10mg·L-1KCl、100mg·L-1 Na2SO4溶液降温过程Fig.5 Temperature changes of solution(10mg·L-1NaCl、10mg·L-1KCl、100g·L-1Na2SO4)under-10℃
在该混合溶液的降温过程中,当温度下降至7.0℃时,溶液开始有小的晶体开始析出,随着温度的进一步下降,有更多的晶体不断析出,当温度下降至-4.3℃时,有大量的冰晶析出,温度迅速回升至-2.0℃,并在随后的十多分钟内始终保持不变。因此,该混合溶液的冰点为-2.0℃。由于同离子效应[5]的存在,使该溶液比同条件下只含100g·L-1Na2SO4溶液的开始析晶温度要高。但是却使溶液的冰点降低。因此,饱和Na2SO4溶液在降温过程中,当含有其它杂质离子时,其冰点总是不高于-1.0℃。
2.4 不同温度下Na2SO4溶液的晶体析出率
取100mg·L-1Na2SO4溶液 70mL于玻璃套管中,做降温处理。当溶液温度下降至8.0后,每隔1℃,分别快速取出玻璃管,并将试管中溶液于析出的晶体抽滤,将抽滤所得的晶体于120℃烘箱内烘干后测定析出的Na2SO4晶体的质量,计算其回收。随着温度降低,Na2SO4晶体回收率见图6。
由图6所示,从8.0℃开始,随着溶液温度的降低,Na2SO4的回收率不断升高。溶液温度为8.0℃时,Na2SO4的回收率为28.2%。当温度降低至0℃时,其回收达到84.3%。从图中6可以发现,当温度降低至1.0℃时,Na2SO4的回收率增长开始变缓,温度降低1℃后,其回收率增加了2.6%,因此,可以推断,在1℃以后,相对而言,降低温度时,其效率也已经比较低。考虑到工业化生产时,回收率越高,效益越好,因此,在工业化生产时,应尽量降低溶液温度以使更多的Na2SO4晶体析出。但由于Na2SO4溶液冰点为-1.0℃,故综合考虑,将Na2SO4溶液的冷却温度控制在0℃~-1.0℃。
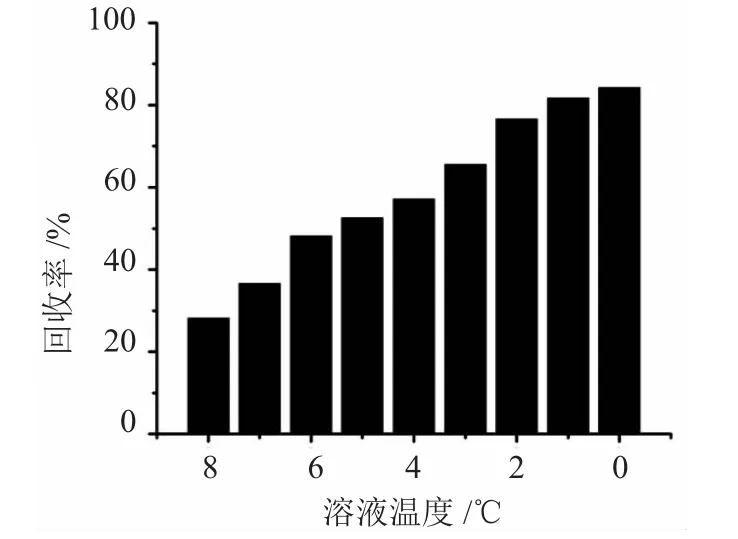
图6 不同温度下,Na2SO4的回收率Fig.6 Recovery rate changes of Na2SO4at different temperatures
3 结语
本文利用模拟Na2SO4降温过程确定了饱和Na2SO4溶液的冰点为-1.0℃,而NaCl、KCl的存在则使Na2SO4溶液的冰点降低。本文数据只是为从含量较高的Na2SO4溶液通过降温来析出Na2SO4晶体这一过程进行理论指导。工业Na2SO4的提纯精制是一个比较复杂的过程,尤其是从卤水中直接提取Na2SO4,其组成十分复杂,各种离子的影响也错综复杂。在实际的生产过程中,所析出的Na2SO4晶体是是否含有其它的种类的晶体,以及如何更好的进一步减少杂质的含量,将有待于进一步的研究。
[1]彭赛军.NaCl-Na2SO4-H2O体系中硫酸钠生产工艺分析[J].中国井矿盐,2007,(1):10-14.
[2]杨成德.芒硝矿区卤水直接生产无水硫酸钠工艺研究[J].内蒙古石油化工,2005,(3):10-11.
[3]谢明胜,卫锋,王爱广.颗粒状无水硫酸钠的生产[J].无机盐工业,2003,(6):30-31.
[4]何凤姣.无机化学(第二版)[M].科学出版社,2006.54-55.
[5]宋天佑,程鹏,等.无机化学(第二版)[M].高等教育出版社,2009.254-257.
[6]中华人民共和国石化行业标准.(SH/T0090-1991)[S].
