水溶性壳聚糖对阻塞性黄疸大鼠肝纤维化的保护作用及其机制
2011-02-24王葆春宫晓光吕云福
王葆春,宫晓光,吕云福
(海南省人民医院普外科,海南海口 570311)
我们通过建立阻塞性黄疸(阻黄)大鼠肝纤维化模型,应用水溶性壳聚糖治疗,研究其对肝纤维化的影响。
1 材料与方法
1.1 动物和分组 健康雄性SD大鼠72只,体重250-280 g,由本院实验动物中心提供,随机分成3组:(1)胆总管不结扎+生理盐水组(SO组);(2)胆总管结扎+生理盐水组(BDL+NS组);(3)胆总管结扎+水溶性壳聚糖组(BDL+WSC组)。每组术后再随机分设7、14、21 d个3时相点,每个时相点8只。
1.2 动物模型制作 术后6 h,SO组、BDL+NS组行腹腔内注射NS(2ml/kg体重,1次/d);BDL+水溶性壳聚糖组腹腔内注射WSC(600 mg/kg体重,1次/d)。分笼普通饲养,自由进水进食。
1.3 检测方法和观察内容 分别于术后7、14、21 d取材。(1)自动生化分析仪测定血清谷丙转氨酶(ALT)、谷草转氨酶(AST)、总胆红素(TB)。(2)肝组织苏木素-伊红(HE)染色。(3)试剂盒检测HSC内MDA、SOD含量:按试剂盒说明书进行操作测定。(4)用RT-PCR检测 I、III型胶原。I型胶原PCR引物序列:Sence5-ACAGGCGAACAAGGTGACAGAG-3,Antisence5-GCCAGGAGAACCAGCAGAGC-3(158 bp);
Ⅲ型胶原PCR引物序列:Sence5-AGATGCTGGTGCTGAGAAGAAAC-3;Antisence5-GCTGGAAAGAAGTC TGAGGAAGG-3(137 bp)
2 结果
2.1 肝功能测定结果 ALT、AST、TB值在胆管梗阻7、14 d时BDL+NS组比BDL+WSC组升高明显,差异有统计学意义(7 d,P<0.05;14 d,P<0.05),而21 d时两组均明显升高,差异无统计学意义(P>0.05)。
2.2 光镜观察 胆管结扎7 d,肝细胞出现点状坏死和少量纤维组织增生;胆管结扎14 d时肝小叶内可见多种形态的坏死灶,周围炎性细胞浸润,纤维组织及小胆管广泛增生;胆管结扎21 d时肝组织增生更明显,结构紊乱呈肝硬化特征;BDL+WSC组在7、14 d时肝组织病理改变均较BDL+NS组轻;胆总管结扎+WSC组21 d时两组改变基本相同。
2.3 HSC内MDA测定结果 胆道梗阻后MDA显著升高,随着梗阻的迁延升高更明显。WSC治疗后,7、14 d时MDA显著降低(7 d,P<0.01;14 d,P<0.05),但21 d时,与BDL+NS组差异无统计学意义(P>0.05)。

表1 各组和各时相段HSC内MDA含量测定结果(±s±s,nmol/mg p rot)组别 n 7 d 14 d 21 d SO组 8 10.87±2.23 10.48±2.53 10.44±2.32 BDL+NS组 8 25.45±4.27 34.63±5.44 41.31±5.76 BDL+WSC组 8 18.54±3.95** 26.39±4.58* 39.68±5.19注:与BDL+NS组比较,**P<0.01,*P<0.05
2.4 HSC内SOD测定结果 胆道梗阻后SOD显著降低,随着梗阻的迁延降低更明显。WSC治疗后,7、14 d时SOD显著升高(7 d,P<0.01;14 d,P<0.05),但21 d时,与BDL+NS组差异无统计学意义(P>0.05)。

表3-6 各组和各时相段HSC内SOD含量测定结果(±s±s,nmol/mgprot)组别 n 7 d 14 d 21 d SO组 8 58.39±3.13 57.36±3.09 58.37±3.23 BDL+NS组 8 41.68±3.82 35.84±4.43 32.68±4.69 BDL+WSC组 8 47.22±3.49 42.75±5.08* 33.53±4.61注:与BDL+NS组比较,**.P<0.01,*P<0.05
2.5 用RT-PCR检测Ⅰ、Ⅲ型胶原和 TNF-αmRNA
SO组大鼠纤维化相关调控基因I、III型胶原、TNF-α的表达相对较低或不表达;与SO组比较,BDL+NS组Ⅰ、Ⅲ型胶原、TNF-αmRNA表达水平明显上升(P<0.01),与BDL+NS组比较,BDL+WSC组Ⅰ、Ⅲ型胶原、TNF-α表达水平明显下降。
3 讨论
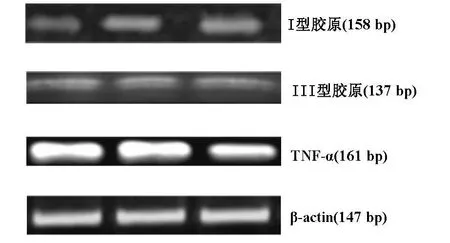
21 d时大鼠肝脏Ⅰ、Ⅲ型胶原mRNA表达变化
多糖是构成生命的四大基本物质之一,是重要的生物活性物质。多糖作为一种天然的高分子化合物,与生命的各种生理机能密切相关,产生多种多样的生物学功能,如免疫调节、抗感染、抗肿瘤、抗凝血、降血糖和抗病毒等。目前,有关糖类在肝脏疾病中的研究已有不少报道,例如,Lee等[1]研究发现,肝细胞表面的去唾液酸化糖蛋白受体及其甘露糖N-乙酰葡萄糖受体可以清除体内异常的糖基化蛋白以维持血清糖蛋白的平衡。因此,可通过检测血清中N-糖基化蛋白谱的异常分布来判断肝细胞功能受损情况。还有研究[2-4]发现,肝炎和肝癌患者血清中转铁蛋白的糖链异常。在多糖保肝、护肝和抗纤维化方面,一些生物活性多糖,如云芝多糖和香菇多糖等的作用已得到公认。
肝纤维化是肝病的共有病理改变,肝星状细胞(HSC)在肝纤维化形成中胶原的过度合成时起着非常重要的作用,HSC的活化和增殖在纤维形成中起着关键作用。HSC的激活及其激活后ECM的异常表达是肝纤维化发生、发展的关键。HSC在肝纤维化形成时胶原的过度合成中起着主要的作用[5],HSC的活化和增殖在纤维形成中起着关键作用,肝星状细胞活化后可以合成大量细胞外基质。TNF-α的大量释放可参与肝脏的损伤和修复循环,并最终引起肝脏大量ECM的合成与沉积,因此HSCs是肝脏中TNF-α的主要来源;TNF-α可进一步激活HSC,Weiner等[5,6]研究发现,TNF-α不仅可使体内外培养的大鼠肝脏Ito细胞增加合成胶原蛋白和蛋白多糖约3.5和2.6倍,增加3T3 L1脂肪细胞系Ⅰ、Ⅲ、Ⅳ型前胶原mRNA的表达,而且还能消除转化生长因子β对大鼠Ito细胞增殖的抑制作用,促使Ito细胞增殖并分泌纤维连接蛋白和蛋白多糖等基质。Czaja等[7]发现,肝纤维化早期肝内TNF-αmRNA首先出现并逐渐增高,随后Ⅰ型胶原mRNA含量开始上升,至肝纤维化晚期,TNF-αmRNA水平逐渐下降,而Ⅰ型胶原mRNA水平持续升高,表明TNF-α在肝纤维化启动和发展过程中起重要作用。许多研究显示肝纤维化时Ⅰ型和Ⅲ型胶原的表达水平是增加的[8]。通过体内试验发现抗氧化剂可以防止氧化应激、脂质过氧化和肝纤维化,提示氧化应激可以直接或者间接对HSC表现出促纤维相关的刺激[9,10]。
本实验结果显示,胆总管梗阻不同时期肝纤维化明显异常,随病程进展,肝纤维化水平增强随之加重。而肝纤维化是阻黄导致肝硬化的细胞病理机理之一[11]。用WSC治疗后,大鼠HSC内SOD的含量在7、14 d时明显高于对照组(7 d,P<0.01;14 d,P<0.05),而且使MDA含量降低(7 d,P<0.01;14 d,P<0.05),肝脏功能明显得到保护。与对照组比较,BDL+NS组 Ⅰ 、Ⅲ型胶原 、TNF-αmRNA 表达增加。与BDL+NS组相比,BDL+WSC组的Ⅰ、Ⅲ型胶原、TNF-αmRNA表达减少。因此说明WSC抑制了脂质过氧化反应,从而减轻阻黄时肝损伤,其机制可能是WSC使氧自由基(如O2-和·OH)与线粒体膜的不饱和脂肪酸发生脂质过氧化反应减少,减轻了脂质过氧化物对线粒体膜完整性的破坏;减轻了氧自由基抑制线粒体的氧化磷酸化,使能量生成减少程度下降,从而减轻肝脏的纤维化。
另外,本实验中还可见用WSC治疗至21 d后,BDL+NS组和BDL+WSC组中SOD都更进一步减少,但两组比较,差异无统计学意义(P>0.05)。提示水溶性壳聚糖只在早、中期能够通过减少自由基的产生,减轻脂质过氧化损伤,,从而起到保护HSC,减轻肝脏损伤的作用,但晚期效果仍差,需要进一步寻找能更有效的保护抗肝纤维化药物。本研究开展了低聚壳聚糖在抗肝纤维化方面的作用研究,并探讨了其作用机制,丰富了中药多糖的抗肝纤维化作用,为寻找特异、有效的抗肝纤维化治疗药物奠定了基础。
[1]LeeSJ,EversS,RoederD,et alMannose receptor-mediated regulation of serum glycoprotein homeostasis[J].Science,2002,295(5561):1898.
[2]Khan ZA,CukiernikM,Gonder JR,et al.Oncofetal fibronectin in diabetic retinopathy[J].Invest Ophthalmol Vis Sci,2004,45(1):287.
[3]Ang IL,Poon TC,Lai PB,et al.Study of serum haptoglobin and itsglycoforms in the diagnosis of hepatocellular carcinoma-a glycopro-teomic approach[J].Proteome Res,2006,5(10):2691.
[4]Spangenberg HC,Thimme R,Blum HE.Serum markersof hepatocel lular carcinoma[J].Sem in Liver Dis,2006,26(4):385.
[5]Gressner AM.The cell biology of liver fibrogenesis-an imbalance of proliferation,growth arrest andapoptosisofmyofibroblasts[J].Cell Tissue Res,1998,292(3):447.
[6]Gressner AM.Transdifferentiation of hepatic stellate cells(Ito cells)to myofibroblasts:akey event in hepatic fibrogenesis[J].Kidney Int Suppl,1996,54:S39.
[7]De Minicis S,Seki E,UchinamiH,et al.Gene expression profiles during hepatic stellate cellactivation in cultureand in vivo[J].Gastroenterology,2007,132(5):1937.
[8]Tsukada S,Parsons CJ,Rippe RA.Mechanismsof liver fibrosis[J].Clin Chim Acta,2006,364(1-2):33.
[9]Pietrangelo A,Gualdi R,Casalgrandi G,et al.Molecular and cellular aspectsof iron-induced hepatic cirrhosis in rodents[J].JClin Invest,1995,95(4):1824.
[10]Lee KJ,Choi JH,Jeong HG.Hepatoprotective and antioxidant effects of the coffee diterpenes kahweol and cafestol on carbon tetrachloride-induced liver damage in mice[J].Food Chem Toxicol,2007,45(11):2118.
[11]Tsai Ly,Lee KT,Tsai SM,et al.Changes of lipid peroxide le vels in blood and liver tissue of patientsw ith obstructivejaundice[J].Chinica Chimica Acta,1993,21 5(1):41.
