P53基因在电离辐射诱导的非小细胞肺癌细胞死亡中的作用
2011-02-24马淑梅李英普宋志恒易贺庆侯吉光贾立立谭哲峰刘晓冬王铁君
乔 俊,马淑梅,李英普,宋志恒,易贺庆,侯吉光,贾立立,谭哲峰,刘晓冬*,王铁君*
(1.吉林大学第二医院 肿瘤放疗科,吉林 长春 130021;2.吉林大学公共卫生学院卫生部放射生物学重点实验室,吉林长春 130021;3.吉林大学中日联谊医院 骨科,吉林 长春 130021;4.吉林省大唐长山电厂职工医院,吉林 松原 138000)
自噬(autophagy)是细胞通过溶酶体来降解和消化自身受损、衰老以及丧失功能的蛋白、细胞器和部分细胞质等生物分子的过程。自噬过程是真核细胞特有的,为细胞的再生与修复提供原料,实现细胞的再循环与再利用[1]。但自噬在肿瘤中起保护还是抑制作用还不明确,肿瘤在电离辐射诱导下是以自噬为主还是凋亡为主还有待研究。近年研究表明P53与自噬与凋亡都有关系。P53在正常细胞是短寿命的,含量极少,但在哺乳动物细胞应激反应时起主要作用,通过调控细胞周期,DNA损伤的修复,衰老,血管生成和细胞凋亡的基因转录活性而发挥作用[2]。近来研究表明,P53也对Caveolin-1,TSAP6,CHmp4C,和DRAM产生影响从而对自噬发挥作用[3]自噬被PI3K严格调控,哺乳动物的自噬过程通常被认为PI3KⅠ通过激活Akt-mTOR激酶抑制自噬,而PI3KⅢ通过调节P-tdIns(3)P促进自噬,但是缺乏PI3KⅠ调节自噬的直接证据[4]。有关文献报道,Akt的激活可以有效的促进MDM2入核,从而与P53相互作用而抑制P53的转录活性[2]。最近研究发现MDM2蛋白是P53主要的负向调节蛋白,抑制P53-MDM2交联可以在结构与生物水平有效激活P53[5]。本研究通过对电离辐射后不同P53状态的H1299细胞的自噬、凋亡相关蛋白的变化,来探讨P53在电离辐射诱导非小细胞肺癌细胞死亡中的作用。
1 材料和方法
1.1 主要试剂与仪器 试剂:AKT、GAPDH、发光试剂盒(ECL)等均购自美国Santa Cruz公司,MDM 2购自Millpore公司,兔抗LC3购自cell signaling公司;二抗羊抗鼠购自中山金桥公司,二抗羊抗兔购自博士德公司。
1.2 细胞培养与照射 人类肺腺癌细胞株(H1299)由本实验室保存,使用10%胎牛血清的DMEM培养基,37°C、5%CO2培养箱中培养,0.25%胰酶消化传代。照射条件:美国VARIAN 3000ix医用直线加速器,单次照射源皮距100cm,吸收剂量率3Gy/min,照射剂量分为0、4、8Gy。
1.3 H1299-P53和H1299-175H细胞模型的建立质粒PcDNA3.1-175H/PcDNA 3.1-p53为本课题组构建并保存,转入 H1299细胞,分别加800 g·L-1/950μg/m lG418筛选,2周后G418耐药性克隆形成,标记H1299-175H/H1299-P53细胞。
1.4 流式细胞术检测凋亡 将处理组细胞用不含EDTA的胰酶消化置于离心管中1 500 r/min离心5 min,弃上清,加入 1×PBS,1 500 r/m in,5min洗两次。将细胞按1×105/ml密度加入400μl loading buffer置于流式管中,后加入Annexin V/PI各 5μl,4℃避光30min后用流式细胞仪检测凋亡情况。
1.5 免疫印迹 细胞加入50-200μl的细胞裂解液(Tris-HCI,NaCL,Triton X100)。4℃,12 000 r/m in离心5min。收集上清,定量后分装于-70℃冰箱保存。蛋白煮沸5 min进行变性,SDS-PAGE电泳。电泳后湿式转印NC膜上(100V 90min);5%脱脂奶粉封闭1.5 h,加1∶1 000稀释的一抗于4℃摇床过夜;TBS洗膜3次;加1∶1 000稀释二抗反应90 min,TBS洗膜3次,ECL显色并记录结果。
1.6 统计学处理 LC3,AKT,MDM 2,Caspase-3,GAPDH基因与蛋白检测结果采用Quantity One软件进行电泳条带灰度分析。
2 结果
2.1 H1299-P53,H1299-175H细胞模型检测
将构建的H1299-P53,H1299-175H细胞及实验室保存的H1299细胞提取总蛋白,采用western bolt检测转染P53基因及Psuper-175H突变子的H 1299是否成功,经western bolt检测,在相对分子量53 KB的位置检测到蛋白表达,证明构建成功.由于P53是短寿命蛋白,检测到微量表达。(见图1)
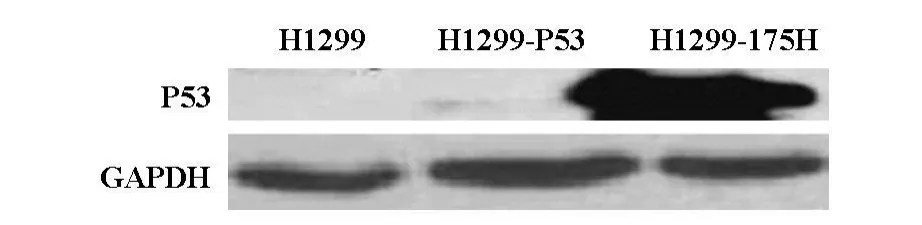
图1 P53基因检测结果
2.2 P53基因对细胞凋亡的影响
采用Annexin V/PI双染法检测细胞凋亡率,H1299,H1299-P53,H1299-175H分别经过电离辐射0GY,4GY,8GY,照射后16小时后进行流式细胞仪检测,结果如图2所示结果显示,H1299(P53-/-)细胞凋亡率随着照射剂量的增加而降低,而H1299-P53、H1299-175随着照射剂量的增加而增加,H1299-P53凋亡增加显著。
2.3 照射后 LC3,Ak t1,MDM 2,Caspase-3蛋白的变化
采用western bolt方法检测AKT1,Caspase-3,MDM 2,LC3的变化,如图3所示,灰度分析显示,LC3在H1299呈现剂量正向依赖性,在H1299-175H呈现剂量负向依赖性,在H1299-P53中,0GY表达最高,4 GY表达最低,8GY表达低于假照组但比4GY高。AKT在H1299细胞随着照射剂量的增加表达逐渐降低,在H1299-P53在4 GY表达量升高而在8 GY又降低,在H1299-175H细胞中AKT随着照射剂量的增加表达逐渐降低。MDM 2在H 1299的表达呈剂量正向依赖性,在H 1299-P53细胞中呈现与AKT相同的变化趋势,在H 1299-175H细胞中4 GY时表达量最高8GY最低。Caspase-3在H1299细胞中随着照射剂量的增加变化不明显,在H1299-P53细胞中呈现剂量正向依赖性,在H1299-175H细胞中,0GY表达最高,4GY表达最低,8GY低于假照组但高于4 GY组。

图2 照射后细胞流式分析结果
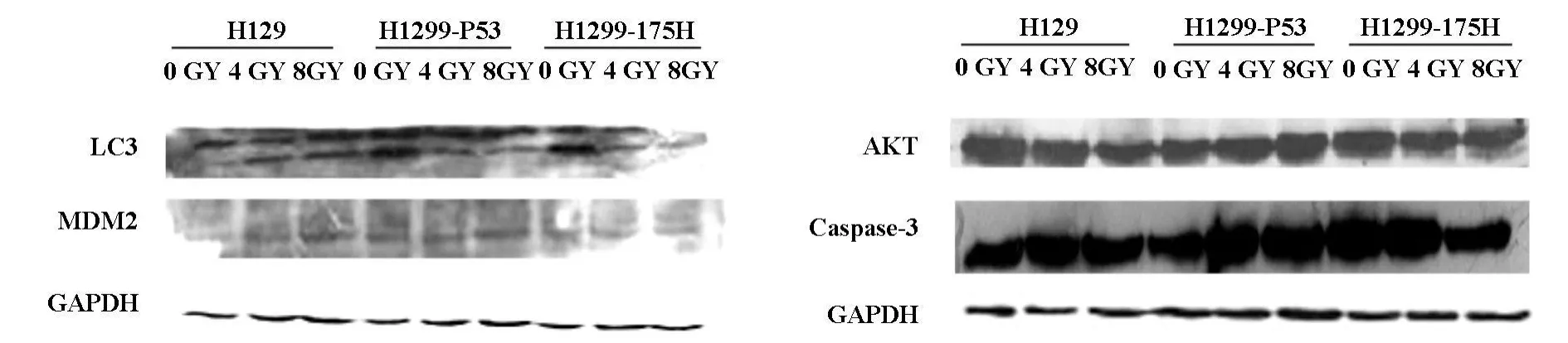
图3 W estern bolt检测凋亡白噬相关蛋白结果
3 讨论
目前,肺癌已经成为导致人类死亡的第二位癌症[6]。放疗是临床上常用的肺癌治疗手段,但是目前常用的放疗方案难以完全杀灭肿瘤细胞,能否运用放射治疗与特定靶点基因联合治疗就成为当前研究热点。
流式细胞术检测细胞凋亡率显示,在H1299(P53-/-)细胞中,照射后凋亡率降低,结果提示电离辐射诱导H1299(P53-/-)的死亡方式不是以凋亡为主。在H1299-P53、H1299-175H细胞中,细胞凋亡率随着剂量增加而增加,H1299-P53凋亡率增加更显著,结果说明P53基因促进细胞发生凋亡。
我们进一步检测自噬相关基因及凋亡相关基因在相同电离辐射条件下的蛋白表达情况。LC3Ⅱ/LC3Ⅰ的表达是自噬的特异性指标,LC3的表达强度与自噬活性密切相关[7]。在H 1299细胞中,LC3Ⅱ/LC3Ⅰ比值随着照射剂量的增加而升高,表明自噬在照射后升高。而H1299-P53细胞中4GY照射组相对于假照组LC3Ⅱ/LC3Ⅰ比值降低,8GY照射组相对于4GY照组LC3Ⅱ/LC3Ⅰ比值升高,表明自噬在照射后降低,说明 P53抑制自噬的发生。在H1299-175H,4 GY照射组相对于假照组LC3Ⅱ/LC3Ⅰ比值降低,8GY照射组相对于4GY照组LLC3Ⅱ/LC3Ⅰ比值也降低,提示P53基因在电离辐射诱导下抑制细胞发生自噬。而三组假照组细胞LC3Ⅱ/LC3Ⅰ依次升高提示P53基因在没有电离辐射条件下促进细胞发生自噬。
Akt是一个PI3KI下游重要的靶激酶,具有丝-苏氨酸激酶活性Akt的活化可以调节细胞内蛋白的各项功能,包括促进细胞转录与增殖、加强细胞的能动性/粘附性、细胞周期进程加速、加速肿瘤血管生成使细胞发生恶性转化[8]。AKT下游有一系列亚基包括FOXO,BAD,MDM 2,TSC2和GSK3,它们来促进细胞增殖、生长与存活[9]。已有文献证实,电离辐射是通过抑制PI3K/AKT而发生自噬[8]。在H1299中AKT的表达量随着照射剂量的增加而降低,表明电离辐射抑制了AKT的表达,从而促进自噬的发生。在H1299-P53细胞中AKT表现呈现剂量正向依赖性,而三组假照组细胞的AKT表达依次降低,说明P53在没有电离辐射条件下抑制AKT的表达促进自噬的发生,三组4GY照射组细胞AKT的变化不显著。
MDM2维持细胞一系列基本功能的关键调节子,也是癌症治疗的很有希望的药物作用靶点。引起人们对MDM2广泛的关注是其与肿瘤抑制蛋白P53的关系[10]。MDM2已经被证实是肿瘤抑制子P53的一个负向调控子,主要通过两种机制:(1)MDM2直接与P53的N末端结合抑制P53的转录激活[10];(2)MDM 2的E3泛素连接酶通过26S蛋白酶来修饰及降解P53[11]。在H1299细胞MDM2的表达呈现剂量依赖性升高,在H1299-P53细胞4G表达最高0GY最低,在H1299-175H细胞中4GY表达最高,8GY回落至最低。三组假照细胞H1299-175H细胞MDM 2增加最明显。4GY照射组依次升高,8GY照射组依次降低。结果提示电离辐射通过激活MDM 2而负向调控P53。
凋亡的特征性指标Caspase-3在H1299细胞中照射后变化不大,说明凋亡不是电离辐射诱导H1299细胞死亡的主要方式。在H1299-P53细胞中,caspase-3呈现剂量正向依赖性,说明p53在电离辐射条件下促进细胞发生自噬.而突变子H1299-175H在照射后凋亡降低,表明突变子已经不具有正常P53的功能。
本课题研究选证实X射线引起H1299 P53(-/-)的死亡主要是以自噬性死亡为主,而引起H1299-P53及H1299-175H的死亡则以凋亡为主,从而为临床寻求新的治疗方案提供理论依据。
[1]Degenhardt K,Mathew R,Beaudoin B,et al.Autophagy promotes tumor cell survival and restricts necrosis,inflammation,and tumorigenesis[J].Cancer Cell,2006,10(1):51.
[2]Lindsey D.M ayo and David B.Donner.The PTEN,Mdm2,p53 tumor suppressor-oncoprotein network[J].TRENDS in Biochemical Sciences,2002 September 27(2):462.
[3]ZhaohuiFeng.P53 Regulation of the IGF-1/AKT/MtorPathways and the Endosomal Compartment[J].Cold Spring HarborPerspectives in Biology,2007,9(1):46.
[4]Dou Z,Pan JA,Lin RZ,ZongWX,et al.The beta identity of class IPtdIns3K:A positive role of p110βin autophagy revealed[J].Autophagy,2011,7(2):246.
[5]高 琳,刘晓冬,马淑梅,等.PI3K I/Akt1在辐射诱导的乳腺癌细胞自噬发生中表达调控及作用机制[J].中国实验诊断学杂志,2010,14(12):1892.
[6]Jacques Ferlay,Hai-Rim Shin,Freddie Bray,et al.Estimatesofworldwide burden of cancer in 2008:GLOBOCAN.
[7]沈 扬,梁立治,洪明晃,等.微管相关蛋白 LC3和自噬基因 Beclin1在上皮性卵巢癌中的表达及其意义[J].癌症,Chinese Journal of Cancer,2008,27(6):595.
[9]KaarbøM,M ikkelsen OL,Maler?d L,,etal.PI3K-AKT-m TOR pathway is dominant over androgen receptor signaling in prostate cancer cells[J].Cellular Oncology,2010,32[1-2]:11.
[10]Momand J,Zambetti GP,O lson DC,George D,Levine AJ.The mdm-2 oncogene product formsa complexwith the p53 protein and inhibits p53-mediated transactivatio[J].Cell,1992,69(7):1237.
[11]Kubbutat MH,Jones SN,Vousden KH.Regulation of p53 stability by Mdm2[J].Nature,1997,387(6630):299.
