泡沫分离法分离水中纳米二氧化钛
2011-02-20张璐璐
张璐璐, 杨 辉, 陈 斌
(陕西科技大学生命科学与工程学院, 陕西 西安 710021)
0 引 言
近年来,利用多相光催化技术处理污水得到了广泛的关注.在常用的各种光催化剂中,二氧化钛(TiO2)由于光敏程度高、成本低等诸多优点,成为最受重视和具有广阔应用前景的光催化剂.在光催化降解过程中,TiO2在反应器中的存在形式主要可以分为两类:悬浮型和负载型[1].由于反应物传质的影响,负载型光催化剂的效率通常不如悬浮型的TiO2,若将固定化光催化剂改为悬浮型的TiO2,则其光催化效率将至少增加10倍,但是从悬浮液中分离回收TiO2是一个很困难的过程[2].
泡沫分离法是利用分离体系(溶液)中存在的表面活性物质,或能与表面活性物质相结合的物质在鼓泡时吸附于泡沫表面而对目标物质进行分离的技术[3].这种方法具有能耗低、设备简单、可以连续进行操作、投资小、可用于体系中微量成分分离等优点.20世纪50年代末以来,国外对该技术进行了大量的研究[2,4-7],直至20世纪80年代末,我国才有一些这方面的报道,且主要集中在两个方面:一是非表面活性剂物质的分离.该技术被广泛地用于工业污水中铜、铁、汞等离子的分离回收以及海水中铀、铝等的富集和原子能工业中含放射性元素的废水处理[8-11];二是表面活性物质的分离以及各种天然或合成表面活性剂的分离,如合成洗涤剂、多肽、蛋白质、酶的分离[12-14].纳米TiO2光催化污水处理系统中TiO2含量低,颗粒小,用沉淀分离、过滤、离心等方法难度大,而泡沫分离法能够很好地分离水中的纳米TiO2,这方面的研究目前国内报道很少.
本文采用泡沫分离技术从水中分离纳米TiO2颗粒,研究了阳离子表面活性剂的用量、溶液pH、溶液离子强度和气体流量等条件对分离效果的影响,旨在为悬浮型光催化反应器的进一步研究和应用提供依据.
1 实验部分
1.1 试剂和仪器
TiO2,锐钛矿,实验室自制(粒径在20~30 nm);NaCl,化学纯,天津市恒兴化学试剂制造有限公司;十六烷基氯化吡啶(RNCl),化学纯,国药集团化学试剂有限公司;盐酸,分析纯,天津大茂化学试剂厂;NaOH,分析纯,天津红岩化学试剂厂.
酸度计(pHS-4C+),成都方舟电子仪器厂;756PC型紫外分光光度计,上海光谱仪器有限公司.

图1 实验装置图
1.2 实验装置
图1为泡沫分离装置示意图,该分离塔为内径3 cm、长度40 cm的有机玻璃管,塔底装有砂板制成的气体分布器.
1.3 实验方法
研究中采用清水代替污水配制TiO2悬浮液,并采用阳离子表面活性剂十六烷基氯化吡啶(RNCl)为吸附剂和起泡剂.精确称量一定量的TiO2加入清水中,制成TiO2悬浮液;配制一定质量浓度的RNCl溶液,量取450 mL于1 000 mL的烧杯中,吸取10 mL制备好的TiO2悬浮液,加入到RNCl溶液中;分别用氢氧化钠或盐酸和氯化钠调整pH值和离子强度,之后取适量样品在650 nm波长下测其吸光度.
将上述的混合液倒入分离塔,利用气体流量计将供气泵的空气流速调整为83 mL/min.所有的实验都在室温下进行.当有泡沫流出时,向收集器中喷洒无水乙醇消泡.待泡沫不再流出时关闭供气泵,测量分离回收液的体积,并量取等体积清水加入到原待分离的混合液中,以清水为参比液,取适量样品在650 nm波长下测量其吸光度,并计算TiO2的质量浓度与起始质量浓度的比值.
2 结果与讨论
2.1 十六烷基氯化吡啶的选择及其质量浓度、pH值对TiO2分离效果的影响
本研究采用氯化十六烷基吡啶(RNCl)作为吸附剂和起泡剂,在水中发生如下反应:
RNCl → RN++ Cl-
(1)

溶液的pH值对分离效果影响较大,这是由于分离体系中除了RNCl的电离以及RN+与nTiO2的结合外,还发生如下反应:
RN++OH-→ RNOH
(2)
上述反应的发生降低了体系中RN+的浓度,从而也降低了TiO2的分离效率.在溶液pH保持不变的情况下,TiO2的吸附量取决于RNCl的质量浓度,RNCl的质量浓度低时吸附量小,随RNCl质量浓度的增加吸附量急剧增加,但RNCl质量浓度大到一定程度时,因TiO2几乎全被吸附分离,其分离效率达到最大,因此继续增加表面活性剂浓度分离效率增加非常缓慢.当溶液中RNCl浓度一定时,TiO2的吸附量取决于pH值的大小,随着pH值的增大,OH-的浓度增大,与OH-结合的RN+的量增加,吸附量减少.图2给出了RNCl的质量浓度和pH值对泡沫分离的影响.图2显示,RNCl质量浓度低于0.25 g/L时,实验结果与上述分析一致.但是,当RNCl质量浓度高于0.27 g/L时,pH值越大,TiO2分离率越高.表面活性剂RNCl是阳离子表面活性剂,为强电解质,在溶液中会电离出带正电荷的RN+,当RNCl质量浓度高于0.27 g/L时,pH增加对于溶液中RN+的量影响不大,这种情况下分离率的主要影响因素为表面活性剂的浓度.另外,相对而言pH值越大,越有利于增加TiO2表面的负电荷,导致TiO2分离率增加.
从图2(b)中可以看出,分离回收液的体积与表面活性剂的浓度和溶液的pH值有关,当pH值和表面活性剂质量浓度较高时,分离回收液的体积较大.实验证明使用阳离子表面活性剂RNCl时,只有TiO2表面带负电荷(悬浮液pH在6.2以上)时分离率最大,在这种情况下,RNCl只通过库仑相互作用吸附表面带有负电荷且具有疏水性的TiO2[2].表面活性剂的质量浓度高,形成的泡沫多,夹带的溶液多,因而分离回收液体积大.pH值较高的情况下,TiO2分离率高,吸附于气泡表面的表面活性剂TiO2复合物多,增加了气泡的厚度和稳定性,分离时回收液体积大.

图2 RNCl浓度以及pH值对TiO2分离的影响
2.2 离子强度对分离率的影响
对于离子型表面活性剂,在其溶液中加入无机盐时,会影响表面活性离子胶束的扩散双电层,减少表面活性离子之间的排斥作用而使双电层平均厚度缩小,从而使胶束容易形成,表面活性得到提高,溶液的表面张力下降,吸附量增加.图3给出了RNCl的质量浓度和离子强度(NaCl浓度)对泡沫分离的影响.从图3(a)中可以看出,离子强度对泡沫分离效果的影响是复杂的,在表面活性剂的质量浓度低于0.20 g/L时,离子强度高,有利于表面活性离子胶束的形成,分离效率高,此时体系中不存在(或非常弱)同离子效应.而在表面活性剂的质量浓度高于0.20 g/L时,高离子强度体系中有较多的Cl-,使得反应(1)的逆反应得以发生,RN+离子浓度降低,因而分离效率比低离子强度体系的低.导致这种变化的另一个原因是TiO2表面双电层所带电荷量减少而不足以和表面活性剂产生吸附作用.然而,当表面活性剂的质量浓度较低时,表面活性剂的吸附量不足以使TiO2呈现疏水性,分离效率也不会高,故增加一定的离子强度可以增加分离效率[2].
图3(b)给出分离回收液的体积变化随着表面活性剂质量浓度的变化情况.如前所述,离子强度增加有利于泡沫形成,所以,在表面活性剂浓度相同的条件下,高离子强度所得到的回收液的体积比低离子强度的大.

图3 RNCl浓度和离子强度对TiO2分离的影响
2.3 气流速度对分离率的影响
图4给出了气流速度对TiO2分离的影响.从图4(a)可以看出,气流速度较高时,TiO2分离率随气流速度的增加而增加,只是RNCl表面活性剂质量浓度低于0.20 g/L时上升较缓,质量浓度高于0.20 g/L时TiO2分离率急剧上升.当RNCl表面活性剂的质量浓度为0.20 g/L时,分离率曲线出现交点,低于0.20 g/L时,空气流速越大,分离率越低,这是由于形成气泡所需气量少,高气流速度导致剪切力增加,气泡稳定性差影响了分离效率;当RNCl质量浓度高于0.20 g/L时,空气流速大,可以形成较多的气泡,而且气泡小,表面积大,吸附能力强,分离率高.
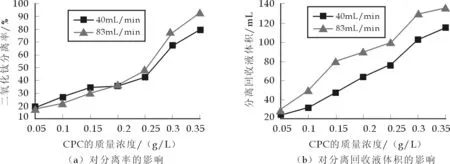
图4 气流速度对TiO2分离的影响
当气流速度较高时,分离回收液的体积在RNCl表面活性剂质量浓度低于0.15 g/L时上升较快,当其高于0.15 g/L时趋于平缓.同时在同一表面活性剂质量浓度条件下,空气流速越大,回收液的体积越大,这也说明空气流速大,能形成较多的气泡,如图4(b)所示.
3 结 论
(1)采用以阳离子表面活性剂十六烷基氯化吡啶为表面活性剂的泡沫分离法分离污水中的TiO2是可行的,其分离效果比较明显,相对于其它分离方法,泡沫分离法简单易行,能耗低,分离率高.
(2)上述泡沫分离法分离TiO2纳米颗粒的主要影响因素有表面活性剂的质量浓度、溶液的pH值、气流速度,当表面活性剂的质量浓度为0.35 g/L、pH值为10.2、气流速度为83 mL/min时可获得最大分离率92.97%.
参考文献
[1] 单志俊,邓慧萍.TiO2光催化氧化技术的研究进展[J] .中国资源综合利用,2007,25(2):7-10.
[2] Shen Y H.Colloidal titanium dioxide separation from water using foam fractionation[J] .Separation Science and Technology,1998,33(16):2 623-2 635.
[3] 郑瑞东,刘 鹰.泡沫分离法的研究进展[J].现代渔业信息,2005, 20(9):3-6.
[4] Bergmann D J, Zhao W.Formulations and performance of soaps and surfactants[J] .China Research Institute of Daily Chemical Industry, 2005,28(10):34-36.
[5] Maruyama H, Seki H, Suzuki A,etal.Batch foam separation of a soluble protein[J].Water Research, 2007, 41(3):710-718.
[6] Aksay S, Mazza G.Optimization of protein recovery by foam separation using response surface methodology[J] .Journal of Food Engineering,2007,79(2):598-606.
[7] Brown L, Narsimhan G, Wankat P C.Foam fractionation of globular protein[J].Biotechnology and Bioengineering,2004,36(9):947-959.
[8] 齐 荣,余兆祥,李佟茗.泡沫分离技术及其发展现状[J] .辽宁化工, 2004,33(9):517-522.
[9] 韦帮森,杨 华.泡沫分离技术在表面活性剂类废水处理工程中的应用[J] .江苏环境科技,2002,15(3):11-12.
[10] 周长春.泡沫分离技术研究进展[J].生物技术通讯,2003,14(1):85-88.
[11] 宋伟光,吴兆亮,刘桂敏,等.泡沫分离除去水溶液中微量金属离子[J].高校化学工程学报,2008,22(5):900-905.
[12] 王春艳,钟 耕.泡沫分离技术在食品成分分离中的应用[J] .中国食品添加剂开发应用,2006,(2):122-125.
[13] 金 玉,陈 雷,殷 建.泡沫分离技术的现状及研究进展[J].民营科技,2008,(11):12.
[14] 高 洁,董文宾,李 菲.泡沫分离技术发展现状及趋势[J].食品科技,2008,(10):99-100.
[15] 张金龙,陈 峰,何 斌.光催化[M] .上海:华东理工大学出版社,2004:16-17.
