SO2 对黑果腺肋花楸果酒的抑菌规律及发酵启动的影响
2011-02-20马兴华韩文忠姜镇荣马艳丽
王 鹏,马兴华,韩文忠,姜镇荣,马艳丽
(辽宁省干旱地区造林研究所,辽宁 朝阳 122000)
黑果腺肋花楸(Aronia melanocarpa)属蔷薇科的落叶灌木,原产于美国,上世纪九十年代初期引入我国。黑果腺肋花楸的果实富含花青素、类黄酮等多种抗氧化性成分[1]。这些成分能够有效地清除生物体内的自由基[2],对于人体保健及防御疾病具有重要的意义。因此,黑果腺肋花楸是一种非常珍贵的药、食两用的经济树种。
在黑果腺肋花楸果酒的酿造前期,果汁需要经过SO2处理,以达到抑制杂菌生长、护色、澄清等目的。但是,由于黑果腺肋花楸果汁中含有大量带有羰基的有机物,其分子中的羰基可以与游离态的SO2相结合,从而使SO2丧失抑制杂菌生长的作用。提高SO2的处理量可以增加果汁中游离态SO2的浓度,但高浓度的SO2又会使发酵的延迟期增长,从而延缓果酒的发酵启动[3]。为了更好地解决黑果腺肋花楸果酒的抑菌与发酵启动的互斥性,本试验试图通过测定SO2在黑果腺肋花楸果汁中的结合率、游离态SO2的变化趋势与抑菌效果,以及不同浓度的SO2对果酒发酵启动的延迟作用,从而总结出SO2对黑果腺肋花楸果酒的抑菌规律、推迟发酵启动的规律以及SO2处理量的最佳区间。
1 材料与方法
1.1 材料
1.1.1 原料及试剂
黑果腺肋花楸果实:辽宁省干旱地区造林研究所提供;酿酒活性干酵母:广东丹宝利酵母有限公司;培养基:PDA-细菌复合培养基;指示剂:甲基红-次甲基蓝混合指示剂;
其他药品:偏重亚硫酸钠、氢氧化钠、双氧水和磷酸均为分析纯。
1.1.2 仪器与设备
电子天平:梅特勒仪器(上海)有限公司;培养箱:上海一恒科学仪器有限公司;超净工作台:苏州苏洁净化设备有限公司;高压灭菌锅:铁岭医疗器械总厂;真空泵:上海亚荣生化仪器厂;热电炉:北京市永光明医疗仪器。
1.1.3 分析方法
游离态SO2及SO2总量的测定:GB/T 15038-2005,氧化-中和法。
活菌总数的测定:平板菌落计数法。
1.2 方法
1.2.1 黑果腺肋花楸果汁中SO2结合率的测定、游离态SO2的变化及抑菌效果的测定
果实→挑选→清洗→沥干→榨汁→不同浓度SO2处理→在20~22℃条件下半密封保存→每24 h测定一次游离态SO2浓度、总SO2浓度及活菌总数,计算SO2结合率,计算公式见公式(1)。

1.2.2 接种后果汁中游离态SO2的变化及发酵启动情况
果汁→不同浓度SO2处理→24 h后接种酵母菌→每12 h测定1次游离态SO2浓度及观察发酵启动的情况。
2 结果与分析
2.1 黑果腺肋花楸果汁中SO2 结合率的变化
利用不同浓度的SO2处理花楸果汁,测定各样品游离态SO2浓度及总SO2浓度,并计算SO2的结合率,结果见图1。
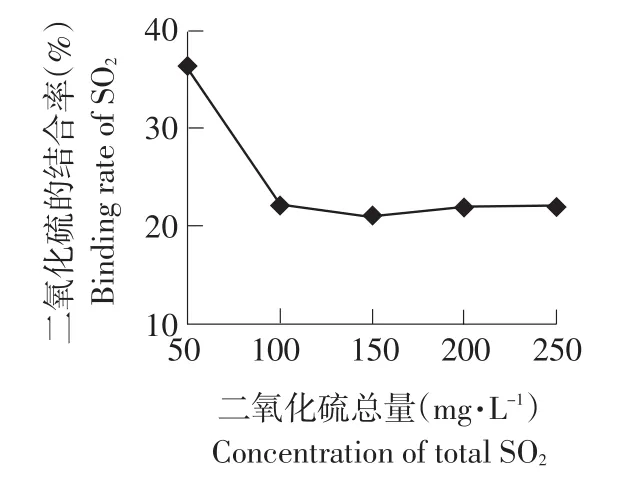
图1 花楸果汁中二氧化硫的结合率随不同处理浓度的变化Fig.1 Variation of the binding rate of SO2 in aronia juice along with different concentrations of SO2
由图1可知,当 SO2处理浓度为 50 mg·L-1时,黑果腺肋花楸果汁中SO2的结合率在35%以上。而当SO2处理浓度大于100 mg·L-1时,黑果腺肋花楸果汁中SO2的结合率处于20%~25%之间,即此时的结合率为相对稳定的值。这说明当SO2处理浓度在100 mg·L-1以上时,羰基化合物与SO2的结合在短时间内形成一种动态的平衡。果汁中SO2与羰基化合物的反应式见公式(2)[5]。
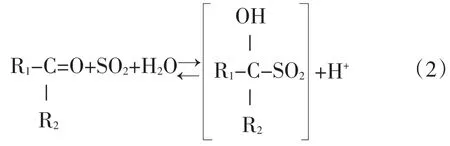
此反应为可逆反应。当SO2浓度很低时,由于反应物中羰基化合物相对过量,化学反应向正方向移动,因此SO2的结合率很高。当SO2处理浓度大于100 mg·L-1时,此反应进入动态平衡状态,即结合态SO2占SO2总量的比例保持不变。此时SO2的结合率约为22%。
2.2 黑果腺肋花楸果汁中游离态SO2 随时间的变化及抑菌效果
利用不同浓度的SO2处理花楸果汁,测定游离态SO2随时间的变化及抑菌效果,结果见图2、3。
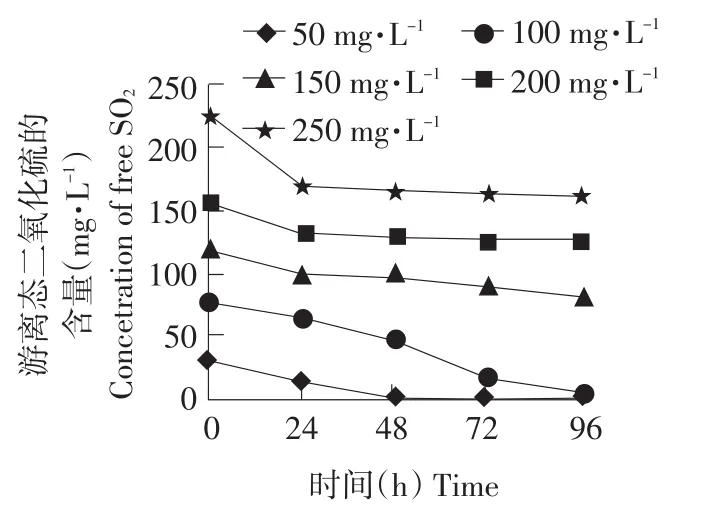
图2 花楸果汁中游离态二氧化硫随时间的变化Fig.2 Variation of the free SO2 in aronia juice along with time
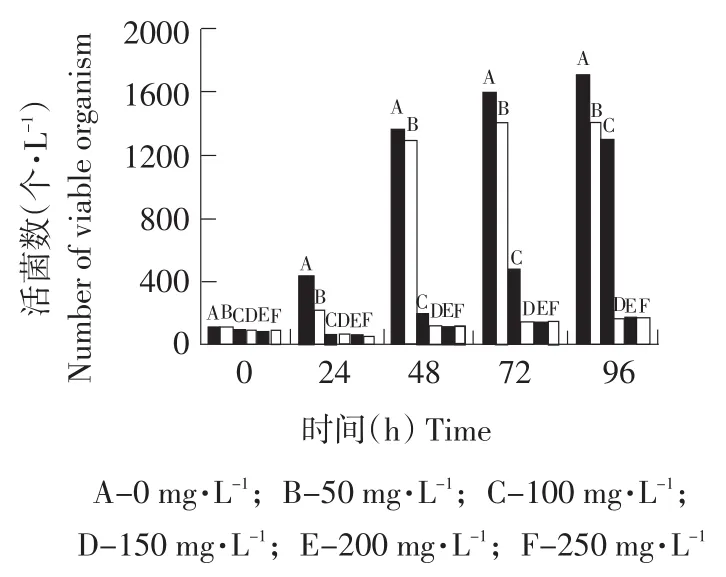
图3 二氧化硫处理后活菌数随时间的变化Fig.3 Variation of the number of viable organism along with time after SO2 treatment
由图2可知,花楸果汁中游离态SO2浓度会逐渐减小。当SO2处理量≥150 mg·L-1时,游离态SO2浓度在24~48 h保持相对稳定。这说明羰基化合物与SO2的结合为暂时的动态平衡,它将逐渐地转移为另一平衡。即当SO2处理花楸果汁时,羰基化合物与SO2的结合会立即达到平衡,此时SO2的结合率相对稳定。但此平衡是暂时的,它会缓慢地向另一个平衡转移,并最终达到新的平衡。综合图2、3可以看出,样品D、E和F的抑菌效果最好。原因是这些样品中含有较高浓度且稳定的游离态SO2。样品B(SO2处理量为50 mg·L-1)中游离态SO2在24 h内开始迅速降低,其活菌数出现明显增加。样品C(SO2处理量为100 mg·L-1)中游离态SO2在24~72 h开始迅速降低,尤其48~72 h降幅最大,并在72 h后降低到15 mg·L-1以下,其活菌数开始明显增加。综上所述,当果汁中保持很高浓度的游离态SO2时,活菌数没有出现明显变化情况,当游离态SO2降到很低浓度时,活菌数会明显增加。因此,保持较高浓度的游离态SO2是抑制杂菌生长的关键。
2.3 接种后游离态SO2的变化及发酵启动
利用不同浓度的SO2处理花楸果汁,测定接种后果汁中游离态SO2的变化及观察发酵启动情况,结果见图4和表1。
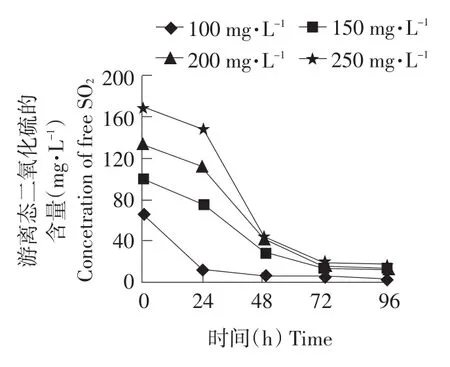
图4 花楸果汁中游离态二氧化硫随时间的变化Fig.4 Variation of the free SO2 in aronia juice along with time

表1 二氧化硫处理后的发酵启动现象Table 1 Phenomena of starting the fermentation after SO2 treatment
从图4可以看出,接种酵母菌后,各样品的游离态SO2均迅速降低,并最终低于15 mg·L-1。这是因为酵母菌对SO2的抗性与其他杂菌相比较强。当接种相当数量的酵母菌后,菌体代谢产生CO2,降低了果汁中SO2的分气压[9],使SO2不断地从果汁中挥发出来,而这个过程又会降低SO2对酵母菌代谢的阻碍,使其产生更多的CO2。并且,溶解在水中的CO2也会使SO2与羰基化合物的结合向正反应方向移动,增加了SO2的结合率。当果汁中游离态SO2降低到一定程度时,酵母菌完全突破游离态SO2的限制,此时发酵开始启动了。从图4可知,SO2处理量为 100 mg·L-1时,游离态 SO2的降速最快。在12 h内降到15 mg·L-1以下。从表1也可以看出,此样品在12 h内出现发酵启动,而其他样品则是在24~36 h出现发酵启动。原因是处理量为100 mg·L-1样品的SO2初始浓度较低,因此其下降速度也较快,它的发酵延迟时间就比较短。
3 讨论
当SO2处理黑果腺肋花楸果汁时,SO2首先会杀死一部分杂菌,并抑制剩余杂菌的生长。本试验仅对SO2的抑菌效果进行了研究,并没有对SO2的杀菌效果与处理时间的关系进行研究。根据相关资料[5],当SO2处理时间为24h时,杀菌效果达到最好。因此本试验选择SO2处理24h后接种酵母菌。
根据本试验的结果与分析,如果将SO2处理时间设为24 h,发酵启动时间设为12 h,则SO2处理量应为 100 mg·L-1;如果将 SO2处理时间设为48 h,发酵启动时间设为24~36 h,则SO2处理量可选择150 mg·L-1。也可以根据黑果腺肋花楸果酒实际加工需要,选择两者之间的数值。但在实际果酒加工中,生产者往往希望在SO2处理效果满足要求的情况下,发酵启动越快越好,并且生产者也倾向于添加较少的SO2。因此,在黑果腺肋花楸果酒加工中,应将100 mg·L-1的SO2处理量作为首先考虑的应用参数。
4 结论
a.SO2处理黑果腺肋花楸果汁时,果汁中羰基化合物与SO2的结合会在较短时间内达到一个平衡。但这一平衡是暂时的。在24~48 h内,它会缓慢地向另一个平衡转移,并达到新的平衡。
b.花楸果汁中游离态SO2的浓度会随时间逐渐变小。当SO2处理量为50 mg·L-1时,杂菌在24 h内出现明显增殖;当SO2处理量为100 mg·L-1时,在48~72 h,杂菌在24~48 h出现明显增殖;当SO2处理量≥150 mg·L-1时,96 h后游离态SO2应然保持较高浓度,且杂菌没有出现明显增殖。
c.接种酵母菌后,各样品的游离态SO2全部迅速降低。当SO2处理量为100 mg·L-1时,在12 h内发酵开始启动;当SO2处理量≥150 mg·L-1时,在24~36 h发酵开始启动。
d.根据结论2和3可以得出SO2处理量的最佳区间为100~150 mg·L-1。
[1]Wawer I.The power of nature aronia melanocarpa[M].UK:Nature's Print Ltd.,2006:91-95.
[2]Oszmianski J.Wojdylo A.Aronia melanocarpa phenolics and their antioxidant activity[J].Eur Food Res Technol,2005,221:809-813.
[3]方强,籍保平,乔勇进,等.果酒中二氧化硫及其控制技术的研究进展[J].农业工程技术,2008(2):15-20.
[4]吴连军,于玲,杜金华.SO2对石榴酒发酵的影响研究[J].酿酒,2007(2):76-78.
[5]李华,王华,袁春龙.葡萄酒工艺学[M].北京:科学出版社,2007:131-139.
[6]方强,籍保平,李博.营养素对苹果酒中结合SO2影响的研究[J].食品科学,2005(2):127-132.
[7]李刚,张浩,张永凤.柿子果酒稳定性研究[J].河南科技学院学报,2006(12):67-69.
[8]吴谋成.食品分析与感官评定[M].北京:中国农业出版社,2002:83-95.
[9]李华,单祖华,王华.二氧化碳对酿酒酵母生长代谢的抑制[J].科技导报,2008(5):31-34.
[10]何国庆.食品发酵与酿造工艺学[M].北京:中国农业出版社,2001:162-171.
