禽多杀性巴氏杆菌OmpA DNA疫苗免疫效果的研究①
2011-02-06王帅涛秦翠丽牛明福侯玉泽张勇法孙晓菲
宫 强 王帅涛 秦翠丽 牛明福 程 茗 侯玉泽 张勇法 孙晓菲
(河南科技大学,洛阳 471003)
禽多杀性巴氏杆菌OmpA DNA疫苗免疫效果的研究①
宫 强 王帅涛 秦翠丽 牛明福 程 茗 侯玉泽 张勇法 孙晓菲
(河南科技大学,洛阳 471003)
目的:研究禽多杀性巴氏杆菌OmpA DNA疫苗在鸡体内诱导的免疫保护效果。方法:PCR扩增禽多杀性巴氏杆菌的ompa基因片段,克隆入pcDNA3.1(+)上,构建重组质粒pOMPA,体外转染SP2/0细胞,RT-PCR和免疫荧光试验检测目的基因的转录及表达情况。动物免疫共分四组:pOMPA组、弱毒疫苗组、pCDNA3.1(+)空载体组和PBS对照组,每组15只4周龄鸡,除弱毒疫苗组外其他三组均肌注免疫三次,每次间隔两周,弱毒疫苗组仅首免时肌注1羽份/每只鸡。间接ELISA检测免疫后血清特异性抗体水平,MTT法检测免疫鸡外周血淋巴细胞增殖情况,双抗夹心ELISA检测IFN~γ分泌情况,强毒攻击,计算免疫鸡存活数目及保护率。结果:体外转染检测结果表明pOMPA可在体外培养的细胞中表达目的蛋白。动物免疫后,DNA疫苗组和弱毒疫苗组血清抗体水平持续上升,与两对照组相比差异极显著(P<0.01),且弱毒疫苗组血清抗体水平明显高于DNA疫苗组(P<0.05)。经提取的外膜蛋白(Omps)诱生后,两疫苗组的SI值极显著高于pCDNA3.1(+)组和PBS免疫组(P<0.01),两疫苗组之间则无差别。两疫苗组免疫鸡外周血淋巴细胞产生的IFN-γ极显著高于两对照组(P<0.01)。强毒攻击后DNA疫苗组和弱毒疫苗组的保护率分别为60%和73.3%。结论:成功构建了禽多杀性巴氏杆菌OmpADNA疫苗,该疫苗为动物提供一定的免疫保护力,但不够理想。
禽多杀性巴氏杆菌;OmpA DNA疫苗;免疫应答;保护效果
禽霍乱亦称为禽出血性败血症,是由禽多杀性巴氏杆菌病引起的多种禽类的传染病,目前仍是威胁我国养禽业健康发展的重大疫病之一。由于该病发病急、死亡快、治疗不及时会造成家禽大量死亡,据统计,我国每年因禽霍乱死亡的鸡几乎可达家禽疫病死亡数的50%[1]。对于该病的控制措施目前主要采用的仍是口服抗菌素类药物,如青霉素、链霉素、土霉素等,但抗菌药物长期应用易导致病原菌产生耐药性,且可能会对禽体产生明显毒害作用,蛋鸡用后产蛋率会明显下降,从而降低了经济效益。因此,为防患于未然,从根本上控制本病,必须应用有效的疫苗进行预防。
预防禽多杀性巴氏杆菌病的疫苗主要有弱毒疫苗和灭活疫苗两种,但禽多杀性巴氏杆菌抗原结构较为复杂,且易发生变异,导致弱毒疫苗的免疫效果并不理想。现有的市售弱毒苗免疫期较短、保护力较低、副作用偏大,应用不当会引起产蛋鸡的产蛋率下降甚至会引起该病的流行[2]。而灭活苗的免疫效果又弱于弱毒活疫苗,因此,研制禽霍乱新型疫苗势在必行。新型疫苗包括重组亚单位疫苗、DNA疫苗、活载体疫苗等。自1990年Wolff发现DNA疫苗以来,因其具有诱导全面免疫应答的能力,已成为疫苗研究领域的热点,受到了全世界的广泛关注,被誉为第三代疫苗。人们已对多种动物传染病如NDV、ILT、AIV等的DNA疫苗进行了深入研究,然而,目前针对多杀性巴氏杆菌病新型疫苗的研究主要集中在重组亚单位疫苗上,且大多针对于猪巴氏杆菌病,禽霍乱DNA疫苗的研究则相对较少[3-7]。
本研究以禽多杀性巴氏杆菌外膜蛋白之一OmpA的编码基因构建了相应的DNA疫苗pOMPA,导入哺乳动物细胞中进行了表达,并通过动物实验检测了该疫苗的免疫保护效果,为研制新型禽霍乱疫苗提供了一定的理论依据。
1 材料与方法
1.1 材料
1.1.1 菌种和细胞 禽多杀性巴氏杆菌CVCC474菌株购自中国兽医药品监察所;禽多杀性巴氏杆菌弱毒活疫苗为齐鲁动物保健品有限公司产品;大肠杆菌感受态细胞DH5α、SP2/0细胞为本实验室保存。
1.1.2 实验动物 1日龄雏鸡购自河南省实验动物中心。
1.1.3 主要试剂 真核表达载体pCDNA3.1(+)为本实验室保存;限制性内切酶、连接酶为MBI公司产品;HRP标记的兔抗鸡IgG、FITC标记的山羊抗兔IgG购自北京希凯创新科技有限公司;RPMI1640液体培养基为Sigma公司产品;脂质体2000为Invitrogen公司产品;鸡IFN-γ检测试剂盒购自上海源叶生物科技有限公司;MTT购自上海华舜生物工程有限公司。
1.2 方法
1.2.1 DNA疫苗的构建 设计合成禽多杀性巴氏杆菌ompa基因序列引物,上游含有KpnⅠ位点,下游含BamHⅠ位点。以全基因组为模板,PCR扩增该基因,回收后连接T载体,双酶切后亚克隆到真核载体pcDNA3.1(+)的相应位点,构建重组质粒pOMPA,即OmpA-DNA 疫苗 。
1.2.2 禽巴氏杆菌外膜蛋白抗血清的制备 超声波裂解法提取禽多杀性巴氏杆菌总外膜蛋白(Omps)[8],Bradford法测定蛋白浓度。加入矿物油乳化成疫苗免疫兔子,抗原含量为2mg/m l,每只兔注射1m l,采用背部多点注射,共免疫三次,每次间隔2周,采血检测抗体效价后备用。
1.2.3 DNA疫苗的转染及检测 将SP2/0细胞传代于24孔细胞培养板中,待细胞密度达80%左右时取脂质体2000和重组质粒pOMPA在250μl细胞培养液中充分混匀。室温作用20~30分钟,加入800μl新鲜的完全培养液,混匀后加入细胞培养板中,设转染空载体pcDNA3.1(+)的细胞为阴性对照。37℃5%CO2培养48~72小时后收获细胞以RT-PCR和间接免疫荧光检测目的基因的转录及其表达情况。
1.2.4 动物免疫 1日龄非免疫雏鸡共60只,饲养至四周龄时随机平均分为四组,即pOMPA组、pCDNA 3.1(+)组、弱毒活疫苗组及PBS对照组。重组质粒体外转染表达后,碱裂解法大量制备质粒pOMPA和pCDNA3.1(+),PEG法纯化,溶于1×PBS(pH 7.2)中,分光光度计测定其浓度和纯度并用上述PBS调整浓度为1μg/μl,进行动物免疫。DNA疫苗组和空载组采用肌肉注射,每只鸡200μl,PBS对照组每只肌注200μl1×PBS(pH 7.2),各组均免疫三次,每次间隔两周。弱毒活疫苗组仅于首免时肌注1羽份/每只鸡。
1.2.5 间接ELISA试验 一免后每周采血,分离血清,-20℃保存待检。以禽多杀性巴氏杆菌菌悬液为包被抗原,包被浓度为109个/ml,室温湿盒内包被过夜。用5%的BSA封闭后加入1∶100倍稀释的待检血清,37℃湿盒内作用1.5小时后加入HRP-兔抗鸡IgG作用1.5小时,加入OPD暗室内显色10分钟后用2mol/LH2SO4终止反应,在OD490处测定吸收值以确定免疫鸡血清抗体水平,共检测6周。
1.2.6 淋巴细胞增殖试验 各免疫组分别于一免2周、二免2周和三免2周时对免疫动物进行心脏采血,分离外周血淋巴细胞,细胞计数后调整浓度为1×107个/ml。96孔细胞培养板每孔加入50μl细胞悬液。试验孔和阴性对照孔各设3个重复,试验孔每孔加入50μl 20μg/m l提取的巴氏杆菌外膜蛋白,阴性对照孔每孔加入50μl RPM I1640培养液,置37℃,5%CO2培养箱培养 60小时后,每孔加入5 mg/mlMTT 10μl,继续培养3小时。然后每孔加100 μl SDS-HCl,继续作用2小时终止反应,测定OD570吸光值 ,计算 :刺激值(SI)=OD(试验孔)/OD(阴性对照孔)[9]。
1.2.7 IFN-γ检测 分别于初免2、4和6周后制备浓度为1×107个/m l的外周血淋巴细胞。以Omps进行刺激,37℃5%CO2培养箱中培养60小时后,吸取培养上清离心收集后-20℃保存。按照检测试剂盒制作标准曲线,对各组免疫鸡分泌的IFN-γ进行检测。
1.2.8 动物攻毒试验 第三次免疫2周后,以禽多杀性巴氏杆菌强毒株CVCC474攻毒,攻毒剂量为5 LD50/只,观察2周,记录各组试验动物的死亡数量,计算各疫苗组的保护率。
2 结果
2.1 体外表达结果 提取转染有重组质粒和空载体的细胞总RNA,进行RT-PCR扩增,结果表明,转染了pOMPA的细胞中扩增出了目的片段,而空载体转染的细胞中未扩增出相应片段(图1A),说明目的基因在该细胞中进行了转录。间接免疫荧光分析结果也表明,转染了重组质粒的细胞在倒置显微镜下可见到荧光出现,而空载体转染的细胞中则无荧光(图1B、C),表明该重组质粒在哺乳动物细胞中获得了表达。

图1 pOMPA转染的RT-PCR(A)和间接免疫荧光检测(B、C)Fig.1 The Results of RT-PCR(A)and indirect immunofluorescent test(B,C)
2.2 ELISA抗体检测结果 以间接ELISA法对免疫后鸡血清中的抗体水平进行检测。结果pOMPA组和弱毒活疫苗组抗体水平呈现逐渐上升趋势,与空载体和PBS对照组相比差异极为显著(P<0.01),两对照组血清抗体水平则始终维持在较低水平。DNA疫苗组虽经3次免疫,但其检测到的抗体水平却仍低于弱毒活疫苗免疫组(P<0.05,图2)。
2.3 MTT检测结果 分别于三次免疫后两周时,心脏采血制备免疫鸡外周血淋巴细胞悬液,以禽多杀性巴氏杆菌Omps进行刺激,MTT法检测其增殖情况。结果初免后各组的刺激值差别不大,二免和三免后弱毒疫苗组和pOMPA组的SI值极显著高于两对照组(P<0.01),但两疫苗组之间则几乎无差异(P>0.05,图3)。
2.4 IFN-γ检测结果 一免2、4和 6周后,采取免疫鸡血,制备外周血淋巴细胞悬液,以Omps为刺激物进行诱导,收集上清,检测IFN-γ的分泌量。结果如图4,一免后各组分泌的IFN-γ虽有差别,但差异不明显(P>0.05);二免和三免后DNA疫苗组和弱毒疫苗组免疫鸡外周血淋巴细胞分泌的IFN-γ的量极显著高于两对照组(P<0.01),且pOMPA组的分泌量稍高于弱毒疫苗组,但两者差别不大(P>0.05)。
2.5 免疫保护效果检测 免疫动物于三免两周后以禽多杀性巴氏杆菌强毒进行攻击,观察两周内的死亡数。结果两对照组免疫鸡几乎全部死亡,而DNA疫苗组和弱毒活疫苗组死亡鸡较少,且前者死亡鸡数目多于后者,结果如表1所示。
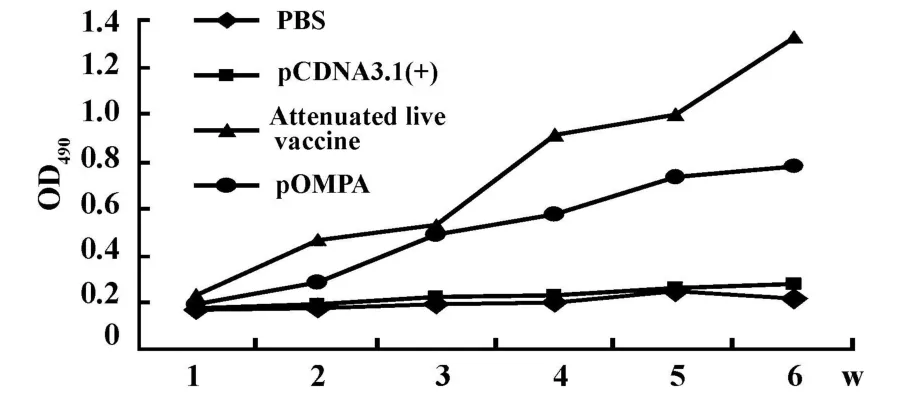
图2 血清中抗体的动态变化结果Fig.2 The p rofile of serum antibody

图3 MTT试验结果情况(SI,±s)Fig.3 The SI value of lymphocytes proliferation from immunized chickens(SI,±s)

图4 IFN-γ分泌情况Fig.4 The level of IFN-γsecred by peripheralblood lymphocytes from immunized chickens

表1 攻毒试验结果Tab.1 Protection of immunized chickens against lethal challenge with avian Pasteurellamuhocida
3 讨论
病原菌的外膜蛋白成分(Omps)不仅在细菌的营养摄取、代谢物质的运输、细菌正常形态的维持以及物质的合成等方面起着重要的作用,而且还具有一定的免疫原性[10,11]。对其深入研究将有助于明确其在病原菌的致病和免疫过程中的作用,为研制相应的新型疫苗奠定基础。目前已有研究表明,Omps在保护禽多杀性巴氏杆菌感染方面起着重要的作用[12]。禽多杀性巴氏杆菌的外膜蛋白包括主要蛋白和微量蛋白两种,主要蛋白包括OmpA和OmpH等。已有研究表明多杀性巴氏杆菌的OmpA抗体能够为机体提供一定的保护[13],但也有研究表明OmpA蛋白虽能诱导实验动物产生较高水平的抗体应答,但不能提供足够的保护力[14]。因此,多杀性巴氏杆菌外膜蛋白A的免疫保护效果还没定论,而且,目前还未见有OmpA DNA疫苗的研究报道。
本实验以禽多杀性巴氏杆菌全基因组为模板,扩增了主要外膜蛋白基因ompa,并构建了DNA疫苗pOMPA,体外转染检测了目的基因的转录和表达情况。结果表明构建的pOMPA可在哺乳动物细胞中表达目的蛋白,从而为进一步研究该疫苗的免疫保护效果奠定了基础。
抗体应答在动物抗多杀性巴氏杆菌感染的过程中具有重要的作用,亚单位疫苗则可诱导机体产生较高水平的抗体,因此人们对此类疫苗的研究较为深入[15,16]。然而,目前已知细胞免疫应答在抗多杀性巴氏杆菌免疫中也具有举足轻重的作用,而DNA疫苗则可有效地诱导细胞免疫反应[17]。本研究同时对OmpA-DNA疫苗免疫后诱导的体液和细胞免疫应答进行了检测。DNA疫苗和弱毒活疫苗免疫后均可诱导机体产生较高水平的抗体,但由于试验所用包被用抗原为禽多杀性巴氏杆菌全菌体,其成分较为复杂,抗原之间可能会存在竞争吸附,使包被于酶标板上的各成分的含量均相对较少,故检测到的针对于单一抗原的抗体水平不是很高,因此DNA疫苗组的抗体检测结果低于弱毒疫苗组。若要提高OmpA-DNA疫苗的检测效果可用提取的禽多杀性巴氏杆菌外膜蛋白Omps作为包被抗原进行ELISA试验检测,或者构建ompa基因的原核表达载体,获得纯化的重组蛋白后以其作为包被抗原进行检测。
MTT试验是检测细胞免疫功能指标的常用方法之一,常通过淋巴细胞对ConA刺激后的转化的程度来衡量T淋巴细胞的应答功能。但ConA作为一种非特异性有丝分裂原,其诱导的淋巴细胞增殖水平较易受到环境因素的影响,因而本研究采用禽多杀性巴氏杆菌Omps为特异性刺激原,检测经其诱导后免疫鸡外周血淋巴细胞的增殖水平。结果表明二免和三免后弱毒疫苗组和pOMPA组的SI值明显高于对照组。本研究同时对疫苗免疫后诱导的Th1型细胞因子IFN-γ的分泌量进行了检测。结果两疫苗组均可刺激机体产生较高水平的IFN-γ,且两对照组分泌的水平则很低。因此,MTT试验和IFN-γ检测试验表明本研究构建的pOMPA疫苗同弱毒活疫苗均可有效地诱导机体产生一定的细胞免疫应答。动物攻毒保护试验是评价疫苗保护效果的最准确的指标之一,三次免疫后以强毒株对免疫鸡进行攻击,结果表明DNA疫苗可为免疫动物提供60%的保护力,弱毒活疫苗的保护率则可达73.3%,因此,本研究构建的禽多杀性巴氏杆菌OmpA-DNA疫苗在对抗禽霍乱方面有一定的效果,但不及传统的弱毒活疫苗理想。
本研究成功构建了禽多杀性巴氏杆菌OmpADNA疫苗pOMPA,动物实验结果表明该疫苗可诱导实验动物产生一定水平的体液和细胞免疫应答,并可为免疫动物提供一定的保护力,但效果不及传统弱毒活疫苗,其原因可能在于ompa基因仅为禽多杀性巴氏杆菌众多保护性抗原基因之一,因此OmpADNA疫苗所含抗原表位不够丰富,不能诱导机体产生足以抵抗强毒攻击的保护力。可尝试利用ompa基因与禽多杀性巴氏杆菌的其他保护性抗原基因如omph、plpb等构建多基因融合DNA疫苗或多价联合DNA疫苗,从而为进一步研究禽霍乱高效新型疫苗奠定基础。
1 熊玲玲.娄底地区禽霍乱流行情况及防制对策[J].中国兽医杂志,1999;25(8):25-27.
2 Mariana S,Hirst R.The immunogenicity and pathogenicity ofPasteurella multocidaisolated from poultry in Indonesia[J].VetM icrobiol,2000;72(1-2):27-36.
3 Liao CM,Huang C J,Hsuan S Letal.Immunogenicity and efficacy of three recombinant subunitPasteurellamultocidatoxin vaccines against progressive atrophic rhinitis in pigs[J].Vaccine,2006;24(1):27-35.
4 Sthitmatee N,Numee S,Kawamoto Eetal.Protection of chickens from fow l cholera by vaccination with recombinant adhesive protein ofPasteurellamultocida[J].Vaccine,2008;26(19):2398-2407.
5 Dabo SM,Confer A,Montelongo Metal.Vaccination withPasteurella multocidarecombinant OmpA inducesstrong but non-protective and deleterious Th2-type immune response inmice[J].Vaccine,2008;26(34):4345-4351.
6 Hsuan SL,LiaoCM,Huang Cetal.Efficacy of anovelPasteurellamultocidavaccine against progressive atrophic rhinitis of swine[J].Vaccine,2009;27(22):2923-2929.
7 Register K B,Sacco RE,Brockmeier S L.Immune response inmice and swine to DNA vaccines derived from thePasteurellamultocidatoxin gene[J].Vaccine,2007;25(32):6118-6128.
8 胡晓娜,朱瑞良,刘红珍etal.禽波氏杆菌外膜蛋白的提取及其免疫原性的检测[J].微生物学报,2007;47(7):714-717.
9 宫 强,刘思国,王春来etal.牛分枝杆菌二价组合及融合DNA疫苗的免疫效果[J].中国兽医学报,2009;2(2):134-138.
10 Gupta V K,RoutPK,V ihan V S.Induction of immune response inm ice with a DNA vaccine encoding outermembrane protein(omp31)ofBrucellamelitensis16M[J].Res Vet Sci,2007;82(3):305-313.
11 Bosch H,Frey J.Interference of outermembrane protein PalAwith protective immunity against Actinobacillus pleuropneumoniae infections in vaccinated pigs[J].Vaccine,2003;21(25-26):3601-3607.
12 ConferAW,金光明.牛对多杀性巴氏杆菌A:3外膜蛋白的抗体反应[J].国外兽医学—畜禽传染病,1998;18(1):34-36.
13 Lu Y S,LaiW C,PakesPetal.A monoclonalantibodiesagainst aPasteurellamultocida outer membrane protein protects rabbits and mice againstpasteurellosis[J].Infect Immun,1999;59:172-180.
14 Gatto N T,Dabo SM,Hancock R Eetal.Characterization of,and immune responses ofm ice to,the purified OmpA-equivalent outermembraneprotein of Pasteurellamultocida serotype A:3[J].VetM icrobiol,2002;87(3):221-235.
15 曹素芳,黄青云.禽多杀性巴氏杆菌一成熟外膜蛋白重组亚单位疫苗免疫效果的研究[J].中国兽医科学,2006;36(6):464-467.
16 Chitra H,Pankaj K,Mithilesh Setal.Experimental iron-inactivatedPasteurellamultocidaA(1):vaccine adjuvanted with bacterial DNA is safe and protects chickens from fow l cholera[J].Vaccine,2010;28(11):2284-2289.
17 王军阳,范桂香,胜 利etal.DNA核酸疫苗诱导小鼠免疫应答的作用[J].西安医科大学学报,2002;23(3):249-251.
[收稿2010-09-27 修回2010-10-18]
(编辑 许四平)
The immune efficacy ofOmpA-DNA vaccine against avian pasteurella multocida
GONGQiang,WANGShuai-Tao,QINCui-Li,NIUMing-Fu,CHENGMing,HOUYu-Ze,ZHANGYong-Fa,SUNXiao-Fei.HenanUniversityofScience&Technology,Luoyang471003,China
Objective:To researchon protective immunity ofOmpA-DNA vaccine against fow l cholera in chickens.Methods:Theom pa gene fragmentamplified by PCR from avian Pasteurellamultocidawas cloned into the eukaryotic expression vector pcDNA3.1(+),and the recombinantplasmid pOMPA was constructed.Then the recombinantp lasmidwas transfected into SP2/0 cells in vitro.The transcription and expression of targetgenewereanalyzed by RT-PCR and indirect immunofluorescence.Fourgroupsof chickensnamed pOMPA,attenuated live vaccine,pCDNA3.1(+)and PBSwere vaccinated with the DNA vaccine,attenuated live vaccine,control vector and PBS respectively.The serum antibodieswere detected by indirect ELISA.The peripheral blood lymphocyte(PBLC)p roliferation and secreted of PBLCwere tested byMTT.The immunized chickenswere challengedwith virulentof avian Pasteurellamu ltocidaon week 2 post the third immunization,and the protection ratewas counted.Results:RT-PCR and indirect immunofluorescence showed that the ompagene could be transfected into SP2/0 cells in vitro and the target proteinwas expressed.Indirect ELISA showed that the levels of antibodies in DNA vaccine group and attenuated live vaccine group weremost significantly higher than thoseof the othergroups(P<0.01),and thatof the former lower than thatof the latter(P<0.05).MTT experiments indicated that the SIvalue inducedwith avian PasteurellamultocidaOmps in the two vaccinegroupswere significantly higher than those of pCDNA3.1(+)and PBSgroups(P<0.01),and the two vaccines groupswere indiscriminate.The IFN-γexperiments displayed that the levels of IFN-γinduced withOmps in thegroups of pOMPA and attenuated vaccineweremostly higher than those of the control groups(P<0.01).The protection rate of DNA vaccineand attenuated live vaccinewere 60%and 73.3%respectively.Conclusion:TheOmpA-DNA vaccine against fow l cholerahas been constructed successfully.The DNA vaccine cou ld enhance the immunity level and the p rotectiveeffectagainst fowl cholera,but is barely satisfactory.
AvainPasteurellamuhocida;OmpA DNA vaccine;Immune response;Protective effect
S855.1
A
1000-484X(2011)05-0454-05
10.3969/j.issn.1000-484X.2011.05.017
①本文为河南省重点科技攻关计划项目(092102110162)
宫 强(1979年-),男,博士,主要从事兽医分子生物学与免疫学研究,E-mail:qianggong79@yahoo.com.cn。