Elafin真核表达载体的构建及其对气道粘液高分泌的调节①
2011-02-06余红梅尤列皮尔曼维克多科罗索夫周向东
余红梅 李 琪 尤列·皮尔曼 维克多·科罗索夫 周向东
(重庆医科大学附属第二医院呼吸内科,重庆 400010)
Elafin真核表达载体的构建及其对气道粘液高分泌的调节①
余红梅 李 琪 尤列·皮尔曼②维克多·科罗索夫②周向东
(重庆医科大学附属第二医院呼吸内科,重庆 400010)
目的:构建天然内生多肽Elafin真核表达载体,探讨其对气道粘液高分泌的影响。方法:抽提Elafin行RT-PCR获取Elafin cDNA,双酶切后将片段装载到pMD18-T载体上。以pMD18-T-Elafin为模板行PCR反应,产物胶回收并双酶切后定向克隆至pEGFP-N1上,转化,筛选,双酶切鉴定重组质粒。将pEGFP-N1-Elafin转染正常人支气管上皮细胞HBE16,给予脂多糖(LPS)刺激,Western blot检测细胞内Elafin蛋白的相对含量,RT-PCR检测各组ElafinmRNA和粘蛋白(MUC)5ACmRNA表达水平,荧光素酶报告基因检测系统测定核转录因子-κB(NF-κB)的活性;ELISA法分析各组细胞MUC5AC蛋白的相对含量。结果:成功构建Elafin真核表达载体,转染重组 Elafin的HBE16细胞成功表达Elafin蛋白。LPS刺激可增强NF-κB的活性,该活性在转染重组Elafin后显著降低;MUC5AC蛋白含量及mRNA水平在LPS刺激后也显著升高,在转染重组Elafin后二者的表达水平明显降低。结论:Elafin真核表达载体成功构建,初步发现Elafin可通过降低NF-κB的活性来下调MUC5AC的表达,为进一步深入研究其对气道粘液高分泌的调节机制奠定了基础。
Elafin;粘蛋白;脂多糖;核转录因子-κB
气道粘液高分泌是慢性气道炎症性疾病的重要病理特征之一,也是目前呼吸系病函待解决的主要问题之一。气道病理性粘液形成的主要原因是粘蛋白的过度表达,气道粘蛋白(Mucin)的主要病理表型是MUC5AC。近几年在气道MUC5AC病理性表达机制方面国内外学者进行了深入的研究,肯定了多种刺激因素引起MUC5AC高表达的重要作用,如吸烟、中性粒细胞弹性蛋白酶及脂多糖(Lipopolysac-charide,LPS)等[1-3]。Elafin作为体内一种天然生态抗菌多肽,不仅是特异性的蛋白酶抑制剂,也是一个强有力的抗炎因子[4]。因此,获取人工重组Elafin对慢性气道炎症性疾病的治疗,特别是气道粘液高分泌的治疗极具研究和应用价值。本研究克隆了全长人Elafin,定向重组至真核表达载体pEGFP-N1获重组质粒pEGFP-N1-Elafin,并给予LPS刺激,初步探讨转染天然内生多肽Elafin对气道粘蛋白基因MUC5AC表达的调节机制,为将重组人Elafin用于临床治疗慢性气道炎症性疾病提供参考。
1 材料与方法
1.1 主要材料 肺腺癌细胞株A549由重庆医科大学生命科学研究院提供,正常人支气管上皮细胞HBE16购自ATCC(美国标准培养收集所);RPMI 1640培养基,胎牛血清购自Hyclone(美国);从绿脓杆菌提取的LPS购自美国Sigma公司;兔抗Elafin多克隆抗体购自Abcam(英国);鼠抗MUC5AC 45M 1单克隆抗体购自Neomarkers(美国);Lipofectamine 2000购自Invitrogen(美国);转录因子NF-κB荧光素酶报告基因质粒pEGFP-N1、pNF-κB-luc和双荧光素酶报告基因检测试剂盒购自碧云天生物技术研究所(北京);pRL-TK Renilla荧光素酶报告基因质粒购自Promega(美国);pMD18-T购自宝生物工程(大连)有限公司;HRP标记的羊抗兔IgG购自北京中山金桥生物技术公司;其余产品均为国产试剂。
1.2 方法
1.2.1 Elafin cDNA的获取及原核载体 pMD18-TElafin的构建 常规培养肺腺癌细胞株A549,提取细胞总RNA并行RT-PCR反应Elafin引物序列为上游CCGGAATTCAGGGCCAGCAGCTTCTTGAT和下游CGGGATCCTCACTGGGGAACGAAACAGG。所得产物行2%琼脂糖凝胶电泳,在368 bp处出现的条带即为所需的Elafin基因片段。然后按DNA胶回收纯化试剂盒(大连宝生物)说明书切胶回收上述Elafin基因条带,并将其与pMD18-T均进行EcoRⅠ和BamH Ⅰ双酶切。再次行DNA胶回收,以去除含EcoR Ⅰ和BamHⅠ位点的非特异性片段,提高连接效率。按T4DNA连接酶试剂盒(大连宝生物)说明书连接12小时,将上述连接产物转化入感受态细胞,转化过程设置阴性及阳性对照组,将转化平板置于37℃,12小时后挑菌,加入5m l的LB液体培养基及5μl的氨苄霉素(100mg/ml)摇菌。12小时后提取质粒,酶切及PCR鉴定质粒构建是否成功,并将重组质粒样品送Invitrogen公司行DNA测序。
1.2.2 真核载体pEGFP-N1-Elafin的构建 因插入表达载体pEGFP-N1的序列如在真核细胞中表达,其序列需有翻译启动码ATG,故我们在设计引物时,在上游引物中加入了ATG。根据Genebank所提供序列(25-378),应用PrimerPremier5.0软件设计引物:上游 CGGAATTCATGACGGCCAGCAGCTTCTTGAT和下游 CGGGATCCCTGGGGAACGAAACAGGCCA(由上海生工合成),以构建成功的 pMD18-T-Elafin为模板,进行PCR扩增反应,获367 bp Elafin片段经琼脂糖电泳回收。将回收的Elafin基因片段和pEGFP-N1进行EcoRⅠ和BamHⅠ双酶切并将酶切产物进行DNA胶回收。然后,按T4DNA连接酶试剂盒(大连宝生物)说明书连接12小时,连接产物转化入感受态细胞,转化过程设置阴性及阳性对照组。将转化平板置于37℃,12小时后挑菌,加入5m l LB液体培养基及100μl的卡那霉素(30mg/m l)摇菌。12小时后提取质粒,双酶切鉴定质粒构建是否成功。
1.2.3 转染 常规消化HBE16细胞,离心后弃上清,用无青链霉素及无胎牛血清的RPMI1640培养基重悬细胞进行培养,待细胞汇合至90%左右进行转染,操作步骤按Lipofectamine 2000说明书进行。转染设空白对照组,空质粒组及重组质粒组。转染后24~48小时在荧光显微镜下观察荧光,以此鉴定转染是否成功及转染效率。
1.2.4 细胞分组 于6孔板中培养HBE16细胞,常规培养换液,待细胞融合至约80%时传代,将细胞分为6组,每组3个复孔:(1)对照组:在无胎牛血清无双抗的1640中继续培养细胞;(2)LPS刺激组:无血清培养液中加入终浓度为10 ng/ml LPS;(3)LPS+pEGFP-N1组:行pEGFP-N1转染,24小时后加入终浓度为 1 ng/ml的 LPS;(4)LPS+pEGFP-N1-Elafin组:行pEGFP-N1-Elafin转染,终浓度为 1 ng/ml的LPS;(5)pEGFP-N1转染组:行pEGFP-N1转染;(6)pEGFP-N1-Elafin转染组:行 pEGFP-N1-Elafin转染。继续培养24小时后分别收集上清和细胞进行相关指标检测,每组实验重复4次。
1.2.5 Western blot检测细胞内Elafin蛋白的相对含量 弃培养液后加入细胞裂解液,冰浴20分钟,4℃12 000 r/min离心15分钟,测定蛋白浓度。取各组细胞蛋白10μg经含15%的SDS-PAGE电泳分离,转移至硝酸纤维素膜上,5%脱脂牛乳封闭1小时,加入兔抗Elafin多克隆抗体(1∶1 000)孵育2小时,再用HRP标记的羊抗兔IgG(1∶10 000)孵育2小时。洗膜后经ECL显色,暗室曝光2分钟。结果以与内参照β-actin产物条带的密度面积积分比值作为Elafin蛋白的相对含量。
1.2.6 荧光素酶报告基因检测系统检测NF-κB的活性 常规培养HBE16细胞,将pNF-κB-luc及 pRLTK转染入细胞,12小时后行 LPS刺激和(或)pEGFP-N1及pEGFP-N1-Elafin转染,操作步骤按双荧光素酶报告基因检测试剂盒说明书进行,以Renilla荧光素酶为内参,用萤火虫荧光素酶测定得到的RLU(Relative lightunit)值除以Renilla荧光素酶测定得到的RLU值,根据得到的比值来比较不同样品间目的报告基因的激活程度。
1.2.7 ELISA法检测细胞分泌的MUC5AC蛋白含量 吸取细胞上清液50μl包被96孔酶标板,4℃过夜,小牛血清室温封闭 1小时,分别加小鼠抗MUC5AC单克隆抗体45M1(1∶100,用含0.05%Tween-20的PBS稀释至50μl)孵育1小时,再加入100μl辣根过氧化物酶-羊抗小鼠IgG(1∶10 000)孵育1小时,经四甲基联苯胺过氧化物酶显色后测各孔吸光度值(450 nm),与标准品比较得出MUC5AC的相对值。
1.2.8 RT-PCR检测ElafinmRNA和MUC5ACmRNA的表达 提取各组细胞总RNA,测A260/280为1.8~2.0,行 RT-PCR反应,各引物序列如下,Elafin:上游CGCTGCTTGAAAGATACTGAC、下 游-GCAGGGACTTAGGACCAGAT;MUC5AC:上游-TCAACGGAGACTGCGAGTACAC、下 游 5′-TCTTGATGGCCTTGGAGCA-3′;GAPDH:上游 3′-TCCCATCACCATCTTCCAG-5′、下游3′-GAGTCCTTCCACGATACCAA-5′。反应体系如下 :模板1μl,引物各 2μl(10 nmol/L),TaKaRa Taq 0.5μl,10×PCRBuffer5μl dNTPM ixture 4μl,灭菌蒸馏水定容至50μl。反应参数如下:94℃5分钟,94℃30秒,60℃(MUC5AC)、61℃(Elafin)、55℃(GAPDH)均 30秒,72℃50秒,35个循环,72℃10分钟。PCR产物经2%琼脂糖凝胶电泳鉴定,电泳结果经光密度面积积分分析,以与管家基因GAPDHmRNA的比值作为目的基因mRNA的相对含量。
1.3 统计学分析 采用SPSS17.0统计软件包分析,根据方差齐性与否分别采用参数检验和非参数检验,即齐性资料用单因素方差分析(ANOVA),结果以±s表示,两两比较采用LSD检验,非齐性资料用秩和检验,结果以P<0.05为差异有统计学意义。
2 结果
2.1 Elafin基因的克隆及鉴定 从A549细胞中提取的总RNA,RT-PCR扩增后经2%的琼脂糖凝胶电泳,在368 bp处出现条带即为Elafin基因片段(图1),此条带行DNA胶回收后用于重组原核质粒的构建。
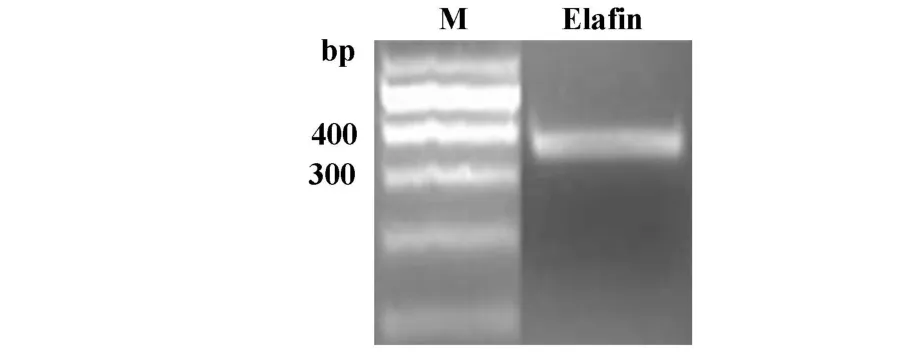
图1 Elafin基因的克隆及琼脂糖电泳鉴定Fig.1 Clone and identification of Elafin
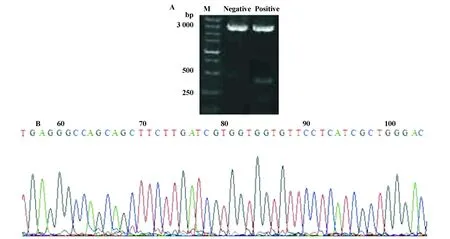
图2 pMD18-T-Elafin的酶切鉴定及DNA测序Fig.2 Restriction enzyme identification of pMD18-T-Elafin and its sequencing
2.2 原核质粒pMD18-T-Elafin的酶切鉴定及DNA测序 重组质粒(相对于未插入任何片段的pMD18-T阴性质粒而言,亦称其为阳性质粒)pMD18-T-Elafin经EcoRⅠ和BamH Ⅰ双酶切鉴定构建成功(图2A),符合预期目标。重组质粒DNA测序结果见图2B(由Invitrogen公司完成),结果与GeneBank报道一致,进一步从基因水平确定重组质粒pMD18-T-Elafin构建成功。
2.3 重组质粒pEGFP-N1-Elafin的酶切鉴定、转染及重组Elafin的表达 重组质粒(相对于未插入任何片段的pEGFP-N1阴性质粒而言,亦称其为阳性质粒)经EcoR Ⅰ和BamH Ⅰ双酶切鉴定确定构建成功(图3A);重组(阳性)质粒转染HBE16细胞 36小时后在荧光倒置显微镜下观察,质粒发出较强绿色荧光(图3D),以此证实转染成功,且荧光越多,表明重组Elafin(recombinant Elafin,rec-Elafin)融合蛋白表达越多;空(阴性)质粒因含有绿色荧光蛋白基因,故亦能发出绿色荧光,阴阳性质粒可由检测细胞是否表达Elafin mRNA和蛋白来区分,见结果2.4。
2.4 转染重组Elafin对Elafin基因及蛋白水平的影响 LPS刺激对细胞内基础Elafin的基因及蛋白表达水平无明显影响,转染重组Elafin后Elafin基因转录水平显著升高(图4A),同时细胞内可检测到大量rec-Elafin的表达(图4B),而转染空质粒pEGFP-N1对Elafin基因及蛋白水平无明显影响。

图3 pEGFP-N1-Ela fin的酶切鉴定、转染及重组Elafin的荧光鉴定Fig.3 Restriction enzyme identification of pEGFP-N1-Elafin and its transfection
2.5 转染重组Elafin对NF-κB的活性的影响 LPS刺激HBE16细胞后,检测到NF-κB(图 5)的相对活性明显高于对照组,差异有统计学意义;转染重组Elafin可下调LPS刺激引起的NF-κB的相对活性;而转染空质粒pEGFP-N1对NF-κB的相对活性无明显影响,差异无统计学意义。

图4 LPS及转染重组Elafin对Elafin基因转录水平及蛋白含量的影响Fig.4 Effects of LPS and rec-Elafin on the expression of Elafin mRNAand protein
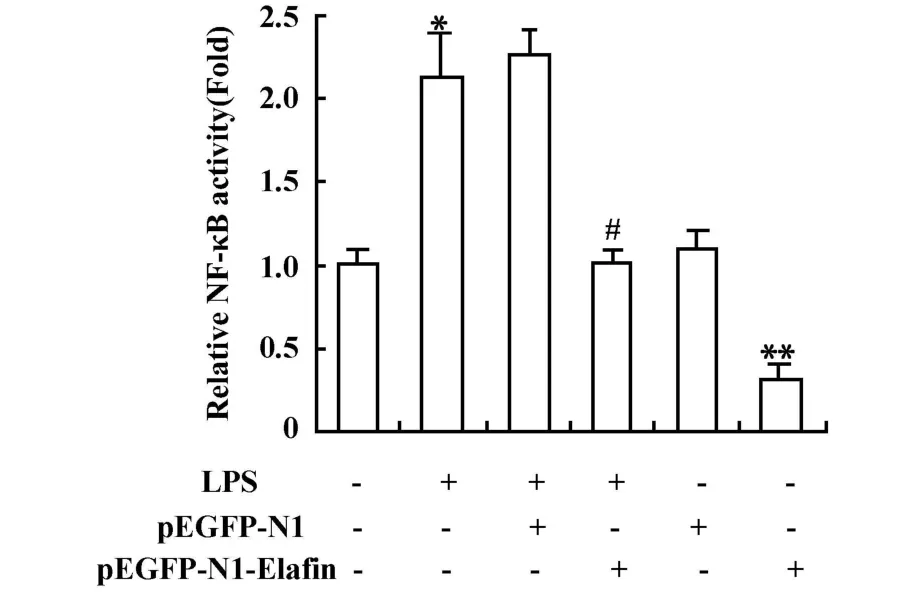
图5 LPS及转染重组Elafin对NF-κB活性的影响Fig.5 Effects of LPS and rec-Elafin on NF-κB activity

图6 各组细胞MUC5ACmRNA的表达及蛋白含量的检测Fig.6 Exp ression of MUC5AC mRNA and protein in each group
2.6 转染重组Elafin对MUC5AC蛋白及mRNA相对含量的影响 单独LPS刺激后细胞内MUC5AC蛋白(图6A)及mRNA(图6B)含量明显高于对照组;在LPS刺激组转染了重组Elafin后,MUC5AC蛋白及mRNA含量明显降低;单纯转染重组Elafin组的MUC5AC蛋白及mRNA含量较对照组明显降低,而MUC5AC蛋白及mRNA相对含量在转染空质粒pEGFP-N1后无明显变化。
3 讨论
Elafin是近些年发现的一种小分子(9.9 kD)抗弹力酶特异性保护因子,属于“trappin”家族,此类蛋白的N末端由可变数目重复序列的6肽(Gly-Gln-Asp-Pro-Val-Lys)组成作为谷氨酰转移酶底物的锚状结构[5]。呼吸道 Elafin主要是由肺泡上皮细胞、Clara细胞以及肺泡巨噬细胞产生,它具有保护细胞外基质及上皮细胞免受中性粒细胞弹性蛋白酶破坏溶解的作用,并显示出良好的抗菌作用及阳离子蛋白酶抑制作用[6]。Elafin这种多重有益效应及其分子量小穿透性好的特点使其成为治疗慢性气道炎症性疾病的极具潜质和希望的候选靶物质,并且作为一种天然生态抗菌素,它可避免长期使用人工合成抗菌素易引起气道菌群的失调。因此,获取人工重组Elafin对慢性气道炎症性疾病的治疗极具研究价值。本研究成功构建了天然内生多肽Elafin真核表达载体pEGFP-N1-Elafin,转染正常人支气管上皮细胞HBE16后细胞表达大量的Elafin蛋白,为在体外高效表达Elafin提供了可能,从而为更深入研究其抗炎、抗菌机制及效能奠定了基础。
粘液高分泌是气道慢性炎症性疾病重要的病理变化之一,过多的粘液储留于气道导致反复的细菌感染,加大了发病率和死亡率。LPS可通过增强NF-κB的活性来上调MUC5AC基因的表达[7,8],而Elafin可通过抑制单核细胞中LPS上调的NF-κB的活性从而下调靶基因的表达水平[9]。因此,本研究以NF-κB为切入点,探讨Elafin对LPS引起的MUC5AC高表达的影响。NF-κB是一个转录因子家族,激活的NF-κB可转入核内形成二聚体结合于靶基因启动子上的特异性序列启动基因转录[10]。在本研究中,LPS可上调NF-κB的转录活性,MUC5AC的表达亦明显增强。转染重组Elafin后,LPS所诱导的NF-κB的活性明显受到抑制,伴有MUC5AC蛋白和转录水平的显著降低,而空质粒pEGFP-N1对上述指标无明显影响。上述结果表明,Elafin可抑制炎性因子上调的NF-κB活性,使其不能与MUC5AC启动子上NF-κB位点的顺式作用元件结合,从而不能启动MUC5AC基因的转录,达到降低MUC5AC病理性表达的目的。
Elafin突出优势在于其既可有效阻碍炎性损伤因子的作用,又可起确实的抗菌作用,故Elafin又是气道抵御局部感染扩散的重要因素[11]。因Elafin具有抗菌多肽及弹性蛋白酶抑制剂的双重身份,近几年我们在其对气道慢性炎症性疾病的治疗方面进行了初步的研究[5,6]。但目前国内外在Elafin对气道粘液高分泌的影响方面的研究甚少,本研究构建了Elafin真核表达载体,并初步探讨了内生多肽Elafin对气道粘液高分泌的调节机制。研究发现Elafin可籍以降低NF-κB的活性来下调脂多糖诱导的粘蛋白基因的高表达,为其在慢性气道炎症性疾病治疗的后续研究、应用奠定了基础。同时也初步肯定了Elafin在治疗气道粘液高分泌方面的积极效应,为临床治疗慢性气道炎症性疾病提供了新的思考。
1 Shao M X,Nakanaga T,Nadel J Aetal.Cigarette smoke induces MUC5ACmucin overproduction via tumor necrosis factor-alpha-converting enzyme in human airway epithelial(NCI-H 292)cells[J].Am J Physiol Lung CellMol Physiol,2004;287(2):L420-L427.
2 Qi L,Xiangdong Z,Hongmei Yetal.Regulationofneutrophilelastase-inducedMUC5AC expression by nuclear factor erythroid-2 related factor 2 in human airway epithelial cells[J].J Investig Med,2010;58(5):730-736.
3 Binker M G,Binker-Cosen A A,Richards Detal.LPS-stimulated MUC5AC production involves Rac1-dependentMMP-9 secretion and activation in NCI-H 292 cells[J].Biochem Biophys Res Commun,2009;386(1):124-129.
4 Roghanian A,Sallenave J M.Neutrophil elastase(NE)and NE inhibitors:Canonical and noncanonical functions in lung chronic inflammatory diseases(cystic fibrosis and chronic obstructive pulmonary disease)[J].JAerosolM ed Pulm Drug Deliv,2008;21(1):125-144.
5 杜先智,周向东.弹性蛋白酶特异性抑制因子 Elafin基因重组腺病毒载体的构建、鉴定与表达[J].中国免疫学杂志,2007;23(6):495-499.
6 Li Q,Zhou X,Nie Xetal.The role of recombinant human elafin in the resistance of A549 cells against Pseudomonas aeruginosa biofilm[J].Respiration,2010;79(1):68-75.
7 Ou XM,Feng Y L,Wen FQetal.Macrolides attenuatemucus hypersecretion in rat airways through inactivation ofNF-kappaB[J].Respirology,2008;13(1):63-72.
8 Ishinaga H,TakeuchiK,K ishioka Cetal.Pranlukast inhibits NF-kappaB activation and MUC2 gene expression in cultured human epithelial cells[J].Pharmacology,2005;73(2):89-96.
9 ButlerM W,Robertson I,Greene C Metal.Elafin prevents lipopolysaccharide-induced AP-1 and NF-kappaB activation via an effect on the ubiquitin-proteasome pathway[J].JBiol Chem,2006;281(46):34730-34735.
10 Solt LA,May M J.The IkappaB kinase complex:master regulator of NF-kappaB signaling[J].ImmunolRes,2008;42(1-3):3-18.
11 Vandermeeren M,Daneels G,Bergers M.Development and application of monoclonal antibodiesagainstSKALP/elafin and other trappin fam ilymembers[J].Archivesof Dermatological Research,2001;293(7):343-349.
[收稿2010-08-12 修回2010-11-01]
(编辑 倪 鹏)
Construction of Eukaryotic expression vector pEGFP-N1-Elafin and its effects on mucus hypersecretion in human airway epithelial cells
YUHong-Mei,LIQi,JuliyM·Perelman,VictorP·Kolosov,ZHOUXiang-Dong.DepartmentofRespiratoryMedicine,theSecondAffiliatedHospital,ChongqingMedicalUniversity,Chongqing400010,China
Objective:To constructeukaryotic expression vectorpEGFP-N1-Elafin and explore themechanism s of endogeny polypeptide elafin in regulatingmucus hypersecretion in airway epithelial cells.Methods:Elafin genewas successfully cloned by RT-PCR reaction.Eukaryotic exp ression vector pEGFP-N1-Elafin was constructed,identificated by restriction enzyme reaction(EcoRⅠ and BamHⅠ)and DNA sequencing,and transfected into HBE16 cells.Cellswere then stimulated by lipopolysaccharide(LPS).After24 h,the levels of Elafin protein and mRNA were detected byWestern blotand RT-PCR respectively,the transcription activity of nuclear factorκB(NF-κB)were detected by luciferase reporter gene detection system,and the levels ofMUC5AC protein andmRNA were detected by ELISA and RT-PCR.Results:The levels of Elafin protein andmRNAwere obviously increased after transfection of recombinant Elafin into HBE16 cells,comparedwith LPSgroup or control group.Therewas anobvious increaseofMUC5AC protein production andmRNA expression,with elevationof NF-κB activity,all significantly higher than controlgroup.Transfected recombinantelafin reducedMUC5AC protein andmRNA level,inhibited NF-κB activity,compared with single LPS-stimulated group.Conclusion:Transfectionofendogeny polypeptide Elafinmay down-regulateMUC5AC overexpression by inhibition of NF-κB.
Elafin;Mucin;Lipopolysaccharide;Nuclear factorκB
R363
A
1000-484X(2011)05-0440-06
10.3969/j.issn.1000-484X.2011.05.014
①本文为国家自然科学基金资助项目(30770951)、国家自然科学基金中俄国际合作项目(81011120108)和中俄政府间合作项目(2009:13-01)
②俄罗斯医学科学院远东呼吸生理与病理研究中心,布拉戈维申斯克675000
余红梅(1982年-),女,在读博士,主要从事气道粘液高分泌的发生机制及防治的研究,E-mail:yhm-023@sohu.com;
及指导教师:周向东(1963年-),男,博士,教授,博士生导师,主要从事气道粘液高分泌的发生机制及防治的研究,E-mail:zxd999@263.net。