低剂量LPS对PC12细胞抗氧化能力的影响
2011-02-06朱凤臣蒋电明祁小桐李维朝重庆医科大学附属第一医院骨科重庆400016
朱凤臣 蒋电明 祁小桐 李维朝 (重庆医科大学附属第一医院骨科,重庆 400016)
低剂量LPS对PC12细胞抗氧化能力的影响
朱凤臣 蒋电明 祁小桐 李维朝 (重庆医科大学附属第一医院骨科,重庆 400016)
目的:探讨低剂量脂多糖(Lipopolysaccharide,LPS)对PC12细胞抗氧化能力的影响。方法:分别以浓度为0、0.01、0.025、0.05、0.1、0.25、0.5、1μg/μl的LPS刺激PC12细胞24小时,MTT法检测细胞活性确立对细胞没有毒性作用的安全剂量;采用安全剂量刺激PC12细胞24小时,收集培养基上清和细胞,采用试剂盒检测上清中的总抗氧化能力(T-AOC),细胞中超氧化物歧化酶(SOD)的表达,Western blot检测细胞内Bcl-2蛋白的表达;流式细胞仪检测细胞内活性氧(ROS)、钙离子(Ca2+)的平均荧光强度。结果:LPS浓度小于0.1μg/μl对细胞没有明显毒性作用(P>0.05);采用 0、0.01、0.025、0.05、0.1μg/μl LPS分别刺激PC12细胞24小时,培养上清中T-AOC呈下降趋势,以0.05、0.1μg/μl组明显(P<0.01),细胞内SOD呈上升趋势(0.05μg/μl组,P<0.05;0.1μg/μl组,P<0.01),细胞内Bcl-2表达逐渐升高(0.025~ 0.1μg/μl组,P<0.01),细胞内 ROS 呈下降趋势(0.1μg/μl组,P<0.01),钙离子未见明显变化(P>0.05)。结论:低剂量LPS处理PC12 24小时具有剂量依赖性增强细胞抗氧化能力,并可能藉此参与应激耐受。
LPS;PC12细胞;抗氧化能力;应激耐受
低剂量LPS可以显著减轻中枢神经系统的损伤程度,改善预后[1,2],这提示低剂量的LPS可能激活抗氧化机制,保护细胞免于氧化应激的损伤,本实验以低剂量LPS刺激PC12细胞,观察培养基上清中TAOC,细胞内SOD、Bcl-2及ROS、Ca2+的表达,初步探讨神经系统疾病炎症过程中应激耐受的机制。
1 材料与方法
1.1 主要试剂及来源 LPS(E.coli055:B5),二甲基噻唑二苯基四唑溴盐(MTT)、2′-7′-二氯荧光乙酰乙酸盐(DCFH-DA)、钙离子负载剂Fluo-3/AM(Sigma公司),Bcl-2抗体(Santa Cruz公司),β-actin 抗体(北京博奥森生物技术有限公司),总抗氧化能力测定试剂盒、超氧化物歧化酶测试盒(南京建成生物工程研究所),BCA蛋白浓度测定试剂盒(碧云天生物技术研究所),RPM I1640培养液、新生牛血清、马血清(Hyclone公司)。
1.2 实验方法
1.2.1 细胞培养 PC12细胞株由重庆医科大学附属第一医院中心实验室惠赠。将复苏后的PC12细胞株接种于含有10%新生牛血清、5%马血清、青霉素和链霉素各100 U/ml的RPMI1640培养液中,放置于37℃、5%CO2条件下孵箱培养。细胞铺满瓶底70%~80%时,用消化液(含0.25%的胰蛋白酶)消化1分钟左右,按1∶3传代,隔天换液,培养 3代后用于以下实验。
1.2.2 细胞活力测定(MTT法) 将消化重悬的PC12细胞调整至浓度为2.0×105ml-1,按每孔200 μl接种于96孔板中,37℃、5%CO2条件下培养16~18小时至细胞贴壁,弃上清,加入用完全培养基配制的 LPS,使各组的浓度分别为0、0.01、0.025、0.05、0.1 、0.25、0.5、1 μg/μl,每组6 孔,继续培养24 小时 ,每孔加入5mg/ml的MTT溶液20μl,37℃孵育4小时,弃上清,加入 150μl DMSO振荡均匀,酶标仪上检测波长490 nm处吸光度值(OD值),分析各组间OD值的变化。
1.2.3 培养基上清中T-AOC和细胞内SOD的检测PC12细胞按每瓶2.0×105ml-1传代,细胞铺满瓶底70%~80%时,更换为含上述不同浓度LPS的完全培养基,继续培养24小时,收集培养基上清和细胞,立即冻存于-80℃冰箱。按试剂盒说明书操作,检测上清中的T-AOC和细胞内的SOD。
1.2.4 细胞内Bcl-2的检测 将上述不同浓度LPS刺激24小时的PC12细胞提取蛋白,BCA蛋白浓度测定试剂盒测定蛋白浓度,各取20μg总蛋白,经10%SDS-PAGE电泳,Bio-Rad Western印迹分析仪将蛋白转移至PVDF膜上。5%脱脂奶粉室温下封闭2小时,一抗(Bcl-2抗体或β-actin抗体)4℃过夜,二抗孵育2小时,加入ECL发光试剂,Gel Doc XR凝胶成像系统对PVDF膜条带行灰度值测定,分析各剂量组的相对灰度值(Bcl-2/β-actin)。
1.2.5 细胞内ROS和钙离子的检测 采用不含EDTA的消化液收集上述不同浓度LPS刺激的PC12细胞,并用无血清培养基重悬,分别加入DCFH-DA、Fluo-3/AM处理细胞,使其终浓度均为10μmol/L,37℃避光孵育30分钟,用PBS清洗2遍,流式细胞仪检测细胞内平均荧光强度(每个样品收集1×104个细胞,用CellQuest软件分析结果)。
2 结果
2.1 不同浓度的LPS对PC12细胞活力的影响 为研究PC12的抗氧化机制,首先要排除药物对细胞毒性作用的干扰,本实验分别用不同浓度的LPS处理PC12细胞24小时,MTT法检测LPS对细胞活性的影响。结果发现当LPS浓度小于0.1μg/μl时对细胞没有明显毒性作用(P>0.05),而随浓度的增大(>0.1μg/μl),细胞的活性明显下降(P<0.01,见图1)。
2.2 不同浓度LPS对PC12细胞培养基上清T-AOC及细胞内SOD的影响 结果显示,不同浓度LPS处理PC12 24小时,培养基上清的T-AOC呈下降趋势,其中 0.05、0.1μg/μl组与其他各组比较差异显著(P<0.01)。细胞内SOD水平呈上升趋势,其中0.05 μg/μl与空白组、0.01μg/μl比较差异具有统计学意义(P<0.05),0.1μg/μl组与其他各组比较差异显著(P<0.01,见表1)。
2.3 不同浓度LPS对PC12细胞Bcl-2的影响 实验结果表明,采用不同浓度的LPS处理PC12细胞,细胞内Bcl-2呈上升趋势,0.025、0.05μg/μl组Bcl-2表达明显高于空白组、0.01μg/μl组(P<0.01),0.1 μg/μl组比其他各组均要高(P<0.01,见图2)。
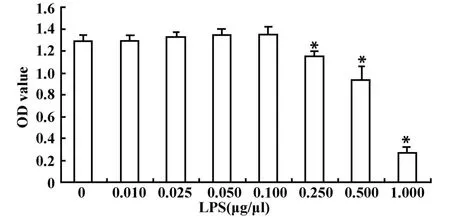
图1 不同浓度LPS对PC12细胞活力的影响(±s,n=6)Fig.1 The effects on the viability of PC12 cellswith different concentrations of LPS(±s,n=6)
表1 不同浓度 LPS对PC12培养基上清 T-AOC、细胞内SOD影响(n=4,±s)Tab.1 The effects on T-AOC in culture supernatant and SOD in PC12 cellswith different concentrations of LPS(n=4,±s)

表1 不同浓度 LPS对PC12培养基上清 T-AOC、细胞内SOD影响(n=4,±s)Tab.1 The effects on T-AOC in culture supernatant and SOD in PC12 cellswith different concentrations of LPS(n=4,±s)
Note:Compared with othergroups,1)P<0.01;Comparedwith controlgroups and 0.01μg/μl group,2)P <0.05.
LPS(μg/μl) T-AOC(U/m l) SOD(U/m l)8.281±0.223 3.402±0.252 0.010 8.232±0.355 3.440±0.153 0.025 8.081±0.125 3.600±0.115 0.050 7.190±0.1041) 3.838±0.0632)0.100 6.230±0.2101) 4.453±0.3431)0
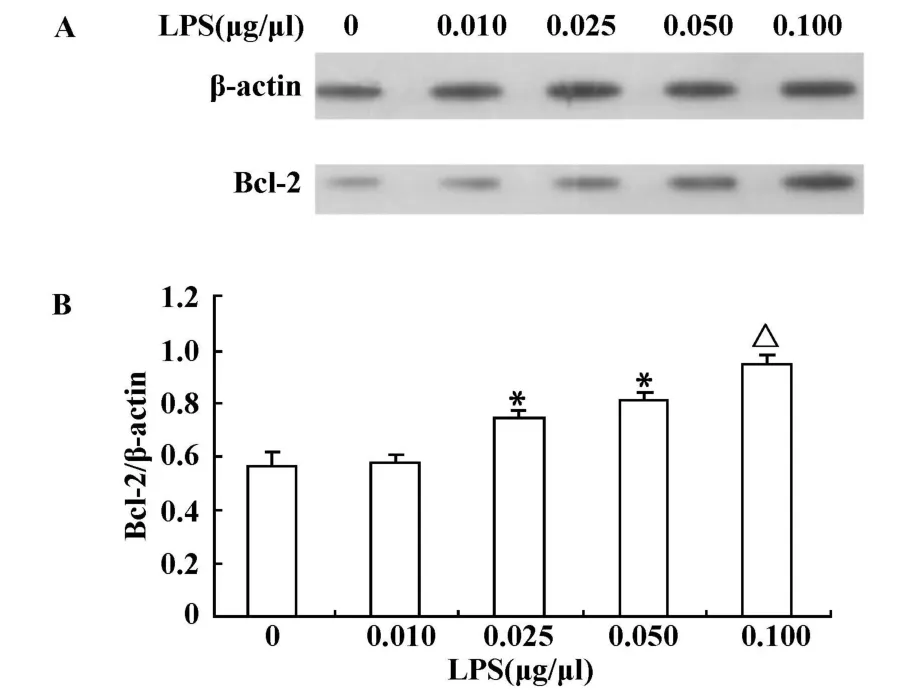
图2 不同浓度LPS对PC12细胞Bcl-2的影响(±s,n=3)Fig.2 The effects on Bcl-2 of PC12 cells with different concentrations of LPS(±s,n=3)
表2 不同浓度LPS对PC12细胞内ROS和 Ca2+的影响(±s,n=4)Tab.2 The effects on ROS and Ca2+in PC12 cells with different concentrations of LPS(±s,n=4)

表2 不同浓度LPS对PC12细胞内ROS和 Ca2+的影响(±s,n=4)Tab.2 The effects on ROS and Ca2+in PC12 cells with different concentrations of LPS(±s,n=4)
Note:Compared with other groups,1)P<0.01.
LPS(μg/μl) ROS fluorescence intensity Ca2+fluorescence intensity 48.53±4.27 16.40±0.93 0.010 48.71±3.69 16.49±0.59 0.025 46.29±4.41 16.26±0.61 0.050 45.99±4.77 16.49±0.76 0.100 34.91±3.101) 16.64±1.09 0
2.4 不同浓度LPS对PC12细胞内ROS和Ca2+的影响 采用不同剂量低浓度LPS干预PC12细胞24小时发现,细胞内ROS平均荧光强度未见明显上升趋势,0.1μg/μl组反而有下降趋势(P<0.01)。细胞内Ca2+平均荧光强度未发生明显变化(P>0.05,见表2)。
3 讨论
LPS是革兰氏阴性菌的胞壁的主要成分,是常用的致炎因子。随着上世纪50年代“内毒素耐受”现象的发现,人们认识到LPS可以激活细胞内源性的保护机制,抵抗后继打击[3]。低剂量LPS可以减轻脑缺血再灌注损伤,减少炎症反应,改善预后,甚至可以减轻脑损伤、脊髓损伤的程度[1,4-8]。研究发现,LPS可以激活神经细胞内的N rf2、HO-1、SOD、NQO1等抗氧化基因抵抗氧化应激[9-11]。本实验采用低剂量LPS刺激PC12细胞,观察其对PC12细胞抗氧化机制的影响,初步探讨抗氧化机制在神经细胞炎症过程中应激耐受的作用。
PC12细胞是一种常用于体外实验的神经细胞株,Hillion等[12]认为PC12可以作为神经元细胞耐受的细胞模型进行大通量的实验研究。本实验采用低剂量的LPS刺激PC12细胞,发现PC12细胞有较强的内毒素耐受性,大于0.1μg/μl的LPS才对其产生明显毒性作用,与Omata等[11]研究结果(0.5μg/μl)存在出入,其原因主要考虑是培养条件的不同引起。本实验发现,低剂量LPS刺激PC12 24小时培养基上清中的T-AOC随LPS的剂量的升高而降低,而细胞内的SOD却呈上升趋势,说明PC12消耗了培养基中的抗氧化物质,同时合成抗氧化酶类或蛋白,保护细胞免于氧化应激的损伤。另外,检测的24小时细胞内ROS发现,细胞内ROS随LPS剂量的增加保持平稳甚至降低的趋势,说明低剂量LPS激活的抗氧化应激机制的确在发挥作用。
线粒体是ROS产生的主要场所,也是细胞内部最受ROS损伤的细胞器,对细胞凋亡具有重要的意义。Bcl-2定位于线粒体外膜上,维持线粒体膜的完整性,并且发挥抗氧化及抑制Ca2+释放等作用,发挥保护细胞的作用[13]。本实验发现,低剂量LPS作用24小时,细胞内Bcl-2随剂量呈上升趋势,提示低剂量LPS促进Bcl-2的合成发挥保护作用。Ca2+是细胞凋亡的始动因素,也是细胞凋亡的标志,本实验发现,低剂量LPS刺激下PC12细胞内的Ca2+浓度没有发生明显变化,提示低剂量的LPS刺激下PC12细胞能够利用抗氧化、抗凋亡机制保护细胞免于损伤[14]。
炎症过程中的氧化应激及抗氧化机制逐渐被人们认识,抗氧化机制对炎症的预后具有重要的意义[15]。本实验结果显示,低剂量LPS可以激活神经细胞内的抗氧化应激机制,发挥氧化应激耐受,保护细胞免于损伤。研究炎症反应中的抗氧化应激机制将助于揭示神经系统疾病炎症反应的病理机制,寻找干预损伤-修复的途径。
1 Marsh B,Stevens S L,Packard A Eetal.Systemic lipopolysaccharide protects the brain from ischem ic injury by reprogramm ing the response of the brain to stroke:a critical role for IRF3[J].JNeurosci,2009;29(31):9839-9849.
2 Rosenzweig H L,Lessov N S,Henshall DCetal.Endotoxin preconditioning prevents cellular inflammatory response during ischemic neuroprotection inmice[J].Stroke,2004;35(11):2576-2581.
3 李维朝,蒋电明,朱凤臣etal.内毒素耐受的分子机制研究进展[J].中国免疫学杂志,2010;26(8):764-768.
4 TasakiK,Ruetzler CA,OhtsukiTetal.Lipopolysaccharide pre-treatment induces resistance against subsequent focal cerebral ischemic damage in spontaneously hypertensive rats[J].Brain Res,1997;748(1-2):267-270.
5 Rosenzweig H L,Lessov NS,HenshallDCetal.Endotoxin preconditioning prevents cellular inflammatory response during ischemic neuroprotection inmice[J].Stroke,2004;35(11):2576-2581.
6 RosenzweigH L,M inamiM,Lessov N Setal.Endotoxin preconditioning protectsagainst the cytotoxic effectsof TNFalphaafter stroke:a novel role for TNFalpha in LPS-ischem ic tolerance[J].JCereb Blood Flow Metab,2007;27(10):1663-1674.
7 Lin H Y,Huang C C,Chang K F.Lipopolysaccharide preconditioning reducesneuroinflammation against hypoxic ischemia and provides long-term outcome of neuroprotection in neonatal rat[J].Pediatr Res,2009;66(3):254-259.
8 Davis A E,Campbell S J,Wilainam Petal.Post-conditioning with lipopolysaccharide reduces the inflammatory infiltrate to the injured brain and spinalcord:apotential neuroprotective treatment[J].Eur JNeurosci,2005;22(10):2441-2450.
9 InnamoratoN G,Rojo A I,García-Yagüe A Jetal.The transcription factor Nrf2 isa therapeutic targetagainst brain inflammation[J].J Immunol,2008;181(1):680-689.
10 Bordet R,Deplanque D,Maboudou Petal.Increase in endogenousbrain superoxide dismutase as a potentialmechanism of lipopolysaccharide-induced brain ischemic tolerance[J].JCereb Blood Flow Metab,2000;20(8):1190-1196.
11 Omata Y,Saito Y,Fujita Ketal.Induction of adaptive response and enhancement of PC12 cell toleranceby lipopolysaccharideprimarily through the upregulation of glutathione S-transferase A3 via Nrf2 activation[J].Free Radic Biol Med,2008;45(10):1437-1445.
12 Hillion JA,TakahashiK,Maric Detal.Development ofan ischemic tolerancemodel in a PC12 cell line[J].JCereb Blood Flow Metab,2005;25(2):154-162.
13 王 彤,刘存志,刘玉珍etal.bcl-2/bax基因调控机体细胞凋亡的机制研究进展[J].中国老年学杂志,2008;28(8):1658-1659.
14 Mathai JP,GermainM,Shore GC.BH 3-only BIK regulates BAX,BAK-dependent release ofCa2+from endoplasm ic reticulum stores andm itochondrial apoptosis during stress-induced cell death[J].J Biol Chem,2005;280(25):23829-23836.
15 Kolls JK.Oxidative stress in sepsis:a redox redux[J].JClin Invest,2006;116(4):860-863.
[收稿2010-12-08 修回2011-01-10]
(编辑 张晓舟)
The effects of low-dose LPS on the anti-oxidant capacity of PC12 cells
ZHUFeng-Chen,JIANGDian-Ming,QIXiao-Tong,LIWei-Chao.DepartmentofOrthopaedics,theFirstAffiliatedHospital,ChongqingMedicalUniversity,Chongqing400016,China
Objective:To investigate the effects of low-dose LPS on anti-oxidant capacity in PC12 cells.Methods:Stimulating PC12 cellsw ith various concentrations of LPS(0,0.01,0.025,0.05,0.1,0.25,0.5,1μg/μl)for 24 h,MTTassaywas conducted to establish safe doses for cell viability.Non-lethal doses of LPSwereused to dealwith PC12 cells for24h,the culture supernatantand cellswere collected.The total anti-oxidant capacity in culture supernatantand superoxide dismutase in cellswere detected with assay kits.The intracellular Bcl-2 protein expressionswere detected with Western-b lot,and the average fluorescence intensity of ROS and calcium were tested with flow cytometry.Results:Less than 0.1μg/μl LPS concentration had no toxicity for cell activity(P>0.05).Stimulating PC12 cellswith different concentrationsof LPS(0,0.01,0.025,0.05,0.1μg/μl),the T-AOC decreased significantly,especially in 0.05μg/μl and 0.1μg/μl groups(P<0.01)and the intracellular SOD increased(0.05μg/μlgroup,P<0.05;0.1μg/μl group,P<0.01).The Bcl-2 exp ressions in PC12 cells increased gradually(0.025-0.1μg/μl group,P<0.01).The intracellular ROS decreased(0.1μg/μl group,P<0.01),but there was no significant changes in calcium(P>0.05).Conclusion:Low-dose LPS increases PC12 cells'anti-oxidant capacity at 24 h in a dose-dependentmanner,and that probably participates in stress tolerance.
LPS;PC12 cells;Antioxidant capacity;Stress tolerance
R392
A
1000-484X(2011)05-0430-04
10.3969/j.issn.1000-484X.2011.05.011
朱凤臣(1979年-),男,在读博士,主要从事脊髓损伤、骨科炎症方面的研究,E-mail:zfc1008@hotmail.com;
及指导教师:蒋电明(1957年-),男,教授,博士生导师,主要从事骨科生物材料、脊髓损伤及周围神经移植等方面的研究,E-mail:jdm571026@vip.163.com。