穴位埋线对非酒精性脂肪性肝病大鼠SREBP-1表达的影响*
2011-02-06周晓玲侯秋科
周晓玲 谢 胜 侯秋科
广西壮族自治区柳州市中医院(广西柳州545001)
非酒精性脂肪肝(NAFLD)是一种肝组织学改变,与酒精性肝病(ALD)相类似,但无过量饮酒史的临床病理综合征。近年来,发现通过中医外治穴位埋线的方法对治疗NAFLD效果明显。本实验通过观察穴位埋线对高脂饮食诱导的大鼠NAFLD及其胆固醇调控元件结合蛋白-1(SREBP-1)的影响,以探讨穴位埋线对高脂饮食诱导的大鼠NAFLD作用及其可能机制,为临床应用提供参考。
1 材料与方法
1.1 实验动物 雄性wistar大鼠40只,清洁级,体质量170~200g,由广西中医学院实验动物中心提供。实验室室温 (20±3)℃,分笼喂养。
1.2 试药及仪器 肝组织总胆固醇(TC)和甘油三酯(TG)试剂盒为北京福瑞生物工程公司产品。一抗兔抗大鼠SREBP-1多克隆抗体(美国Santa Cruz公司)。二抗羊抗兔IgG-HRP由武汉博士德公司提供。胆固醇及0.3%胆酸钠购自国药集团化学试剂有限公司。猪油为市售。普通饲料和高脂饲料(含87.7%普通饲料+2%胆固醇+0.3%胆酸钠+10%猪油)均购自广西中医学院实验动物中心(桂检证字2003A010号)。超敏发光液由北京普利莱公司提供。
1.3 分组及造模 大鼠适应性喂养1周后,随机分为4组:正常对照组、模型组、穴位埋线4周组、穴位埋线8周组,每组8只。模型组、穴位埋线4周组、穴位埋线8周组给予高脂饲料饮食,正常对照组给予普通饲料饮食,自由饮水。
1.4 穴位埋线治疗方法 根据化痰利湿、活血化瘀的治则,穴位埋线治疗组取丰隆、足三里、太冲、三阴交穴[1]。将大鼠置于自制固定器中,取双侧上述穴位,线穿进3号注射针头内,将针头刺入穴位,直刺约5mm,提插得气后,用针芯抵住羊肠线(针芯由直径0.1mm、长5mm毫针剪成平头改成),缓缓退出针管,将羊肠线留在穴内。每3日1次,穴位埋线4周组治疗4周,穴位埋线8周组治疗8周。模型组大鼠亦置入固定器中15min,但不进行治疗。
1.5 标本采集 每组大鼠在治疗结束后隔夜禁食12h,称体质量,以10%水合氯醛1mg/kg腹腔内注射麻醉,开腹后肉眼观察肝脏情况,腹主动脉取血,0.5h内离心取血清待检。取肝左叶同一部位1cm×1cm×1cm组织置于细胞裂解液中,匀浆并收集蛋白,-20℃保存。
1.6 检测方法 一般情况:观察大鼠食欲行为、状态、体质量、毛发及死亡情况,实验结束测体质量及肝湿质量。血清指标测定:测定丙氨酸氨基转移酶(ALT)、门冬氨酸氨基转移酶(AST)、TG、TC,全部采用全自动生化仪检测。Western Blot检测肝组织蛋白SREBP-1的表达:肝左叶同一部位每100mg组织加入400μL MPER蛋白提取试剂,在冰上充分匀浆后,收集匀浆液,10000r/min离心5min,转移上清。分装后,取50μL,加入6×蛋白质样品缓冲液10μL混匀,在100℃水浴中煮沸5min,各组取10μL在10%SDS聚丙烯酰胺凝胶上电泳后,电转至PVDF膜,TTBS洗5min,3次,5%脱脂牛奶封闭30min,分别加兔抗ALP和VDR多克隆抗体(1∶1000)。4℃过夜,TTBS洗 5min,4次,分别与 HRP 标记的二抗羊抗兔IgG (1∶10000)室温下振荡孵育 1h,TTBS洗10min,4次,加超敏发光液反应5min,在暗室中曝光,后在显影液和定影液中冲洗胶片,显像后观察结果。
1.7 统计学处理 应用SPSS 13.0统计软件。计量资料以(x±s)表示,计数资料比较采用检验,组间比较采用单因素方差分析及LSD检验。P<0.05为差异有统计学意义。
2 结 果
2.1 各组一般情况比较 见表1。实验过程中,穴位埋线4周组大鼠于第6周因肺部感染死亡1只。穴位埋线4周组其余大鼠和其余组大鼠生长发育良好,无死亡。与正常对照相比较,模型组大鼠肝脏湿质量和肝指数(每100g体质量的肝脏湿质量)均显著高于正常对照组(P<0.05)。与模型组相比,穴位埋线 4周组、穴位埋线8周组大鼠体质量、肝脏湿质量均较模型组有所下降,其中穴位埋线8周组肝指数与模型组差异有统计学意义(P<0.05)。
2.2 各组血清学指标比较 见表2。模型组大鼠血清ALT、AST较正常对照组大鼠显著升高(P<0.01);与模型组相比,穴位埋线4周组、穴位埋线8周组大鼠ALT、AST均有下降趋势,与模型组比较,差异有统计学意义 (P<0.05)。与正常对照组相比,模型组大鼠血清TC显著升高(均为P<0.01),与模型组相比,穴位埋线4周组、穴位埋线8周组血清TG、TC均有下降,其中TC显著下降(P<0.01)。
表1 各组大鼠体质量、肝湿质量和肝指数比较 (±s)
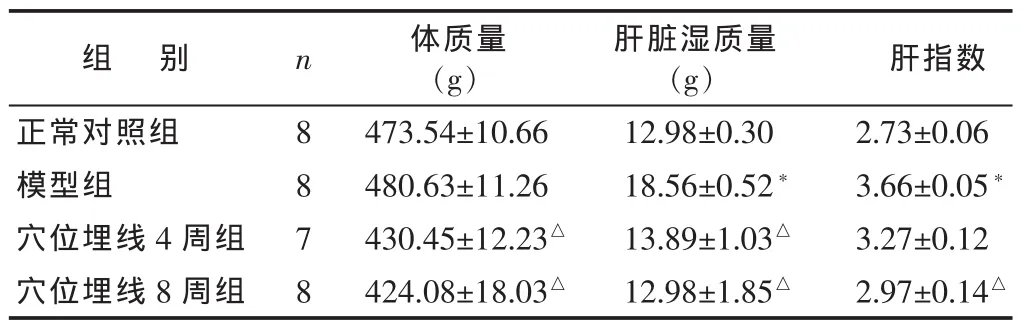
表1 各组大鼠体质量、肝湿质量和肝指数比较 (±s)
与正常对照组比较,*P<0.05,**P<0.01;与模型组比较,△P <0.05,△△P <0.01。 下同。
组 别正常对照组模型组穴位埋线4周组穴位埋线8周组n 8878体质量(g)473.54±10.66 480.63±11.26 430.45±12.23△424.08±18.03△肝脏湿质量(g) 肝指数12.98±0.30 2.73±0.06 18.56±0.52* 3.66±0.05*13.89±1.03△ 3.27±0.12 12.98±1.85△ 2.97±0.14△
表2 各组血清学指标比较 (±s)
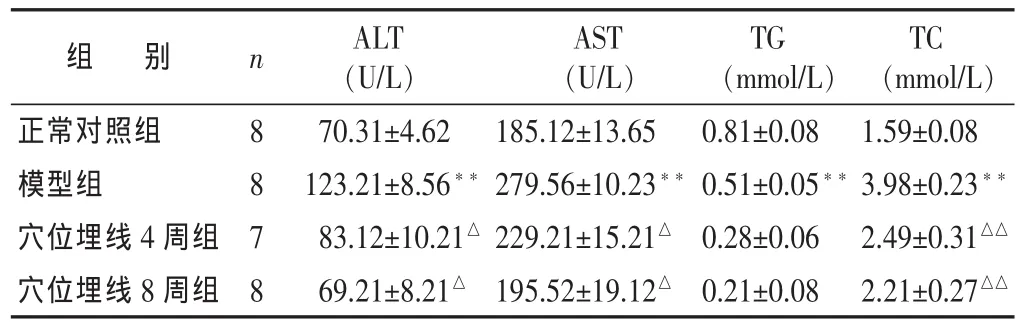
表2 各组血清学指标比较 (±s)
组 别正常对照组模型组穴位埋线4周组穴位埋线8周组n 8878 ALT(U/L)70.31±4.62 123.21±8.56**83.12±10.21△69.21±8.21△AST(U/L)185.12±13.65 279.56±10.23**229.21±15.21△195.52±19.12△TG(mmol/L)0.81±0.08 0.51±0.05**0.28±0.06 0.21±0.08 TC(mmol/L)1.59±0.08 3.98±0.23**2.49±0.31△△2.21±0.27△△
2.3 肝脏SREBP-1的表达 模型组SREBP-1表达水平明显高于正常对照组,穴位埋线4周组、穴位埋线8周组SREBP-1蛋白的表达水平均低于模型组,且穴位埋线8周组的蛋白表达低于穴位埋线4周组。见图1。

图1 肝脏SREBP-1蛋白电泳图
3 讨 论
SREBPs是一类能与胆固醇调节组件1(SRE-1)发生特异性结合的蛋白[2]。SREBP-1a主要调控胆固醇和脂肪酸合酶(如乙酰辅酶A羧化酶)以及TG代谢的低密度脂蛋白受体的基因转录,SREBP-1c则选择性调控脂肪酸、TG以及糖代谢(如葡萄糖激酶)中基因的表达水平[3]。胰岛素和类胰岛素生长因子Ⅰ也可以通过SREBP-1介导LDL-R启动子的激活,从而调节细胞内的胆固醇含量[4]。
NAFLD发病机制极为复杂,1998年Day和James提出的“二次打击”学说已成为解释该病发生机制的主要理论[5]。胰岛素抵抗(insulin resistance,IR)在NAFLD的形成中发挥着“一次打击”的作用,导致肝细胞脂肪变性。相关机制研究表明,胰岛素受体底物2(IRS-2)是胰岛素在肝中信号转导的主要介导物,调控着胰岛素敏感性,而核SREBPs能有效地取代和干扰反式作用因子的结合,来抑制下游P13K/Akt通路,从而减少糖原合成[6]。因此,SREBPs能直接下调IRS-2的转录,从而抑制胰岛素信号转导。推测这种分子机制解释了糖原合成向脂质合成的转移以及IR的形成,而IR可通过增加糖酵解而促进肝细胞内脂肪酸的合成,造成肝内脂质(主要为TG)蓄积而引起NAFLD。Shimomura等成功建立了SREBP-1c在肝脏过度表达的小鼠模型,观察到这些小鼠出现了脂质紊乱、IR和肝脂肪变性[7]。通过转基因小鼠和基因剔除小鼠的研究发现SREBP-1c主要与脂肪酸代谢和糖代谢有关[8]。
已有研究表明,针刺在治疗脂肪肝及肝纤维化方面有一定的效果[9]。穴位埋线的埋线过程与针刺过程相似,具有普通针刺疗法的作用效果,并具备针刺“静以留之”的长期作用,类似“埋针”疗法。肠线在穴位内慢慢软化、分解、吸收的过程对穴位产生一种柔和而持久的刺激,从而达到慢性疾病长期治疗的目的。我们通过大量的前期的临床工作已发现穴位埋线对治疗非酒精性脂肪肝的治疗有效率达92.50%,可通过降低血清瘦素水平、改善胰岛素抵抗,增加肝细胞对胰岛素的敏感性,从而调节血脂代谢,达到治疗NAFLD患者的作用[10]。本实验显示,与正常组相比,模型组SREBP-1的表达明显高于正常组。本实验Western blot结果显示穴位埋线4周组、穴位埋线8周组的SREBP-1的蛋白表达水平明显低于对照组。穴位埋线8周又低于4周治疗组。初步证明穴位埋线对脂质代谢具有时间的量效关系,同时也进一步证明了穴位埋线疗法在调控胰岛素抵抗信号通路方面具有重要意义。
综上所述,中医认为NAFLD的基本病机是脾肾亏虚,而在此体质基础上形成的痰、湿、瘀等病理产物为本病发病之关键,因此我们在选择穴位进行埋线治疗时遵循化痰利湿、活血化瘀的治则。SREBP-1作为调控胰岛素调节通路中一个必不可少的元素参与脂质的合成,通过穴位埋线治疗能减弱SREBP-1的表达,这也许与NAFLD的脂质的合成减少有关,调节SREBP-l表达可能是治疗NAFLD的潜在的靶点。从而这在一定的程度上推断穴位埋线疗法对调控胰岛素调节通路各蛋白分子的表达有着潜在作用,也为今后进一步探讨NAFLD中西医病机的相关性提供可研究的方向。
[1] 李忠仁.实验针灸学[M].北京:中国中医药出版社,2003:314.
[2] Hresko RC, Mueckler M.mTOR.RICTOR is the Ser473 kinase for Akt/protein kinase B in 3T3-L1 adipocytes[J].JBiol Chem,2005,280(49),40406-40416.
[3] Porstmann T,Santos CR,Griffiths B,etal.SREBP activity is regulated bymTORC1 and contributes to Akt-dependent cell growth[J].CellMetab,2008,8(3):224-236.
[4] Wullschleger S,Loewith R,Hall M N.TOR signaling in growth and metabolism[J].Cell,2006,124(10):471–484.
[5] ChalasaniN,DeegMA,Persohn S,etal.Metabolicand anthropometric evaluationofinsulin resistanceinnondiabeticpatientswithnonalcoholic steatohepatitis[J].Am JGastroenterol,2003,98(10):1849-1855.
[6] Thomas Porstmann, Beatrice Griffiths, Yuen-Li Chung, et al.PKB/Akt induces transcription of enzymes involved in cholesterol and fatty acid biosynthesis via activation of SREBP[J].Oncogene,2005,24(10):6465-6481.
[7] AhmedMH,ByrneCD.Modulationofsterolregulatoryelementbinding proteins (SREBPs) aspotential treatments fornon-alcoholic fatty liver disease(NAFLD)[J].DrugDiscov Today,2007,12(17-18):740-747.
[8] Kammoun H L, Chabanon H, Hainault I, etal.GRP78 expression inhibitsinsulinand ER stress-induced SREBP-1cactivation and reduces hepatic steatosisinmice[J].JClin Invest,2009,119(5):1201-1215.
[9] 田虹,金丽敏.电针艾灸治疗单纯肥胖性脂肪肝30例临床观察[J].针灸临床杂志,2004,20(12):32-33.
[10]周晓玲,谢胜.穴位埋线结合强肝消脂饮对非酒精性脂肪肝血清瘦素水平及胰岛素抵抗指数的影响[J].中国中医急症,2010,19(11):1845-1846.
