我院2010年107份不良反应报表质量分析
2011-02-03韩敏珍刘红艳姜军
韩敏珍 刘红艳 姜军
我院2010年107份不良反应报表质量分析
韩敏珍 刘红艳 姜军
目的分析我院2010年107份药品不良反应(ADR)报告表质量。方法 根据我国ADR报告表(2004版)的填表要求,制定出ADR报告表填写质量评价标准,并按标准对报告表的填写质量进行统计、分析和评价。结果收集107份ADR报告表,13份为“数据完整”的报告,占12.24%;94份为“数据不完整”的报告,占87.76%。其中,缺项138次,平均每份报告表1.5次;填写错误63次,平均每份报告表0.7次;填写内容不完整46次,平均每份报告表0.5次。结论ADR报告表质量差。建议建立和完善监测机制和岗位操作规程(SOP),充分发挥临床药师的作用并进行ADR报告表填报的培训,逐步实施网络电子报表。
药品不良反应;报表;质量;分析
药品不良反应(ADR)是指合格药品在正常用法用量下出现的与用药目的无关或意外的有害反应。加强药品不良反应监测工作是为了保障公众用药安全。世界卫生组织(WHO)的统计资料表明,ADR发生率为5% ~20%,住院患者有10%~15%发生ADR。在我国每年5000多万住院患者中,至少有250万患者的住院治疗与ADR有关,住院患者中发生ADR的则有500万至1000万人[1]。药品不良反应(ADR)报告表信息收集是ADR信息资源处理流程的基础和起点,是保证ADR信息质量的关键。医师、药师及护士的ADR意识及其对ADR信息收集技术方法的掌握程度对医院ADR信息质量起着决定性作用。通过对我院2010年107份住院患者ADR报表进行统计分析,以引起广大医务人员对报告表填写质量的重视,同时探讨药品不良反应监测工作中存在的问题和解决方法。
1 资料与方法
1.1 一般资料 收集我院2010年各临床科室上报的ADR报告表107份。
1.2 方法 根据我国ADR报告表(2004版)的填表要求,制定出报告表填写质量评价标准。将需要填写的表格内容分为31项,31项内容均填写完整的报告表,定义为“数据完整”的报告表;缺项或填写错误、内容不完整的报告表,定义为“数据不完整”的报告表。运用EXCEL软件对ADR报告表进行统计分析。
2 结果
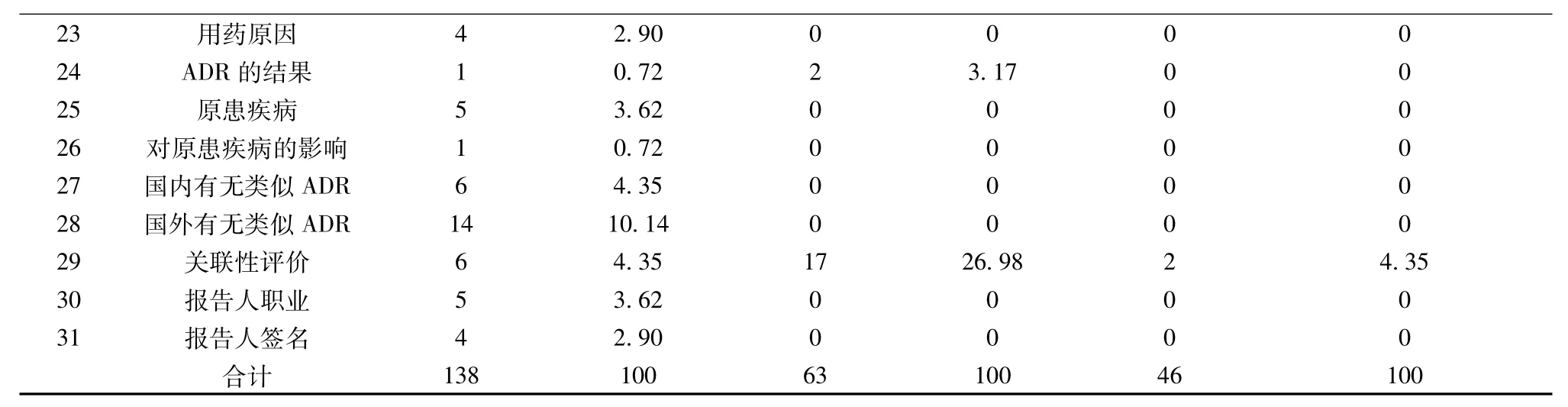
107份报告表中,13份为“数据完整”的报告,占12.24%;94份为“数据不完整”的报告,占87.76%,显示我院报告表的质量很低。不完整项目见表1。

表1 ADR报告表不完整项目表
23 用药原因42.90 0 0 0 0 24 ADR的结果 1 0.72 2 3.17 0 0 25 原患疾病 5 3.62 0 0 0 0 26 对原患疾病的影响 1 0.72 0 0 0 0 27 国内有无类似ADR 6 4.35 0 0 0 0 28 国外有无类似ADR 14 10.14 0 0 0 0 29 关联性评价 6 4.35 17 26.98 2 4.35 30 报告人职业 5 3.62 0 0 0 0 31 报告人签名 4 2.90 0 0 0 0合计138 100 63 100 46 100
3 分析
3.1 报告表填写缺项 从表看,在不合格的94份报告表中,缺项的报告数共达138次,平均1份报告就有1.5次,缺项情况严重。其中缺少“商品名称”的报告最多,共21份,占15.22%;缺项的报告数占第二位的是“国外有无类似ADR”,共14例,占10.14%;第三位的是“批号”,有8例,占5.88%;第四位的是“ADR的性质、部门、电话”,各7例,占5.07%;第五位的是“生产厂家、用药起止时间、国内有无类似ADR、关联性评价”,各6例,占4.35%。
3.2 报告表填写错误 从表看,在不合格的94份报告表中,填写错误63次,平均每份报告表错误0.7次,填写错误的情况较严重。其中通用名称填错误18次,占28.57%;关联性评价填错17次,占26.98%;用药起止时间填错13次,占20.63%;部门填错6次,占9.52%;ADR的性质填错5次,占7.94%;出生日期和 ADR的结果各填错 2次,占3.17%。
3.3 报告表填写内容不完整 从表看,在不合格的94份报告表中,填写内容不完整的46次,平均每份报告表填写内容不完整0.5次。其中“ADR描述及处理情况”内容不完整19次,占41.30%;“用法用量”内容不完整12次,26.09%;“通用名称”内容不完整11次,占23.91%;“用药起止时间”和“关联性评价”内容不完整各2次,占4.35%。
出现上述情况的主要原因可能有以下几点:①填表人对开展ADR监测工作的重要性和必要性认识不够。认为填写ADR报告表只是领导布置下来的事,不影响大局,所以责任心不够,敷衍了事。②填表人缺乏ADR的基础知识,对ADR的定义、类型和因果关系评价等缺乏应有的认识。③对处方药物不熟悉。医生不了解处方药物的商品名和ADR的国内外情况,所以填写时只能空缺。④医务人员没有严格执行岗位操作规程(SOP),对医嘱执行的记录不完整,或配药后丢弃药品包装,当出现ADR时,无法填写表格内相应的内容。
4 讨论
4.1 争取领导重视,建立和完善药品不良反应报告的监测机制是ADR监测工作的关键争取领导重视,建立和完善监测机制,切实落实《药品不良反应报告和监测管理办法》及有关ADR的各项工作制度,是建设和落实开展药品不良反应报告和监测工作的关键。
4.2 建立和完善药品不良反应报告和监测工作的岗位操作规程是ADR监测工作的保障建立ADR发现、处理、报告的岗位SOP;完善病程、用药和护理文书的记录。有完整的各项临床记录和药品资料,才有可能填写出内容完整的报告表。
4.3 加强宣传教育和报告表填报的培训是ADR监测工作的基础。ADR报告和监测工作的宣传教育,特别是报告表填报的培训,是提高ADR报告表质量的基础。充分发挥临床药师的作用,临床药师下临床后应帮助和指导临床医生及护士正确填写报告表,在ADR的发现、治疗、报告和预防等方面起积极作用,有效提高报告表的质量。
总之,ADR报告表是获取ADR信息的基础、关键,错误的ADR报告表会给ADR的分析、评价作出的错误判断。因此,提高ADR报告表的质量,是做好ADR监测工作的关键。
[1] 卢熠,何文威.医院开展药品不良反应监测的现状及改进建议.中国药业,2006,15(12):40-41.
556000 贵阳医学院第二附属医院药剂科
