碳纤维增强碳与碳化硅双基体陶瓷基复合材料作为口腔种植体材料的细胞毒性
2011-02-03方铁钧周群狄丽莎谭兆军邓景屹
方铁钧,周群,狄丽莎,谭兆军,邓景屹
(1.中国医科大学附属盛京医院口腔科,沈阳 110004;2.中国医科大学口腔医学院儿童牙科,沈阳110002;3.中国科学院金属研究所,沈阳 110016)
碳纤维增强碳与碳化硅双基体陶瓷基复合材料作为口腔种植体材料的细胞毒性
方铁钧1,周群1,狄丽莎2,谭兆军1,邓景屹3
(1.中国医科大学附属盛京医院口腔科,沈阳 110004;2.中国医科大学口腔医学院儿童牙科,沈阳110002;3.中国科学院金属研究所,沈阳 110016)
目的通过体外细胞培养法评价碳纤维增强碳与碳化硅双基体陶瓷基复合材料(C/C-SiC)对细胞生长和凋亡的影响。方法 用实验材料不同浓度浸提液培养小鼠成纤维细胞L929,采用MTT法检测细胞的相对增殖度;采用急性溶血试验检测材料对血细胞的溶血作用,计算溶血率;采用流式细胞仪、Annexin V-FITC/PI双染法检测阴性对照组、100%C/C-SiC组、纯钛组、阳性对照组的细胞散点图,计算正常细胞、早期凋亡、晚期凋亡和坏死细胞的比例。结果 C/C-SiC复合材料的细胞毒性为1级,溶血率为0.156%,无明显溶血反应,与阴性对照组和纯钛组的差异无统计学意义(P>0.05)。C/C-SiC组4个象限细胞比例与纯钛组和阴性对照组比较差异无统计学意义(P>0.05),阳性对照组的早期凋亡、正常细胞比例与其他任一组比较差异均有统计学意义(P<0.05)。结论 C/C-SiC复合材料有生物安全性基础,无细胞毒性,无溶血反应。
细胞毒性;溶血反应;MTT;成纤维细胞L929;复合材料;凋亡
目前口腔种植体材料大部分是钛和钛合金材料,金属种植体本身的缺点是与骨组织的弹性模量相差较大,易形成应力集中和骨吸收。碳纤维复合材料如碳纤维增强碳基体复合材料(C/C),由于碳元素有优异的生物相容性能,具有与人体骨非常接近的弹性模量[1,2],能有效减少应力屏蔽效应导致的骨吸收[3],而且材料具有稳定的化学性质和高强度的机械性能,是一种潜在的骨修复和替代材料。但是C/C复合材料长期置于体内,其游离出来的碳颗粒会沉积到皮肤,造成“黑肤效应”[4]。C/C-SiC是以C/C为胚体,用化学气相渗透技术把SiC基体通过气相渗透而制得。C/C-SiC克服了C/C碳颗粒易脱落易氧化的缺点,具有更出色的各种性能。C/C-SiC作为生物医学材料的应用研究还未见报道。本研究采用中国科学院金属研究所提供的C/C-SiC,利用体外细胞毒性手段,初步探究该材料作为口腔种植体材料的可行性。
1 材料与方法
1.1 材料、仪器与试剂
C/C-SiC、纯钛、纯铅(中国科学院金属研究所),L929小鼠成纤维细胞(中国医科大学实验技术中心),Annexin V-FITC/PI、MTT、DMSO(美国 Sigma 公司),IX70倒置显微镜(日本Olympus公司),酶标检测仪(奥地利Tecan公司),流式细胞仪(美国BD公司)。
1.2 材料的制备与浸提液的提取
1.2.1 MTT法和Annexin V-FITC/PI双染法浸提液提取:C/C-SiC、纯钛、纯铅利用线切割技术制成5mm×5mm×2mm大小。取C/C-SiC片、纯钛片、纯铅片各30片,常规超声波清洗,蒸馏水清洗,烘干后放入75%乙醇浸泡24h,滤纸上干燥,紫外线正反面各照射30min后置于浸提容器内,按样本表面积与浸提液比例为3cm2/mL加入RPMI1640培养液,在37℃恒温器浸提72h。
1.2.2 溶血试验浸提液提取:将C/C-SiC片、纯钛片常规清洁,高温高压蒸汽消毒,干燥,按材料量与无菌生理盐水之比为5g/10mL的标准,每个试管加入10mL生理盐水,生理盐水全部覆盖材料(C/C-SiC组n=3,纯钛组n=3),同时设置对照组,每个试管10mL无菌生理盐水作为阴性对照组(n=3),每个试管10mL蒸馏水作为阳性对照组(n=3),共4组。将所有组置于37℃恒温水浴浸提30min后分别收集于无菌离心管中,放4℃冰箱保存。
1.3 实验方法
1.3.1 MTT法:将L929小鼠成纤维细胞经3次传代后取对数生长末期细胞,用0.5%胰蛋白酶消化,配制成2×104/mL的细胞悬液,取5块96孔培养板,每孔加入100μL细胞悬液,于37℃、5%CO2培养箱培养24h。吸除原培养液,每孔分别加入100μLRPMI1640液(阴性对照组)、铅浸提液(阳性对照组)、纯钛浸提液(纯钛组)、100%、50%和 25%的C/C-SiC浸提液(100%C/C-SiC组、50%C/C-SiC组、25%C/C-SiC组),浓度用RPMI1640液稀释控制,以没有细胞只有RPMI1640液(空白对照组)作为调零孔,共7组,每组6孔,继续培养。分别于24、48、72、96、120h后取出一块板,倒置显微镜下观察细胞的生长情况,每孔加入20μLMTT溶液,继续培养4h,吸除孔内的培养液,加入200μLDMSO溶液,摇床上低速振荡10min,用酶联免疫检测仪测定各孔的吸光度值(Optical density,OD),波长为 490nm,比较各组OD值的差异,计算细胞相对增殖率(relative growth rate,RGR),根据RGR判定材料的细胞毒性。RGR≥100%的细胞毒性等级为0级;75%~99%为1级;50%~74%为2级;25%~49%为3级;1%~24%为4级;<1%为5级。评价标准是0、1级为合格;2级应结合细胞形态评价;3、4、5级为不合格。

1.3.2 溶血试验:每20mL新鲜兔全血中加入1mL2%(20g/L)草酸钾生理盐水溶液,调整生理盐水用量,使稀释后兔血0.2mL在10mL蒸馏水中在545nm 处的 OD值为(0.8±0.3),使用前配制,于 4℃冰箱储存。每试管中加入抗凝兔血0.2mL,轻轻摇匀后置于37℃恒温水箱中60min后各试管1500r/min离心5min,吸取上清液,在紫外分光光度计上于545nm波长测量OD值,计算溶血率。评判标准:溶血率>5%时,可判断材料具有溶血作用。

1.3.3 Annexin V-FITC/PI双标记流式细胞仪检测细胞凋亡:取对数生长期末细胞,配制成1×106/mL的细胞悬液,取12孔培养板,每孔加入1mL细胞悬液,于CO2培养箱培养24h,吸除孔内培养液,分别加入RPMI1640液(阴性对照组)、100%C/C-SiC浸提液(100%C/C-SiC组)、纯钛浸提液(纯钛组)、铅浸提液(阳性对照组)1mL,共4组,每组6孔,培养48h后,吸除浸提液,胰酶消化细胞,加入1mL冷PBS,在 4℃、1000r/min离心10min,冷 PBS清洗 2次。将细胞重悬于400μL缓冲液,加入5μLAnnexin V-FITC轻轻摇匀,避光室温下反应15min,加入10μLPI,避光室温反应5min,1h内上流式细胞仪检测,选择488nm氩离子激光源。观察各组细胞流式细胞仪散点图,计算各组正常、早期凋亡、晚期凋亡和坏死细胞的含量。
1.3 统计学分析
2 结果
2.1 L929细胞形态学
在倒置显微镜下观察,24~120h阴性对照组、纯钛组、各浓度C/C-SiC组的细胞密度增加。120h时细胞长满培养板底部,呈重叠状态,细胞生长状态良好,呈梭形或多角形,形态规则,核分裂相多见,仅见到个别细胞皱缩、变圆。24h时阳性对照组细胞数量少,且大部分细胞已皱缩,形态极不规则,细胞间隙变大,细胞中可见颗粒样物质,120h时几乎所有阳性对照组细胞已脱落死亡。见图1。

2.2 MTT实验结果
阴性对照组、纯钛组及25%、50%、100%C/CSiC组的OD值随时间的推移逐渐增大,从96h开始细胞的增长进入平台期,而阳性对照组细胞的OD值随时间的推移逐渐减少,至120h已基本达到空白对照组的OD值水平。见图2。

随着培养时间的增加,阴性对照组、纯钛组、25%、50%、100%C/C-SiC组的OD值也相应增加,与培养时间成正线性关系,显示细胞生长较快。阳性对照组随着时间的增加OD值减少,表示细胞生长受到抑制及破坏。经统计学分析,各时间点阳性对照组与其他组比较OD值的差异均有统计学意义(P<0.01),25%、50%、100%C/C-SiC组与阴性对照组和纯钛组比较、纯钛组与阴性对照组比较,OD值的差异均无统计学意义(P>0.05)。见表1。纯钛组及25%、50%、100%C/C-SiC组细胞毒性为0或1级,表现出很轻微的细胞毒性,阳性对照组细胞毒性为2~4级,表现出很明显的细胞毒性。见表2。
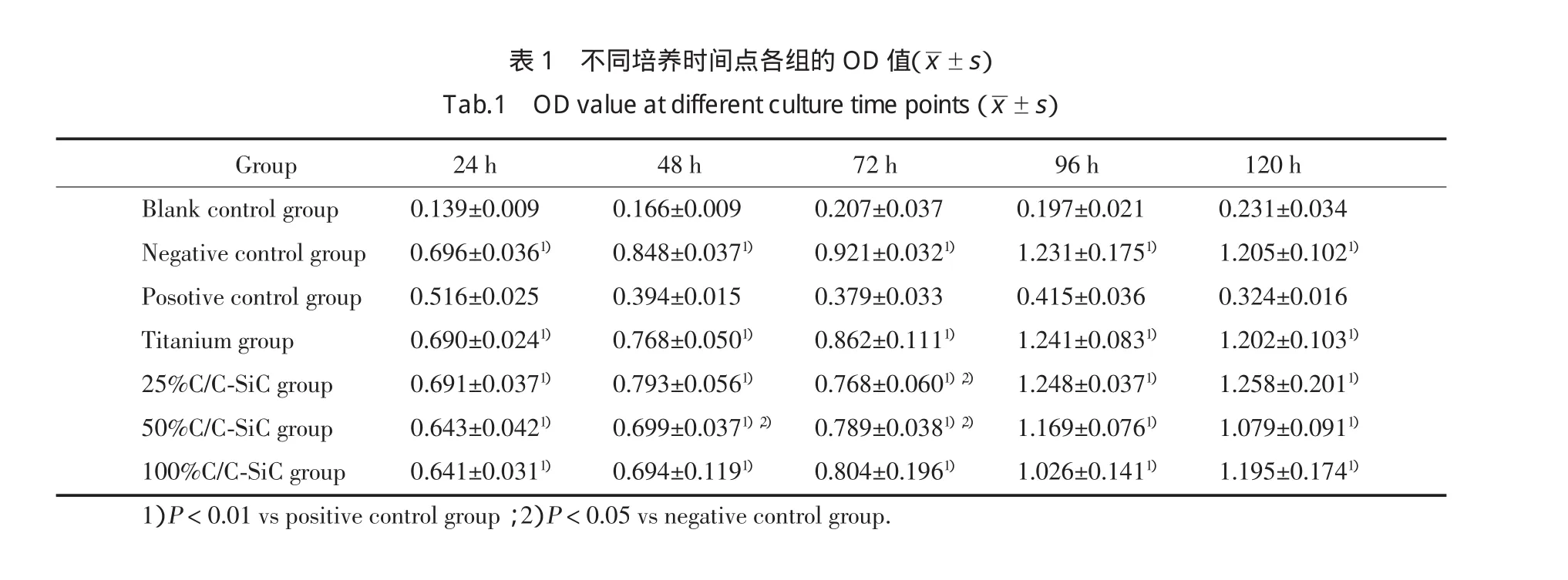
表1不同培养时间点各组的OD值(±s)Ta b.1ODv a l u e a t d i f f e r e n t c u l t u r e t i m e p o i n t s(±s)Gr o u p 24h 48h 72h 96h 120h Bl a n k c o n t r o l g r o u p 0.139±0.009 0.166±0.009 0.207±0.037 0.197±0.021 0.231±0.034Ne g a t i v e c o n t r o l g r o u p 0.696±0.0361) 0.848±0.0371) 0.921±0.0321) 1.231±0.1751) 1.205±0.1021)Po s o t i v e c o n t r o l g r o u p 0.516±0.025 0.394±0.015 0.379±0.033 0.415±0.036 0.324±0.016Ti t a n i u m g r o u p 0.690±0.0241) 0.768±0.0501) 0.862±0.1111) 1.241±0.0831) 1.202±0.1031)25%C/C-Si Cg r o u p 0.691±0.0371) 0.793±0.0561) 0.768±0.0601),2) 1.248±0.0371) 1.258±0.2011)50%C/C-Si Cg r o u p 0.643±0.0421) 0.699±0.0371),2) 0.789±0.0381),2) 1.169±0.0761) 1.079±0.0911)100%C/C-Si Cg r o u p 0.641±0.0311) 0.694±0.1191) 0.804±0.1961) 1.026±0.1411) 1.195±0.1741)1)P < 0.01v s p o s i t i v e c o n t r o l g r o u p;2)P < 0.05v s n e g a t i v e c o n t r o l g r o u p.
2.3 溶血试验结果
C/C-SiC样品与纯钛的溶血率均为0.156%,小于5%,C/C-SiC样品无明显的溶血反应存在。
2.4 Annexin V-FITC/PI双标记流式细胞仪检测结果
100 %C/C-SiC组、纯钛组、阴性对照组均有大量活细胞集中于左下象限,早期凋亡细胞量少,阳性对照组右下象限可见明显增多的早期凋亡细胞。100%C/C-SiC组4个象限的细胞比例与纯钛组和阴性对照组比较差异无统计学意义(P>0.05),阳性对照组的早期凋亡、正常细胞含量与其他任一组比较,差异均有统计学意义(P<0.05)。见图3,表3。

表2不同培养时间点各组细胞RGR与细胞毒性等级Ta b.2RGRa n d c y t o t o x i c i t y l e v e l a t d i f f e r e n t c u l t u r e t i me p o i n t s 24h 48h 72h 96h 120h RGR(%) Cytotoxicity RGR(%) Cytotoxicity RGR(%) Cytotoxicity RGR(%) Cytotoxicity RGR(%) Cytotoxicity Negative control group 100.00 0 100.00 0 100.00 0 100.00 0 100.00 0Positive control group 67.68 2 33.43 3 24.09 4 21.08 4 9.55 4Titanium group 98.92 1 88.27 1 91.74 1 100.97 0 99.69 125%C/C-SiCgroup 99.10 1 91.94 1 78.57 1 101.64 0 105.44 050%C/C-SiCgroup 90.48 1 78.15 1 81.51 1 94.00 1 87.06 1100%C/C-SiCgroup 90.13 1 77.42 1 83.61 1 80.17 1 98.97 1Group

表3流式细胞仪检测结果(±s,%)Ta b.3Th e r e s u l t s o f f l o wc y t o me t r y(±s,%)Cells Negative control group Titanium group 100%C/C-SiCgroup Positive control group V-/PI-(LL)89.07±0.161)88.19±1.261)88.16±0.851)81.94±0.79V+/PI-(LR)5.35±0.411)6.05±0.571)5.35±0.151)12.86±0.90V+/PI+(UR) 5.07±0.24 5.29±0.90 5.13±0.89 4.75±0.14V-/PI+(UL) 0.51±0.16 0.47±0.08 0.35±0.12 0.45±0.131)P<0.05vs positive control group.

3 讨论
C/C的碳纤维在特殊角度下编织而成的,具有一定的韧性,符合天然牙在牙槽窝内有一定生理动度的特性,Meijer等[5]提出,柔性材料的种植体与骨发生柔韧的结合,种植体能更好地把应力传递到周围的骨组织,因此它可能是硬性种植体很有前途的替代品。C/C在作为生物材料应用方面人们做了较多的研究,细胞毒性实验发现无细胞毒性[6,7],具有很好的细胞相容性能。在20世纪90年代初,乌克兰国家科学中心哈里科夫技术物理研究院就展开了C/C作为人工骨组织替换材料方面的大量研究,用该材料生产的人工骨段、关节头都已成功应用于临床,并且取得良好的效果。然而C/C也有不足之处,如材料表面摩擦或长期存在体内其碳颗粒会脱落,随着体液的流动部分沉积于体表形成“黑肤效应”。C/C-SiC是在C/C的基础上利用化学气相渗透技术把SiC基体通过气相渗透制得,其每束碳纤维表面覆盖一层热解碳层然后再由气相渗透的SiC基体覆盖,成为了一体材料,因此材料有效阻止了热解碳层的暴露与碳颗粒的脱落,强度也随之大大提高。
体外细胞培养法是研究生物相容性的常用方法之一,体外细胞毒性试验是评价生物安全性最早、最重要且又应用广泛的方法。MTT法是检测材料细胞毒性的常用方法。本实验选用L929小鼠成纤维细胞系作为细胞毒性的试验对象,该细胞系具有易培养与传代、稳定、可重复性强等优点,在细胞毒性试验中被常规地选用。实验对材料浸提液的3个稀释浓度的细胞毒性进行一系列连续的时间点监测,这样更实际地反映出浸提液浓度及时间的变化对细胞增殖度的影响。MTT结果中,只有48h时的50%C/C-SiC组和72h时的25%C/C-SiC组和50%C/CSiC组的OD值与阴性对照组的OD值差异有统计学意义(P<0.05),但这3个组与纯钛组比较差异无统计学意义(P>0.05)。其他的纯钛组、25%C/C-SiC组、50%C/C-SiC组、100%C/C-SiC组与阴性对照组的OD值差异均无统计学意义(P>0.05),表明C/CSiC和纯钛一样具有良好的细胞相容性能。阳性对照组与任何一组的OD值差异均有统计学意义(P<0.01),说明铅有明显细胞毒性。由于实验用的C/CSiC来自工业用材料,不是特殊生产的生物医用材料,材料在生产过程中可能会存在某些杂质,杂质随浸提液释出而对细胞产生影响,这可能是实验中个别C/C-SiC组与阴性对照组OD值的差异存在统计学意义的原因之一。
材料植入体内后可与血液接触,若材料存在溶血因素,则会引起血细胞的破坏。急性溶血试验作为评价与骨和软组织长期接触材料的生物安全性测试方法之一,比较敏感地反映材料对红细胞的影响。溶血试验也被认为是细胞毒性评价的一个补充实验[8]。按照中国医药行业标准,急性溶血试验阴性对照组吸光度值不大于0.03、阳性对照组吸光度值在(0.8±0.3)时,实验结果灵敏度较高,本实验符合这一要求。实验结果可见,C/C-SiC与纯钛一样,其溶血率为0.156%,小于5%,无明显溶血反应存在。
在材料的生物相容性评价中,细胞凋亡的发生与材料的性质或结构有关,对凋亡过程的分析有助于了解组织与材料的相互作用[9]。流式细胞计量术被广泛应用于分析细胞活性,它能够探测细胞凋亡途径。由散点图可发现,阴性对照组、100%C/C-SiC组、纯钛组大量细胞集中于左下象限,说明正常细胞含量多,生长状况良好,任二者之间未见统计学差异,由此可见C/C-SiC不促进细胞的凋亡。而阳性对照组右下象限见明显增多的早期凋亡细胞,与其他任一组的差异均有统计学意义,说明纯铅浸提液促进细胞的凋亡,具有细胞毒性。当然,本实验从单一时间点来检测细胞的凋亡,这可能并不是代表细胞凋亡的真实程度,因为细胞凋亡是一个复杂并且不同步的过程[9],所以未来的实验要把时间因素对细胞凋亡的影响考虑在内。
细胞毒性试验是评价材料生物相容性的初级试验,即一个筛选试验,确定材料能不能进行下一步的研究[10]。目前,C/C-SiC主要应用于航天航空和高温工业领域,在生产过程中可能存在一些对人体健康有害的物质。因此,在进行下一步动物体内实验研究之前,需要对有害物质的种类和含量进行测定,并设计去除有害的杂质,研制符合生物医用材料标准的生产工艺。
[1]Pesakova V,Klezl Z,Balik K,et al.Biomechanical and biological properties of the implant material carbon-carbon composite covered with pyrolytic carbon[J].JMater Sci:Mater M,2000,11(2):793-798.
[2]Cao N,Li MS,Ma QS,et al.Biomedical coatings prepared on carbon/carbon composite[J].Sci Eng Compos Mater,2007,14(3):241-249.
[3]Bruckmann H,Huttinger KJ.Carbon,a promising material in endoprosthetics.Part 1:the carbon materials and their mechanical properties[J].Biomaterials,1980,1(2):67-72.
[4]Cao N,Bai YQ,Ma QS,et al.Biological behavior of hydroxyapatite coatings on carbon/carbon composites produced by plasma spraying[J].New Carbon Mater,2008,23(2):144-148.
[5]Meijer GJ,Cune MS,Bandooren M,et al.Acomparative study of flexible (polyactive)versus rigid hydroxyapatite permucosal dental implants.Ⅰ.Clinical aspects[J].JOral Rehabil,1997,24(2):85-92.
[6]Pesakova V,Smetanajr K,Balik K,et al.Biological and biochemical properties of the carbon composite and polyethylene implant materials[J].JMater Sci:Mater M,2003,14(6):531-537.
[7]Cao N,Wang QX,Dong JW,et al.Characterization and biological behavior of a carbon fiber/carbon composite scaffold with a porous surface for bone tissue reconstruction [J].New Carbon Mater,2010,25(3):232-235.
[8]孙皎,顾国珍,钱云芳.生物材料不同接触方式和条件对溶血作用影响的研究[J].生物医学工程杂志,2003,20(1):8-10.
[9]Gough JE,Scotchford CA,Downes S.Cytotoxicity of glutaraldehyde crosslinked collagen/poly(viny1alcohol)films is by the mechanism of apoptosis[J].JBiomed Mater Res,2002,61(1):121-130.
[10]Elshahawy WM,Watanabe I,Kramer P.In vitro cytotoxicity evaluation of elemental ions released from different prosthodontic materials[J].Dent Mater,2009,25(12):1551-1555.
(编辑 陈 姜,英文编辑 刘宝林)
Cytotoxicity of Carbon Fiber-reinforced C-SiCBinary Matrix Composite(C/C-SiC) for Dental Implant Materials
FANGTie-jun1,ZHOUQun1,DILi-sha2,TANZhao-jun1,DENGJing-yi3
(1.Department of Stomatology,Shengjing Hospital,China Medical University,Shenyang 110004,China;2.Pediatric Dentistry,School of Stomatology,China Medical University,Shenyang 110002,China;3.Institute of Metal Research,Chinese Academy of Sciences,Shenyang 110016,China)
ObjectiveTo evaluate the effect of C/C-SiCcomposite on the growth and apoptosis of mouse fibroblast cells.MethodsMouse fibroblasts (L929)were cultured in a series of elution of specimen,MTTassay was performed to investigate the relative growth rates;Hemolytic reaction of specimen to blood cells was detected by acute hemolysis test;Cell scatter diagrams of elutes of negative control group,100%C/C-SiCgroup,titanium group,positive control group was detected by Annexin V-FITC/PIdouble staining,the viable,early apoptotic,late apoptotic and necrosis cells were calculated.ResultsThe cytotoxicity of C/C-SiCcomposite was grade 1,acute hemolysis rate was 0.156%.There were no significant differences between the negative control group and C/C-SiCgroup or between the titanium group and C/CSiCgroup(P>0.05);The FACSimages showed that the proportions of cells in four quadrants of titanium group,negative control group were not statistically different from C/C-SiCgroup (P>0.05),there were more early apoptotic cells and less viable cells in positive control group than that of other three groups (P<0.05).ConclusionThe C/C-SiCcomposite was compatible with tested cells,with a relative background of biological safty.
cytotoxicity;hemolysis;MTT;fibroblast L929;composite;apoptosis
R783.1
A
0258-4646(2011)05-0417-05
doi CNKI:21-1227/R.20110523.1813.003
http://www.cnki.net/kcms/detail/21.1227.R.20110523.1813.003.html
方铁钧(1983-),男,硕士研究生.
周群,E-mail:zhouqun_888@163.com
2010-11-04
网络出版时间:2011-05-1815:25
