CDH12对涎腺腺样囊性癌细胞侵袭能力的影响
2011-02-03王锦锋佘林于林灿郑斐斐卢友光
王锦锋,佘林,于林灿,郑斐斐,卢友光
(福建医科大学附属口腔医院预防科,福州 350002)
CDH12对涎腺腺样囊性癌细胞侵袭能力的影响
王锦锋,佘林,于林灿,郑斐斐,卢友光
(福建医科大学附属口腔医院预防科,福州 350002)
目的探讨CDH12基因对涎腺腺样囊性癌细胞(SACC)侵袭能力的影响。方法 应用巢式RT-PCR法从涎腺腺样囊性癌高转移细胞株SACC-M的总RNA中扩增出CDH12cDNA;应用AdEasyTMXL腺病毒载体系统构建含人CDH12基因的重组腺病毒表达载体;转染SACC-M细胞后,采用Western blot检测CDH12蛋白分子的表达,采用侵袭小室法检测CDH12对SACC-M细胞侵袭能力的影响。结果 CDH12基因重组腺病毒及空腺病毒经鉴定正确;Western blot检测发现,CDH12基因重组腺病毒转染细胞(Ad-CDH12/SACC-M)组CDH12的表达水平明显高于空腺病毒载体转染(Ad0/SACC-M)对照组;与Ad0/SACC-M组相比,Ad-CDH12/SACC-M组细胞的侵袭能力明显高于Ad0/SACC-M组(P<0.01)。结论CDH12能够促进涎腺腺样囊性癌细胞的体外侵袭能力,提示该基因在涎腺腺样囊性癌的侵袭转移中可能具有重要意义。
CDH12;腺病毒;腺样囊性癌;侵袭
涎腺腺样囊性癌(salivary adenoid cystic carcinoma,SACC)是最常见的唾液腺恶性肿瘤之一,容易侵袭神经或侵入血管并扩散,通过血行转移至肺是SACC的临床生物学特征之一。CDH12基因编码的神经型钙黏素(N-cadherin)分子是钙黏素分子家族的重要成员,目前已在多种人类肿瘤中检测到了N-cadherin的异常表达[1]。我们在前期研究中构建了转移能力不同的两个SACC细胞株的基因表达谱[2],在此基础上筛选出可能与转移相关的cadherin家族基因,并应用实时定量PCR技术及免疫组化技术检测了SACC高低转移细胞株之间cadherin基因相对表达水平的差异,发现CDH12基因在SACC高低转移细胞株之间的表达水平有明显差异[3]。这说明CDH12基因可能在SACC的侵袭转移中起重要的作用。本研究通过构建CDH12基因重组腺病毒表达载体,观察其对涎腺腺样囊性癌高转移细胞株SACC-M侵袭能力的影响,以期进一步研究CDH12与涎腺腺样囊性癌侵袭转移的关系。
1 材料与方法
1.1 细胞
人涎腺腺样囊性癌高转移细胞株SACC-M由上海交通大学医学院附属第九人民医院口腔颌面外科肿瘤实验室惠赠,SACC-M是利用人涎腺腺样囊性癌低转移细胞株SACC-2[4]5次连续裸鼠体内传代,结合体外克隆技术,筛选出的肺高转移性腺样囊性癌细胞株[5],其转移能力与SACC-2相比有明显的增强,转移率由18%提高至96%。腺病毒包装细胞AD-293由福建医科大学分子医学研究中心、福建省高校感染与肿瘤重点实验室提供。SACC-M以及AD-293细胞均培养于含10%胎牛血清的DMEM培养基,置于37℃、5%CO2、饱和湿度培养箱培养。
1.2 质粒、菌株及主要试剂
腺病毒穿梭载体pShuttle-IRES-hrGFP-1、E.coli DH5α、BJ5183-AD-1和XL 10-Gold菌株购自美国Stratagene公司;DMEM培养基、胰酶和胎牛血清(FBS) 购自美国 HyClone 公司;TRIzol、Lipofectine 2000购自美国 Invitrogen公司;PrimeScript RT reagent Kit、PrimeSTAR HS DNA Polymerase、DNA Ligation Kit Ver.2.0、pMDTM18-T Vector 购 自 日 本TaKaRa宝生物公司;胶回收及质粒小量抽提试剂盒购自上海超世生物科技有限公司;质粒大量抽提试剂盒购自德国Qiagen公司;限制性核酸内切酶NheⅠ、XhoⅠ、PmeⅠ和PacⅠ等购自美国NEB公司;兔抗人-CDH12抗体购自英国Abcam公司;细胞裂解液、BCA法定量试剂及AP标记山羊抗兔二抗购自上海碧云天生物技术公司;PVDF膜购自美国Amersham公司;CDP-STAR购自瑞士Roche公司;Fibronectin、BD BioCoatTMMatrigelTMInvasion Chamber为美国BD公司产品;其余化学试剂为国产分析纯。
1.3 引物设计与合成
PCR引物(表1)根据GenBank登录的CDH12基因序列(NM_004061)用primer 3.0程序设计,其中内引物的上游引物含有NheⅠ酶切位点(下划线斜体所标示序列),下游引物含有XhoⅠ酶切位点(下划线斜体所标示序列),设计完成后由上海博尚生物技术有限公司合成。

表1C D H 12巢式P C R引物T a b.1P r i me r s u s e d f o r n e s t e d P C R Primer Sequence of primers PCR product size(bp)Outer-primer Forward 5′ACGGTTGATTTGACGGATTTCT 3′ 2762Reverse 5′CTTGTCCCAGAGTGTGTGTGTG 3′Inter-primer Forward 5′CTAGCTAGCATGCTTACAAGGAACTGTTT 3′ 2403Reverse 5′CCGCTCGAGAGTGACTTTATCAGGGTTAT 3′
1.4 CDH12基因的扩增、克隆、筛选和鉴定
取处于对数生长期的SACC-M细胞,采用TRI-zol试剂提取细胞总RNA,电泳确认RNA未被降解后,用紫外可见分光光度计测定样品吸光度(A260及 A280)。取 0.5μg RNA,利用 PrimeScript RT reagent Kit进行RT-PCR,按照37℃15min;85℃2min;4℃10min合成cDNA;然后按照PrimeSTAR HS DNA Polymerase说明书进行巢式PCR扩增CDH12基因,并在CDH12基因两端引入NheⅠ和XhoⅠ酶切位点。PCR产物经1%琼脂糖凝胶电泳分离回收后,与pMD18-T vector于4℃进行连接,16h 后转化 E.coliDH5α 感受态菌,转化后(50μg/ml)氨苄青霉素抗性琼脂平板上随机挑选单克隆,PCR筛选重组子,EcoRⅠ酶切鉴定重组质粒。将经过PCR筛选和酶切鉴定正确的pMD18T-CDH12阳性重组子的菌液送往上海英骏生物技术有限公司作基因序列检测。经测序正确的克隆命名为pMD18TCDH12。用于筛选阳性克隆的PCR引物序列为:上游 5′CGCCAGGGTTTTCCCAGTCACGAC 3′,下游 5′GAGCGGATAACAATTTCACACAGG 3′。
1.5 CDH12基因重组腺病毒载体的构建
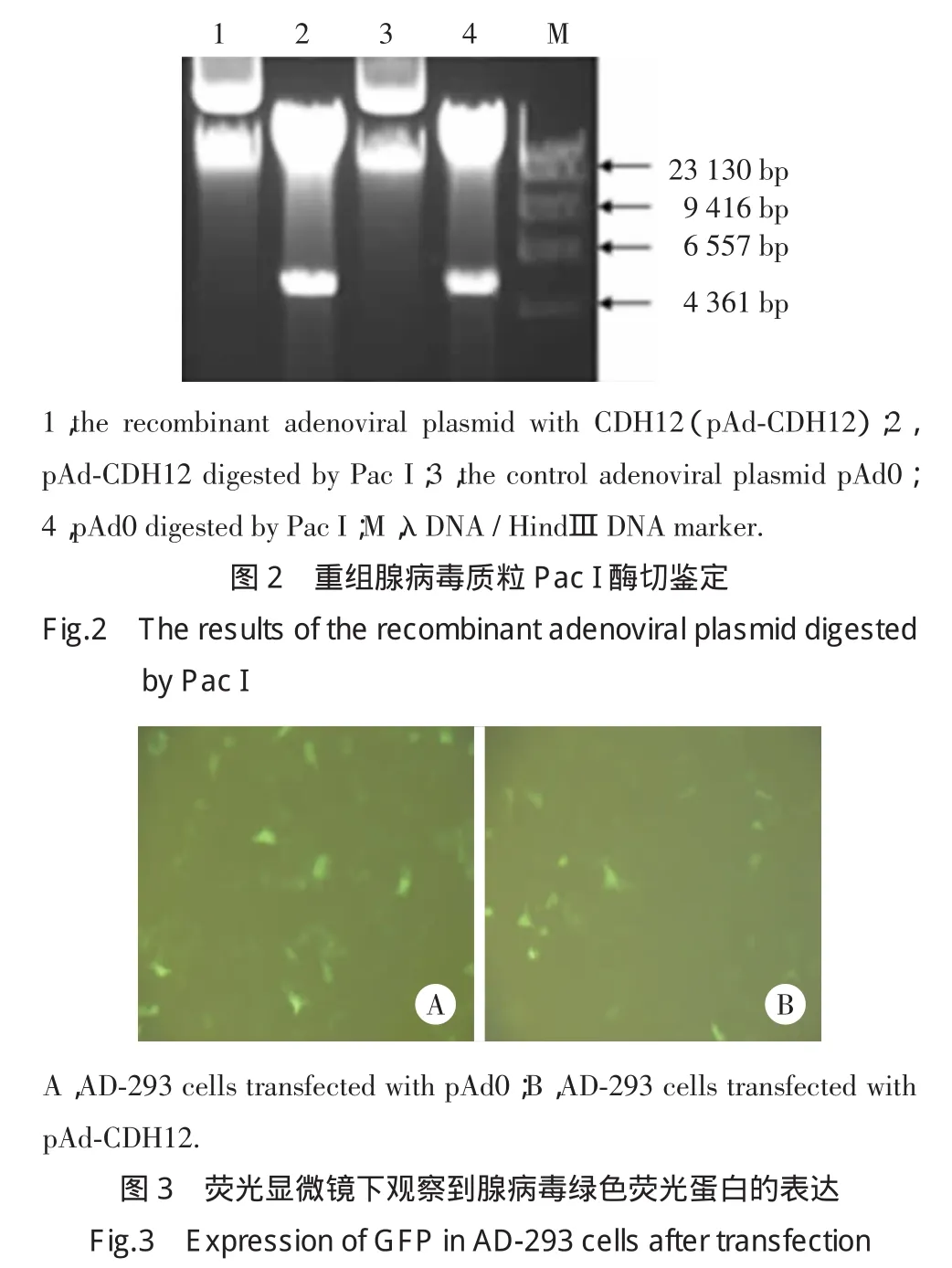
将测序正确的克隆pMD18T-CDH12与腺病毒穿梭载体pShuttle-IRES-hrGFP-1分别经NheⅠ和XhoⅠ双酶切后用DNA Ligation Kit连接,转化E.coli DH5α感受态菌后,抽提质粒行NheⅠ和XhoⅠ双酶切鉴定。鉴定正确后,将其转化BJ5183感受态菌,用50μg/ml卡那霉素LB琼脂平板筛选,PacⅠ酶切鉴定,阳性重组子转化XL 10-Gold感受态菌,Pac I酶切鉴定,大量抽提鉴定正确的重组腺病毒质粒(pAd-CDH12)及空腺病毒质粒(pAd0),定量后经PacⅠ消化及纯化,以Lipofectamine 2000转染AD-293细胞,转染10~14d后可见AD-293细胞发生细胞病变效应(cytopathic effect,CPE),荧光显微镜下观察绿色荧光蛋白的表达。继续扩增腺病毒2代,并测定腺病毒的滴度,获得最适感染复数(multiplicity of infection,MOI)。
1.6 CDH12基因重组腺病毒表达载体的鉴定
将Ad-CDH12及Ad0分别以MOI感染SACCM细胞,3d后收集细胞,加入细胞裂解液,提取总蛋白,BCA蛋白定量后,利用Western blot验证CDH12重组腺病毒载体的表达。即分别取15μg细胞总蛋白进行SDS-PAGE电泳后,电转移至PVDF膜,0.5%BSA封闭,依次结合兔抗人-CDH12单克隆抗体(一抗)、AP标记山羊抗兔IgG(二抗)后,用CDP-Star作为碱性磷酸酶的化学发光底物,暗室中X线片曝光、显影,扫描。以tubulin作为内参蛋白。
1.7 体外肿瘤细胞侵袭能力的测定
在已包被好Matrigel的BioCoatTMMatrigelTMInvasion Chamber内外加入500μl无血清DMEM培养基,置于37℃、5%CO2培养箱中2~3h。胰酶消化分别感染Ad-CDH12及Ad015h后的SACC-M细胞,重悬于无血清DMEM培养液,向小室内分别加入1.5×105个上述2组细胞。下室内加入700μl含0.1mg/ml Fibronectin和10%FBS的DMEM培养液,置37℃、5%CO2培养箱常规培养48h。取出小室,弃除上室液体,室温下结晶紫染色,用棉签擦净上室膜面未穿膜的细胞,光镜下(×200)计数5个视野的侵袭细胞数,计算平均值,每组重复3次。
1.8 统计学分析
2 结果
2.1 目的基因CDH12的获得
采用RT-PCR从SACC-M细胞提取总RNA,经巢式PCR扩增获得目的基因CDH12,并在CDH12基因两端引入NheⅠ和XhoⅠ酶切位点。产物经1%琼脂糖凝胶电泳,在约2.7kb处可见1明亮条带,与目的片段大小一致(图1)。目的基因与T载体连接后,经测序证实与GenBank登录的人CDH12基因序列一致。
2.2 CDH12重组腺病毒表达载体的鉴定
测序正确的重组子pMD18T-CDH12经NheⅠ和XhoⅠ双酶切后,将CDH12亚克隆至腺病毒穿梭载体pShuttle-IRES-hrGFP-1,然后经Pme I线性化后转化BJ5183感受态菌,在BJ5183中与腺病毒骨架质粒pAdEasy-1发生同源重组,PacⅠ酶切鉴定获得正确的腺病毒质粒(图2),将其转化XL 10-Gold感受态菌大量扩增,腺病毒质粒pAd-CDH12及pAd0转染AD-293细胞后会发生CPE,荧光显微镜下可见绿色荧光蛋白(图3),说明CDH12基因重组腺病毒Ad-CDH12及空腺病毒Ad0包装成功。
2.3 Western blot鉴定N-cadherin的表达
Western blot检测结果显示,感染Ad-CDH12和Ad0的SACC-M细胞裂解物中均可见到140kDa左右的N-cadherin带。感染Ad-CDH12组表达水平比(N-cadherin/tubulin)明显高于感染空腺病毒载体的Ad0组,说明腺病毒载体能很好地表达CDH12蛋白。见图4。
2.4 CDH12对SACC-M细胞侵袭能力的影响
BioCoatTMMatrigelTMInvasion Chamber已经重建了基底膜胶,在聚碳酸脂膜表面形成类似天然基底膜的结构,细胞侵袭穿过重建基底膜胶的能力可反映该细胞的侵袭能力。Ad-CDH12/SACC-M组48h后穿过侵袭小室聚碳酸脂膜的细胞数(88.00±9.70)明显多于 Ad0/SACC-M 组(42.80±4.92)(P <0.01),说明Ad-CDH12/SACC-M细胞的侵袭能力明显增强。见图5。

3 讨论
钙黏素是钙离子依赖性的亲同性细胞黏附分子,主要参与正常组织结构的形成和维持,使细胞具有不同的黏附特性;也可作为信号受体,参与影响细胞的增殖和分化等生物学行为,而且可能在肿瘤形成、侵袭和转移过程中发挥着至关重要的作用。目前已经发现>110个钙黏素家族成员,其中包括经典钙黏素分子,如上皮型钙黏素(E-cadherin,由CDH1基因编码)、神经型钙黏素(N-cadherin,由CDH12基因编码)等。Zhang等[6]研究发现,E-cadherin在SACC中低表达,且其表达水平同SACC细胞的分化呈正相关。此外,Lai等[7]认为,E-cadherin 的表达同SACC的神经侵袭、局部复发和远处转移有关。本课题组前期构建了SACC转移能力不同的两个细胞株的基因表达谱[2],在此基础上筛选出可能与转移相关的cadherin家族基因,并在应用实时定量PCR技术检测涎腺腺样囊性癌高转移细胞株SACC-M与低转移细胞株SACC-2之间cadherin基因相对表达水平的差异时发现,CDH12基因在SACC-M中的表达水平明显高于SACC-2,免疫组化检测结果发现,CDH12在有转移的临床标本中的表达高于没有转移的标本[3]。提示CDH12基因可能在SACC的侵袭转移中起重要作用。在本研究中,我们通过构建CDH12基因重组腺病毒并感染SACC-M细胞使其过表达CDH12蛋白(N-cadherin分子),体外细胞侵袭实验显示,CDH12可以促进SACC细胞的体外侵袭能力。进一步证实了CDH12基因在SACC细胞中的异常表达影响其侵袭能力,CDH12可以促进SACC的侵袭能力,因此推测CDH12在SACC的恶性进展中可能起着重要的作用。
研究发现,N-cadherin可通过促进肿瘤细胞的迁移,在上皮性肿瘤的侵袭转移过程中起决定性作用,而且在乳腺癌、甲状腺癌、膀胱癌和前列腺癌中都检测到了N-cadherin的异常表达[1]。Islam 等[8]发现,上皮细胞不适当的表达N-cadherin会引起细胞间更多的分离,这是侵袭性肿瘤细胞的典型特征。此外,N-cadherin还可能通过与内皮细胞的相互作用来促进肿瘤的转移。研究发现,与对照组相比,经转染后表达N-cadherin的乳腺癌细胞MCF-7与人单层内皮细胞之间的黏附力明显增强[9]。另有研究发现,N-cadherin在促进黑色素瘤的发生中起着双重作用。正常黑色素细胞通过E-cadherin与角化细胞的相互作用调节其生长,当黑色素细胞在黑色素瘤演进过程中从表达E-cadherin转为表达N-cadherin时,解除了角化细胞对生长的控制,获得了同成纤维细胞和内皮细胞相互作用的能力,而这两种细胞均表达N-cadherin。黑色素瘤细胞同真皮成纤维细胞的相互作用可使其迁移出组织,同内皮细胞的相互作用则可使其进入循环系统[10,11]。
cadherin属于Ⅰ型细胞表面膜蛋白,其表达随着细胞生长、发育状态不同而改变,并且可以作为信号受体,影响细胞的增殖和分化等生物学行为,在细胞极性、分选和迁移方面均具有调节作用。研究发现,N-cadherin能够促进成纤维细胞生长因子(fibroblast growth factor,FGF)启动一种非生长因子依赖性的信号通路[12,13],也可以激活 FGF 受体依赖的信号通路[14]。而生长因子受体可以调节多种细胞行为,包括细胞的运动性和侵袭性[15]。研究还发现,N-cadherin也可能同肿瘤细胞其他受体酪氨酸激酶相互作用,例如一种称为钠氢交换子调节因子的小蛋白作为骨架把N-cadherin和β-catenin同血小板源性生长因子受体连接起来,这种蛋白质复合体定位于迁移的肿瘤细胞的前沿,可促进肿瘤细胞的运动[16]。结合本研究结果,我们认为,CDH12可能促进SACC细胞的体外侵袭能力,因此推测CDH12在SACC的恶性进展中可能起着相当重要的作用。但癌细胞的侵袭转移是一个复杂的过程,涉及到多种基因或信号的变化,CDH12基因可能不是唯一影响SACC侵袭和转移的重要因素,其影响SACC侵袭转移的具体机制仍有待于进一步深入研究。
[1]Gloushankova NA.Changes in regulation of cell-cell adhesion during tumor transformation[J].Biochem J,2008,73(7):742-750.
[2]Lu YG,Zhou HY,Ding LC,et al.Analysis of differential expression genes related to different metastasis potential of adenoid cystic carcinoma using restriction fragments differential display PCR[J].Chin J Med Genet,2006,23(5):505-510.
[3]佘林,丁林灿,王锦锋,等.钙黏素家族相关基因与涎腺腺样囊性癌转移的关系[J].福建医科大学学报,2010,44(3):182-185.
[4]何荣根,张晓珊,周晓建,等.涎腺腺样囊性癌ACC-2和ACC-3细胞系的建立及其形态学观察[J].华西口腔医学杂志,1988,6(1):1-3.
[5]关晓峰,邱蔚六,何荣根,等.肺高转移性涎腺腺样囊性癌细胞株的筛选[J].中华口腔医学杂志,1996,31(2):74-77.
[6]Zhang ZY,Wu YQ,Zhang WG,et al.The expression of E-cadherincatenin complex in adenoid cystic carcinoma of salivary glands[J].Chin J Dent Res,2000,3(3):36-39.
[7]Lai FY,Zhang Q,Wu QL,et al.Expression and significance of E-cadherin in adenoid cystic carcinoma of the salivary glands [J].Chin J Cancer,2007,26(9):1025-1028.
[8]Islam S,Carey T,Wolf GT,et al.Expression of N-cadherin by human squamous carcinoma cells induces a scattered fibroblastic phenotype with disrupted cell-cell adhesion [J].J Cell Biol,1996,135(6):1643-1654.
[9]Hazan RB,Phillips GR,Qiao RF,et al.Exogenous expression of N-cadherin in breast cancer cells induces cell migration,invasion,and metastasis[J].J Cell Biol,2000,148(4):779-790.
[10]Sandig M,Voura EB,Kalnins VI,et al.Role of cadherins in the transendothelial migration of melanoma cells in culture [J].Cell Motil Cytoskeleton,1997,38(4):351-364.
[11]Li G,Satyamoorthy K,Herlyn M.N-cadherin-mediated intercellular interactions promote survival and migration of melanoma cells[J].Cancer Res,2001,61(9):3819-3825.
[12]Doherty P,Williams G,Williams EJ.CAMs and axonal growth:a critical evaluation of the role of calcium and the MAPK cascade[J].Mol Cell Neurosci,2000,16(4):283-295.
[13]Skaper SD,Moore SE,Walsh,FS.Cell signalling cascades regulating neuronal growth-promoting and inhibitory cues[J].Prog Neurobiol,2001,65(6):593-608.
[14]Utton MA,Eickholt B,Howell FV,et al.Soluble N-cadherin stimulates fibroblast growth factor receptor dependent neurite outgrowth and N-cadherin and the fibroblast growth factor receptor co-cluster in cells[J].J Neurochem,2001,76(5):1421-1430.
[15]McKay MM,Morrison DK.Integrating signals from RTKs to ERK/MAPK[J].Oncogene,2007,26(22):3113-3121.
[16]Theisen CS,Wahl JK,Johnson KR,et al.NHERF links the N-cadherin/catenin complex to the platelet-derived growth factor receptor to modulate the actin cytoskeleton and regulate cell motility[J].Mol Biol Cell,2007,18(4):1220-1232.
(编辑王又冬,英文编辑郑华川)
Effect ofCDH12on the Invasive Ability of Salivary Adenoid Cystic Carcinoma Cells
WANG Jin-feng,SHE Lin,DING Lin-can,ZHENG Fei-fei,LU You-guang
(Department of Preventive Dentistry,Hospital of Stomatology,Fujian Medical University,Fuzhou 350002,China)
ObjectiveTo clarify the effect of geneCDH12on invasiveness of human salivary adenoid cystic carcinoma cells.MethodsCDH12cDNA was amplified by nested RT-PCR using the total RNA extracted from the highly metastatic human salivary adenoid cystic carcinoma cell line SACC-M.TheCDH12gene recombinant adenoviral expressing vector was constructed using AdEasyTMXL Adenoviral Vector System.SACC-M cells were infected with recombinant adenovirus and the expressed target proteins were examined by Western blot.Tumor invasion assay was performed to study the effect ofCDH12on invasiveness of SACC-M cells.ResultsTheCDH12gene recombinant and control adenoviral expressing vector were successfully constructed.The expression ofCDH12was significantly increased in Ad-CDH12/SACCM cells compared with that in Ad0/SACC-M cells.Compared with Ad0/SACC-M cells,the invasive ability of Ad-CDH12/SACC-M cells had been enhanced significantly.ConclusionCDH12could increase the invasion of salivary adenoid cystic carcinoma cells in vitro.CDH12might have an important role in the invasion and metastasis of salivary adenoid cystic carcinoma.
CDH12;adenovirus;adenoid cystic carcinoma;invasion
R781.7
A
0258-4646(2011)01-0033-05
福建省科技厅科技计划重点项目(2008Y0041)
王锦锋(1983-),男,医师,硕士.
卢友光,E-mail:fjlyg63@163.com
2010-06-30
book=1,ebook=173
