生殖细胞膜脂筏中精原糖脂质的分离纯化及初步鉴定
2011-11-15张彦龙
张彦龙
(东北林业大学野生动物资源学院动物医学系,哈尔滨 1 5 0 0 4 0)
在哺乳动物中生物体内,存在二种主要的硫酸化糖脂质,一种是大脑的神经鞘(sphingolipid)的硫酸盐半乳糖神经酰胺(sulfated galactosylceramide)也称之为硫酸糖脂质(galactosylsulfatide,SM4s;Sulfatide),在髓鞘(myelin sheath)中有较高的含量;另一种是存在于雄性生殖细胞的硫酸盐半乳糖烷基甘油酯(sulfated galactosylalkylacylglycerol),称之为是精原糖脂质(seminolipid,SM4g),精原糖脂质较高的表达在从精母细胞到精子细胞的各个阶段的生殖细胞。它们基本结构硫酸根是由前体PAPA(3′-phosphoadennosine 5′-phosphosufate),通过它们共同的转移酶—脑苷脂硫酸转移酶(cerebroside sulfotransferase,CST)催化下,在高尔基膜上将PAPA上的硫酸根转移到乳糖环的三位上,形成硫酸化的糖脂质[1,2]。
CST已成功的从人的肾癌细胞中精制,并且cDNA被克隆,CST基因突变鼠出现部分神经紊乱,生殖细胞在减数分裂前期停止分化而凋亡,导致雄性的不孕。Northern杂交证明在小鼠的肾脏、脑、睾丸、胃、小肠、肝脏、肺中发现了它的mRNA,通过精原干细胞移植技术,证明了在附睾中也有硫酸化糖脂质的存在,但结构和功能还有待解析[3~6]。在生殖细胞中糖脂质存在于生殖细胞的表面,精子细胞的精原糖脂质直接粘附在卵子的透明带上,由此可能与受精有关,但具体功能还不甚了解,在生殖细胞中详细的功能还有待探讨[3~7]。为进一步研究硫酸化糖脂质的生物学特性和功能,纯化硫酸化的糖脂质是开展此项研究前提条件之一。
脂筏(lipid-raft)又称膜的微小功能区(microdomain),这些微小功能区富集有鞘糖脂和胆固醇中,包括甘油磷酸肌醇(glycosylphosphatidylinositol,GPI),它们共同和所黏附的蛋白作为细胞膜的旁系结构组成部分的漂浮在细胞膜上的复合物,目前多项研究表明,具有蛋白的极性排列和细胞信号传导的功能[8~10]。作为硫酸化的精原糖脂质在生殖细胞中是否以脂筏形式存在,是本研究目标。
为此,我们从牛的睾丸中提取精原糖脂质,从小鼠的睾丸生殖细胞中提纯脂筏,通过检验证明精原糖脂质以脂筏形式存在于小鼠睾丸的生殖细胞膜中,这个结果对于今后进一步研究精原糖脂质及其相结合蛋白质的生物学特性必将起到一定的推动作用。
1 材料与方法
1.1 实验材料
牛的睾丸;氯仿;甲醇;蔗糖;orcinol;DEAESephadex A-25,Pharmacia Fine Chemicals(Piscataway,NJ);C57BL/6 小鼠;silica gel HP-K 板(10cm ×10 cm,250 μm ),Whatman Inc.(Clifton,NJ);Silica Gel 60 HPTLC plates(Merck);超速离心机(Beckman),转子(SW40Ti)。
1.2 精原糖脂质的提纯
睾丸组织的处理:将牛的睾丸去除外膜,用刀切碎,称取500 g,按10倍体积加入氯仿/甲醇=1/2混合液,在超生波中破碎组织并过夜搅拌,次日应用二层滤纸过滤除去杂质。
第一次DEAE-Sephadex A-25层析:离子交换柱先用甲醇洗涤一下,然后填充在甲醇中事先膨胀好的 DEAE-Sephadex A-25,总体积大约 110 cm3,应用氯仿/甲醇/水=30/60/8平衡 DEAE-Sephadex A-25,总体积为1 L;加入经滤纸过滤的牛睾丸样本,应用平衡液洗涤,体积为柱床体积的10倍以上。加入0.1 mil/L醋酸铵/甲醇,收集洗脱液,每个管50 ml。每个管取100 μl滴加到硅胶板上,应用orcinol硫酸染色液染色鉴定,将含有硫酸糖脂质的管收集到一起,得到粗提精原糖脂质。将样本粗体精原糖脂质在旋转蒸发仪中浓缩剩20 ml左右,加入200 ml去离子水,超声波中分散粗提物,将样本放入透析袋中除盐,在4℃下透析,并换3~4次去离子水;将经过透析的样本加入乙醇,在旋转蒸发浓缩直至干燥,得到粗提的精原糖脂质命名为Pre。
硅胶层析:硅胶悬浮在100%氯仿中,添加柱床上,并应用氯仿平衡层析柱硅胶.浓缩的样品溶解在氯仿中,经超声波10 min处理,然后低速离心,将上层液加入平衡好的硅胶柱中.应用氯仿1 L洗涤,然后应用500 ml的氯仿/甲醇=9/1混合液,除去非特异性的物质。洗脱精原糖脂质,应用1 500 ml的氯仿/甲醇=4/1洗脱,每管50 ml收集,每个管取100 μl,TLC检验,TLC展开液为氯仿/甲醇=4/1。将含有精原糖脂质的管收集,按上述方法浓缩直至干燥,之后溶解到氯仿/甲醇/水=30/60/8中。
第二次DEAE-Sephadex A-25层析:用氯仿/甲醇/水=30/60/8平衡 DEAE-Sephadex A-25的柱床中,加入溶解到氯仿/甲醇/水=30/60/8的样本,用平衡液按10倍柱床体积洗涤,再用5倍的甲醇洗涤。精原糖脂质洗脱,洗脱液为醋酸铵/甲醇,洗脱方法梯度洗脱 20 mil/L;40 mil/L;60 mil/L;80 mil/L;100 mil/L,每个管50 ml;每个管取100 μl除盐后,TLC检验,展开液为氯仿/甲醇=4/1,将含有精原糖脂质的管收集,按上述方法浓缩直至干燥。
逆向层析除盐:Sep-pak-C18和注射器连接,将浓缩的样本溶解在水/甲醇=1/1,经超声溶解制成悬液.Sep-pak-C18平衡液分别为氯仿/甲醇=2/1,用量7 ml;甲醇 7 ml;水 30~50 ml.将样本加入柱床中;用大于10 ml的水洗涤.洗脱液分别应用甲醇3 ml;氯仿/甲醇=2/1用量6 ml,将洗脱液收集到一起,应用氮气吹干样本,经TLC检验样本纯度。
1.3 生殖细胞的制备
小鼠生殖细胞的制备100个生后60 d的小鼠睾丸无菌采集,按着精原干细胞的制备方法[2],剥离睾丸去除睾丸被膜,取精细管PBS冲洗3次,置于32℃水浴摇床中,在0.25%/PBS胰蛋白酶消化20~30 min;DMEM冲洗,加入1 mg/ml胶原酶和200~500 μg/ml DNA酶作用20~30 min;吸管吹打使细胞分散,过55~77 μm尼龙筛滤过细胞,低速离心收集细胞,并用DMEM冲洗重悬,调整细胞浓度为105~106/ml,将细胞放于75 cm2细胞培养瓶中培养,培养液为DMEM加10%FBS,培养条件为32℃。由于体细胞易贴壁生长,约6~7 h后晃动培养瓶收集半悬浮细胞,即可获得高浓度生殖细胞,离心回收细胞,用PBS洗涤3次备用。
1.4 生殖细胞脂筏的制备
制备方法按着脂筏不溶于去垢剂的原理和方法[13],在离心回收的生殖细胞中加入水解缓冲液(25 mMTris-HCI;PH7.5/0.15M NaCl,包 括 1%TritonX-100,1 mmol/L phenylmethylsulfonyl fluoride,1 mmol/L Na3Vo4,10 Trypsin inhibitor units/ml aprotinin5),在冰上应用Teflon匀浆器反复匀浆细胞上下40~50次,然后将匀浆好的细胞加入蔗糖,调节蔗糖最终浓度40%,加入Beckman SW40Ti转子的离心管中,每个离心管4 ml,之后加入30%、5%的蔗糖两个梯度,每个梯度在4 ml,在4℃下39 000 r/min离心18 h。30%、5%蔗糖溶解液为细胞水解缓冲液。
1.5 脂筏的回收
将在离心管中不溶性的条带分别回收放入1.5 ml的小管中,15 000 r/min离心15 min,再用PBS洗涤3次,最后沉淀物溶解到氯仿/甲醇/水=10/20/1,经震荡后在15 000 r/min下离心15 min,沉淀用于SDS-PAGE蛋白电泳鉴定,上清液在真空离心机蒸干后,经Sep-pak-C18除盐,浓缩后应用TLC鉴定。
2 结果
2.1 牛睾丸中精原糖脂质提纯及鉴定
我们利用DEAE-Sephadex A-25和硅胶交替层析,从牛的睾丸提纯出高纯度的精原糖脂质。在第一次应用DEAE-Sephadex A-25提纯,我们获得了粗提的精原糖脂质,在经硅胶层析厚,我们收集层析样本,每个管 50 ml,每个管中提取 100 μl,经浓缩后,在硅胶板上薄层层析展开,如图1A中所示Pre代表第一次经DEAE-Sephadex A-25粗提样本,13-20表示是经硅胶颗粒层析后,每个样本收集50 ml洗脱液,取100 μl经TLC展开后,在orcinol硫酸染色的结果,从第13-20管有精原糖脂质。在经第2次DEAE-Sephadex A-25离子交换层析,按着不同浓度的硫酸铵洗涤,我们发现,在60 mmol/L醋酸铵/甲醇洗脱下,在4~8管有精原糖脂质的存在,并且经Sep-pak-C18逆向层析除盐后,我们点样 5、10 μl后鉴定提纯精原糖脂质的纯度,表明获得较高纯度的精原糖脂质,如图3C所示。
2.2 脂筏的提纯及鉴定
按着制备精原干细胞的方法,制备生殖细胞悬液,这里包括精子形成过程中的各个阶段的生殖细胞,在裂解液存在的下,应用匀浆机裂解生殖细胞,将其加入蔗糖梯度的最底层,蔗糖最终浓度在40%,经18 h超速离心后,我们可以看到两条白色的带,如图2A所示,上层带在5%和30%之间;下层带在30%和40之间.回收两条带后,用有机溶剂分离脂筏,脂类部分经浓缩除盐后薄层层析鉴定,并和从牛睾丸中提纯的精原糖脂质比较,如图2B所示,得到和提纯精原糖脂质分子量大小相等的两条带,上面的带含有较多的精原糖脂质,下面的含量比较少。同时被分离的蛋白在12%浓度的SDS-PAGE电泳,经银染色证明有蛋白存在,由此说明,精原糖脂质和某种蛋白相结合,以脂筏的形式存在于睾丸的生殖细胞中。
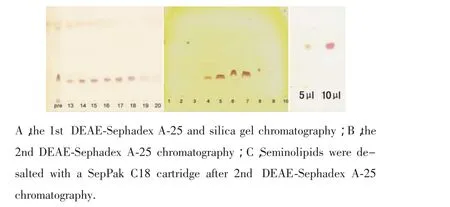
图1 D E A E-S e p h a d e x A-2 5和硅胶层析提纯牛睾丸中的精原糖脂质,经薄层层析(T L C)o r c i n o l硫酸染色的结果F i g.1 P u r i f i c a t i o n o f b o v i n e t e s t i c u l a r s e mi n o l i p i d

图2 从雄性生殖细胞中经蔗糖梯度离心提纯的脂筏及其鉴定结果F i g.2 P u r i f i c a t i o na n di d e n t i f i c a t i o no f s e mi n o l i p i di nt h el i p i dr a f t o f t h e s p e r ma t o g e n i c c e l l me mb r a n e s
3 讨论
关于从牛睾丸中提纯精原糖脂质,我们参考Juan G的方法并略作改进[11],应用DEAE-Sephadex A-25离子交换和硅胶颗粒层析相结合,并且应用逆向层析除盐,经薄层层析(TLC)鉴定,获得高纯的精原糖脂质.在提纯过程中也发现,按着文献[11]所报道,在第一次离子交换后,粗提的精原糖脂质在加10%甲醇的氯仿中溶解后,硅胶不能很好的吸附住精原糖脂质,(数据没有展示),所以应用纯氯仿溶解精原糖脂质,得到较好的吸附效果;在第二次离子交换层析过程中,我们逐级增加醋酸铵的浓度,每个浓度洗脱液在300 ml,最终在60 mmol/L,洗脱出高纯的精原糖脂质.经TLC检验及单克隆抗体染色(结果没有展示)验证提纯的为精原糖脂质。
精原糖脂质在哺乳动物的生殖细胞中占总糖脂的90%以上,缺少精原糖脂质导致雄性的不孕[3];在受精中过程中,在精子细胞膜上以脂筏形式起着粘结作用[12,13]。但是还有许多不明之处,如在生殖细胞分化过程中功能及细胞信号如何传导,形成微小功能区所黏附蛋白分子有哪些,所以我们利用脂筏在去污剂不溶的特性,经蔗糖梯度离心,提纯出脂筏,从蔗糖梯度离心结果可知,发现有两条带在不同浓度的蔗糖中,上层条带的蛋白要多于下面的条带,可以预测精原糖脂质在生殖细胞分化的不同时期有着不同的作用和功能,并黏附不同的蛋白分子.我们期待这些发现能够解明精原糖脂质所连接蛋白质的生物学功能。
事先的研究已经知道精原糖脂质本质上为生殖细胞所必需[2]。脂筏与膜的信号转导、蛋白质分选均有密切的关系[8]。我们这次从生殖细胞中提存了脂筏,并证明了精原糖脂质包括在脂筏中,由此推测精原糖脂质在生殖细胞细胞膜内,作为一个为受体信号传导和运输的功能性平台,并且作为脂筏的组成部分而发挥关键作用.下面的工作就是必须解明精原糖脂质及其所结合的蛋白分子在生殖细胞膜上的分子生物学机制,这部分工作也已经开展,应用提纯的脂筏制备出单克隆抗体,希望通过此研究方法能够鉴定出硫酸化糖脂质所黏附的蛋白分子。
精原糖脂质在哺乳动物中除上述的生殖细胞一些生物学特性外,最近的研究表明,抗硫酸糖脂质的单克隆抗体能封闭IAV[influenza A/WSN/33(H1N1)virus]和硫酸糖脂质的结合,结果导致在核内病毒的核蛋白蓄积而影响到IAV病毒的复制,保护小鼠对流感病毒的致死性[13]。由于无论是硫酸糖脂质还是精原糖脂质有共同的抗原结构,所以提纯精原糖脂质,将来可用于制备单克隆抗体之用,虽然糖脂质缺少免疫原性,这个问题最近已经通过制备突变鼠得到解决,应用提纯的精原糖脂质免疫CST突变鼠,较容易的获得单克隆抗体,并通过实验研究得到证实[1]。
总之,硫酸化的糖脂质在生物体内的功能还有许多不明之处,通过对其脂筏的研究可进一步帮助我们解决硫酸化糖脂质的一些生物学功能,也对于研究其他脂质所形成脂筏的生物学功能研究起到推动作用。
[1]Cheng X,Zhang Y,Kotani N,et al.Production of a recombinant single-chain variable-fragment (scFv)antibody against sulfoglycolipid[J].J Biochem(Tokyo),2005,137(3):415-421.
[2]Popovic ZV,Sandhoff R,Sijmonsma TP,et al.Sulfated glycosphingolipid as mediator of phagocytosis:SM4s enhances apoptotic cell clearance and modulates macrophage activity[J].J Immunol,2007,179(10):6770-6782.
[3]Zhang Y,Hayashi Y,Cheng X,et al.Testis-specific sulfoglycolipid,seminolipid,is essential for germ cell function in spermatogenesis.Glycobiology[J].2005,15(6):649-654.
[4]Hirahara Y,Tsuda M,Wada Y,et al.cDNA cloning,genomic cloning,and tissue-specific regulation of mouse cerebroside sulfotransferase[J].Eur J Biochem,2000,267(7):1909-1917.
[5]Honke K,Hirahara Y,Dupree J,et al.Taniguchi N.Paranodal junction formation and spermatogenesis require sulfoglycolipids[J].Proc Natl Acad Sci USA,2002,99(7):4227-4232.
[6]Honke K,Tsuda M,Hirahara Y,et al.Cancer-associated expression of glycolipid sulfotransferase gene in human renal cell carcinoma cells[J].Cancer Res,1998,58(17):3800-3805.
[7]Franchini L,Panza L,Kongmanas K,et al.An efficient and convenient synthesis of deuterium-labelled seminolipid isotopomers and their ESI-MS characterization[J].Chem Phys Lipids,2008,152(2):78-85.
[8]Simons K,Ikonen E.Functional rafts in cell membranes[J].Nature,1997,387(6633):569-572.
[9]Brown,DA,London,E.Functions of lipid rafts in biological membranes[J].Annu Rev Cell Dev Biol,1998,14:111-136.
[10]Katagiri YU,Ohmi K,Katagiri C,et al.Prominent immunogenicity of monosialosyl galactosylgloboside,carrying a stage-specific embryonic antigen-4 (SSEA-4)epitope in the ACHN human renal tubular cell line-a simple method for producing monoclonal antibodies against detergent-insoluble microdomains/raft[J].Glycoconj J,2001,18(4):347-353.
[11]Juan G,Alvarez,Bayard T.Storey,Mark L.Hemling,et al.Hig hresolution proton nuclear magnetic resonance characterization of seminolipid from bovine spermatozoa[J].Lipid Res,31,1990,31(6):1073-1081.
[12]Wattana Weerachatyanukul,Ira Probodh,Kessiri Kongmanas,et al.Visualizing the localization of sulfoglycolipids in lipid raft domains in model membranes and sperm membrane extracts[J].Biochimica et Biophysica Acta,2007,1768:299-310.
[13]Takahashi T,Murakami K,Nagakura M,et al.Sulfatide is required for efficient replication of influenza A virus[J].J Virol,2008,1768(2):299-310.
