利用硫化亚铁做还原剂处理废旧干电池制取硫酸锰的研究
2011-01-29段雪梅巢文军
段雪梅,巢文军
(常州市环境监测中心站,江苏常州213001)
干电池为一次性电源,给人们的日常生活带来了许多便利,但电池中含有汞、镉、铅、锌、铜、锰等有毒重金属物质[1-4],属于污染物质。使用后废旧电池的随意丢弃,会给环境造成严重污染,其中的重金属离子会污染地下水及土壤,而且通过食物链进入人体使人致病,同时造成资源的浪费。近年来,随着人们环保意识的加强,对废旧电池的无害化处理及综合利用逐渐引起人们的重视[4-7]。特别是针对废旧锌锰干电池中锌和锰的回收,开展了较多的研究工作。孔祥平[8]测定了废旧碱性锌锰干电池的组成,探索了焙烧碳粉在硝酸、双氧水体系中的酸解行为,分析了硝酸用量、双氧水用量、反应温度和反应时间对碳粉中金属锌和锰浸取率的影响,并通过滴加碳酸钠,高温分解碳酸锰粉末制备二氧化锰。得出焙烧碳粉为5.40 g,20 mL HNO3(1∶1),40 mL H2O2(3%),60℃下反应1 h,锌的浸取率可达91.7%,锰的浸取率可达98.3%。而高玉华[9]将锌锰干电池经过剥离后碳包中内含物焙烧,(温度为750℃,焙烧时间为1 h)再用硫酸(1∶1)浸取,滤液采用沉淀法分离锌和锰。锌和锰的回收率分别为94.5%和93.6%。本文在实验室条件下探讨了利用硫化亚铁作为还原剂、硫酸溶液作为浸提剂处理废旧电池制取硫酸锰的工艺可行性进行了研究,并对反应过程中影响硫酸锰产量的各种因素进行了探讨和归纳,以期为回收利用废旧碱性锌锰电池中锰提供一定理论依据。
1 试验原理及方法
1.1 实验原理
目前,广泛使用的锌-锰不可充干电池,主要有酸性及碱性两类,负极为锌皮,正极碳包的主要组成为:碳棒、氧化锰、碳粉、乙炔黑、氯化铵、氯化锌、电糊、沥青及少量的铅、镉、汞。对废旧电池处理,一般倾向于先应回收利用,然后再采用还原剂处理,消除污染。基于锌、二氧化锰等可溶于酸溶液中,使锌-锰干电池中的锌、二氧化锰与硫酸作用生成可溶性盐溶液,再对其进行蒸发结晶,得到具有回收价值的产品,即硫酸锰,其次是硫酸锌、氯化铵。实验中可选用的还原剂较多,如硫化亚铁、铁粉、硫酸亚铁等。
铁粉、硫化亚铁分别作为还原剂时,对碳包中的重金属离子及二氧化锰还原的反应方程式为:

硫酸锌的浸出反应式为:
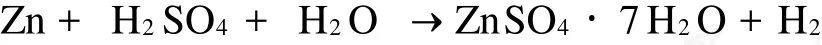
1.2 实验方法
将废旧锌锰干电池,简单地机械剖开,人工分离各种物质,并作相应塑料盖、铁壳、碳棒和铜帽回收处理。收集电池中的黑色填充物,称取约5.0 g干燥黑粉放入100 mL烧杯中,加入硫酸15 mL(体积比1:5)溶液,置于70℃恒温水浴锅中加热,分批加入还原剂,不断搅拌,加热至浸出反应充分完成。过滤分离,收集滤液,因滤渣主要是碳粉、乙炔黑等物质,由于条件所限滤渣丢弃。因反应中可能有Fe3+等混入滤液中,此外酸量也有可能过量而影响到硫酸锰的质量。为消除这些因素的干扰,所以考虑滤液需中和及净化,可用少许CaCO3调节p H值到5左右,并放入水浴锅中维持10 min左右,使其充分反应,然后抽滤,收集滤液加热浓缩并结晶,得到粉红色晶体即产物硫酸锰(MnSO4·nH2O)。
2 结果与讨论
考虑到反应时间、温度、酸量以及还原剂量等均会影响到反应制备的硫酸锰产量,实验就上述各因素的影响予以探讨。
2.1 时间的影响
为探索试验实验条件下制备硫酸锰最佳反应时间,以1 h为间隔,分别取反应时间为1 h,2 h,3 h, 4 h,5 h和6 h,实验结果见图1。
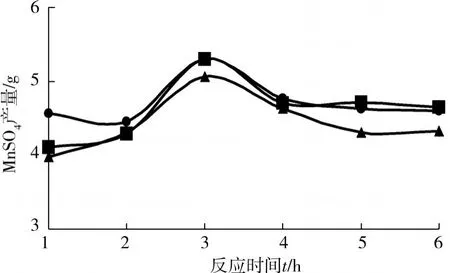
图1 反应时间对硫酸锰制备产量的影响
由图1可以看出硫酸锰的产量随时间的增加其产量显著增加,在3 h左右时硫酸锰产量达到最高,随之其产量又迅速下降,在4~6 h之间维持在一个较为平衡的状态。一般来说反应产物的量会随着时间的增长而增加,在3 h之前,由于反应物质之间反应不完全,所以产量小于反应3 h的产量。在5~6 h之间,理论上来讲,产量应与3 h的相接近。但由图1中可以看出:在5~6 h之间硫酸锰产量却有所下降。分析产生这种现象的主要原因可能是,由于反应温度为70℃,温度较高且反应时间过长,导致反应物过多失水而呈粘稠状,过滤时有部分硫酸锰滞留在碳粉中,从而硫酸锰产量有所下降。因此在制取硫酸锰的时候,反应时间不能过长以免出现干结现象,从而影响产量。
2.2 温度的影响
温度的升高,反应物分子的能量增加,大量的非活化分子获得能量后转变成活化分子,系统中活化分子百分数大大增加[10]。有效碰撞次数增多。因而,反应速率明显加快。则相对于同一反应时间,不同反应温度来说,温度越高,反应速率越快,其反应产物也相应较多。为进一步了解温度对硫酸锰的产量的影响,实验分别选取30℃,50℃,70℃和90℃对硫酸锰的产量结果进行了试验。结果见图2。
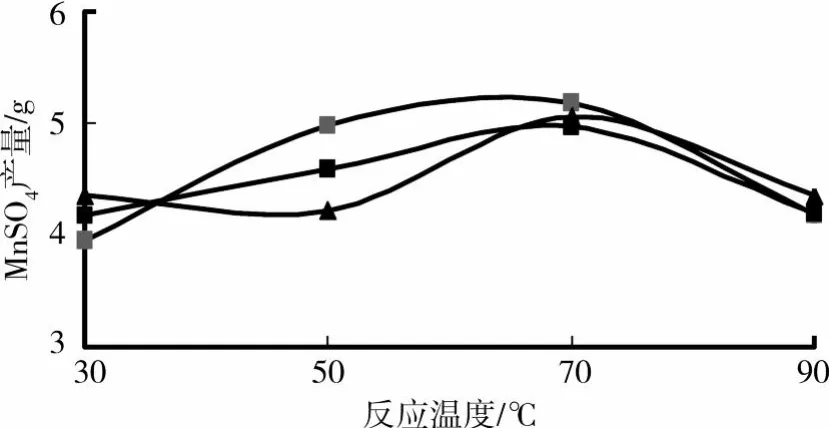
图2 反应温度对硫酸锰制备产量的影响
由图2可以看出,硫酸锰的产量呈现先随温度的升高而增加,后其产量逐步降低的现象,其中在70℃左右的硫酸锰产量最高。显然硫酸锰的产量和温度之间并不存在单纯的正比现象。分析原因当反应温度过高时,水分挥发,分子之间的有效碰撞次数相对减少,导致反应产物硫酸锰的产量也随之减少(在实验中也观察到30℃,50℃,70℃下的反应产物为稍粘稠状液体,而90℃下的反应物为干结块状。)
2.3 硫酸用量的影响
试验考察了硫酸用量对硫酸锰的产量的影响,硫酸用量分别为13mL,15mL,17mL,19mL(采用的是1:5的硫酸),结果见图3。
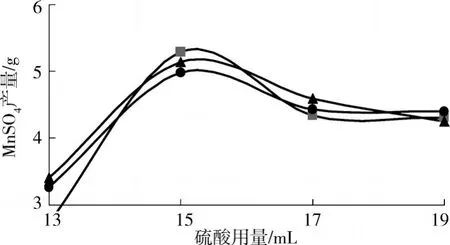
图3 硫酸用量对硫酸锰制备产量的影响
从反应原理来讲,硫酸锰产量应该随着硫酸用量的增加而增加。因为电池中的二氧化锰能够溶解于硫酸中,并形成Mn2+,硫酸越多,二氧化锰溶解得越充分,则硫酸锰产量越高。但实验结果却并非如此,从图3可以看出,当硫酸用量为15 mL时,硫酸锰产量最多,其他用量下相对较低。在实验中观察到当硫酸用量为17 mL,19 mL时,此时,制备的硫酸锰的颜色微微发黄,经用NaOH检验后,表明该情况下制得硫酸锰中含有一定量的硫酸铁。所以,在一定量的碳粉中制取硫酸锰,有一个最佳硫酸量。硫酸过少,反应不完全;硫酸过多,反应物之间比例不平衡,不仅降低硫酸锰产量并导致产物不纯。
2.4 硫化亚铁用量制备硫酸锰的影响
随着硫化亚铁用量的增加,硫酸锰的浸出率将有所提高。但是本实验并非如此,而是对于硫化亚铁有一个最佳投料量。在该实验中,相对于5.0 g的碳粉,我们分别选取0.6 g,0.8 g,1.0 g,1.2 g, 1.4 g,1.6 g的硫化亚铁进行比较,其他条件如图4所示。经实验得出硫化亚铁的最佳投料量为0.8 g (见图4)。这是因为硫化亚铁用量过少,还原剂不足,硫酸锰的浸出回收率就不高;反之,还原剂过多,则浸出液中残存大量 S2-,就容易与 Mn2+生成MnS沉淀。从而使滤液中的Mn2+降低,浓缩结晶得到的硫酸锰的产量降低。
3 结论
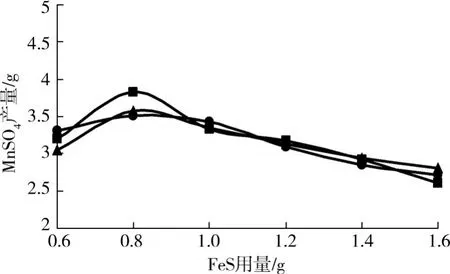
图4 FeS用量对硫酸锰制备产量的影响
(1)以硫化亚铁为还原剂制取硫酸锰的最佳反应条件:硫酸用量为15 mL,反应温度70℃,硫化亚铁的用量为0.8 g和反应时间3 h时,硫酸锰的产率可达80%以上。
(2)以硫化亚铁为还原剂制取硫酸锰的,硫酸锰产值较高,且其工艺简单,操作可行。因实验所得硫酸锰(Ⅱ)可形成粉红色的各种水合晶体,如MnSO4·4H2O。加热时可脱水成为白色无水硫酸锰(Ⅱ)。硫酸锰(Ⅱ)是最稳定的锰(Ⅱ)盐。其用途广泛:在农业上是重要的微量元素肥料之一;是植物合成叶绿素的催化剂,可促进作物长势,增加收获量;它还是畜牧业和饲养业的饲料添加剂;在工业上广泛应用于医药、油漆、造纸、陶瓷、印染、催化剂、矿石浮选、电解锰及其他锰盐生产①硫酸锰在食品中的用途.http://bbs.foodmate.net/thread-105143-1-1.html,2007-03-14。从废旧电池中制取硫酸锰既可减少污染,又可变废为宝取得良好的经济效益。
[1] 王金良,王 琪.再谈废电池的污染及防治[J].电池工业, 2002,7(1):3-8.
[2] 杨淑华郭笃发.浅议废旧电池的危害与我国回收现状[J].山东师范大学学报:自然科学版,2004,19(1):55-59.
[3] 牛冬杰,聂永丰.中国废电池管理对策分析[J].城市环境与城市生态,2000,13(1):48-50.
[4] 张胜涛,王 林,韩涟漪,等.废弃电池的危害及其回收利用[J].电池工业,2002,7(1):3-8.
[5] 蓝嗣国.废旧干电池的几种综合利用方法[J].环境科学动态, 2000(4):30-34.
[6] 杨家玲.从工业废物中回收重金属[J].化工环保,1997,17: 218-220.
[7] 韩东梅南俊民.废旧电池的回收利用[J].电源技术,2005,29 (2):128-131.
[8] 孔祥平.废旧锌锰干电池中锰的回收条件研究[J].应用化工, 2009,38(7):990-993.
[9] 高玉华.从废旧锌锰电池中回收锌和锰的工艺研究[J].有色金属再生与利用,2006,7:19-20.
[10] 陈静,李健美.活化能与温度关系图的计算机辅助释疑[J].化学研究,2000,11(3):55-57.
