液相色谱-串联质谱法测定马饲料中的抗凝血类药物
2011-01-29张亦农
高 照,张亦农
(国家体育总局中国反兴奋剂中心,北京 100029)
抗凝血药物是国际马术联合会(International Equestrian Federation,FEI)禁用药物名录中的一类药物[1],由于香豆素类及茚酮类抗凝血药物具有生物活性且广泛存在于天然产物中,近年来有关该类物质的临床应用和毒性引起了人们的普遍关注。欧洲食品安全局在对动物肝中毒实验的非显著性不良效应水平研究基础上,规定了人每日可承受的最大摄入量为0.07 mg/kg[2]。目前针对该类药物主要采用液相色谱法进行药物毒理和体内代谢方面的研究,对几种药物,尤其是双香豆素和苯茚二酮类的液相色谱-质谱(LC-MS/MS)测定方法的研究较少[3-4]。HPLC-MS/MS法灵敏度高、专属性和特异性好,是近年来兴奋剂检测方法主要的发展方向[5]。本实验通过固相萃取净化等手段纯化和富集样品,运用HPLC-MS/MS进行快速分析和筛查,并对该类化合物的电喷雾离子化裂解途径进行归纳,建立能够同时快速筛查和定量测定饲料中该类药物的方法。
1 试验部分
1.1 主要仪器与装置
Agilent 6410LC-MS/MS系统(1200binary快速液相,6410/2k-A三重四极杆质谱仪):美国Agilent公司产品;高速冷冻离心机:美国Sigma公司产品;涡旋振荡器:Scientific Industry公司产品;固相萃取装置:美国 Waters公司产品;Milli-Q纯水系统:美国Millipore公司产品。
双香豆素(dicoumarin)和雌三醇(IS):购自中国药品生物制品检定所;醋硝香豆素(acenocoumarin)、苯茚二酮(phenidione)、苄丙酮香豆素(warfarin)、香豆素(coumarin):均购自上海安谱科学仪器有限公司。双香豆素使用氯仿溶解,其他标准品使用甲醇溶解,各配制1g/L标准储备液,分别用甲醇稀释标准储备液制备系列标准工作液。甲醇、乙腈、乙酸乙酯(色谱纯):均购自沃凯公司;氯仿、高氯酸(分析纯):购自北京试剂公司;乙酸胺(色谱纯):购自Baker公司;MCX固相萃取柱(150mg):美国 Waters公司产品。
1.2 仪器实验条件
1.2.1 色谱及质谱条件 色谱柱:Zorbax SB C18柱(2.1mm×100mm×3.5μm);柱温30℃;流速2.5mL/min;流动相 A:10mmol/L乙酸铵水溶液;流动相B:乙腈溶液;干燥气温度320℃;干燥气流速12L/min;雾化器压力2.794×105Pa;毛细管电压:3 500V(+)/3 000V(-);流动相梯度为:0~2min、20%B,2~10 min、20~28%B,10~10.01min、28%~90%B;10.01~15min,90%B;Post run:6min;进样量10μL。5种药物及内标MRM优化的采集参数列于表1。

表1 MRM检测模式下5种药物优化的质谱条件Table 1 The optimized conditions of MRM detection for five anticoagulants
1.2.2 样品预处理 精确称量(1.00±0.02)g经粉碎的饲料于50mL具塞离心管中,加入100 μL 1μg/L雌三醇内标,静置1h后准确加入4.0mL甲醇,涡旋振荡2min后超声20min,然后以9 000r/min冷冻(-4℃下)离心10min,吸取上清液于另一50mL离心管中,再向残渣中加入16mL 0.02mol/mL NaOH 溶液,涡旋振荡5min后,相同条件下冷冻离心,合并2次提取溶液后加入40μL高氯酸溶液调节pH 4,涡旋振荡2min后以4 000r/min离心5min。上清液通过Oasis MCX(150mg/6mL)萃取小柱(依次用6mL甲醇、6mL水活化)净化,离心管底层白色胶状蛋白沉淀用1mL甲醇、5mL水洗涤后,离心后一同过柱。5mL 15%甲醇水淋洗后,20mm Hg负压下抽干3min,用5mL V(氯仿)∶V(异丙醇)=5∶1的混合溶液洗脱。收集洗脱液于50℃下氮气吹干,用400μL V(甲醇)∶V(水)=1∶1的混合溶液溶解后检测。5种物质定量下限及内标提取离子色谱图示于图1。

图1 5种物质定量下限及内标的提取离子色谱图Fig.1 The extracted ion chromatography of all drugs at the level of lower limit of quantification
2 结果与讨论
2.1 质谱色谱条件优化及稀释溶剂的选择
实验选用Zorbax SB C18色谱柱(2.1mm×100mm×3.5μm),5种药物有较好的灵敏度和分离度,且相互间无明显干扰。根据香豆素类药物及茚二酮类药物的理化性质和结构特征,分别在正负模式下考察了5种药物的质谱响应,结果发现香豆素在正离子模式下一级全扫描均有较好的响应,主要为准子离子峰[M+H]+,另外有较弱的[M+Na]+峰。其余的药物均为在负离子模式下有较好的响应,主要为准分子离子峰[M-H]-。选择性质较为相似的雌激素雌三醇[6]作为内标。通过对不同碰撞能量下主要碎片离子的分析,对5种药物的裂解途径进行解析,所选择的主要离子与其结构特征相符,保证了该类物质定性分析的准确性。每个待测物选取两对丰度较大、基质干扰小的离子对作为定量离子对和辅助定性离子对,采集分为5段,分别采用正负切换的离子扫描模式,各时间段内通过优化驻留时间保证定性定量的准确度,使待测物选择离子色谱峰上采集点不少于20个。实验比较了甲醇,甲醇水溶液(V(甲醇)∶V(水)=1∶1),乙腈水溶液(V(乙腈)∶V(水)=1∶1)作为复溶溶剂进样,结果表明,用甲醇水溶液(V(甲醇)∶V(水)=1∶1)定容后,上样各药物峰型较好且响应良好。
2.2 样品预处理方法的优化
目前针对几类药物的提取方法多采用加入酸性缓冲液后,用乙酸乙酯、氯仿等有机溶剂液液萃取[7-11]后浓缩进样,但赛马饲料为植物性复合饲料,基质较为复杂[12],故选择固相萃取提取净化。有文献报道Yu[13-14]等用反相混合型阳离子交换固相萃取柱对沉淀蛋白后赛马血液中的违禁药物进行了提取净化,以V(二氯甲烷)∶V(乙酸乙酯)=4∶1的混合溶液洗脱中性和酸性药物,以含2%浓氨水的V(乙酸乙酯)∶V(二氯甲烷)∶V(异丙醇)=5∶4∶1的混合溶液洗脱碱性药物,结果有较好的灵敏度和重现性。基于化合物的性质(香豆素类药物极微溶于醇和醚试剂,略溶于氯仿,而香豆素及茚二酮类在碱性溶液中易溶),实验了渗透组织能力较好的甲醇浸润和沉淀蛋白后用0.02mol/LNaOH溶液提取5种药物后,提取上清液经阴离子交换混装柱Oasis MAX净化后,以2%甲酸乙腈溶液洗脱,结果表明,净化后双香豆素和苄丙酮香豆素的回收率均较低且波动较大,这可能是由于香豆素类物质在碱性环境下过柱时间较长发生不可逆开环,部分待测物降解造成的。在相同条件下提取上清液,用HClO4调pH值至弱酸性后,分别通过阳离子交换混装柱Oasis MCX及Oasis HLB萃取柱净化,结果显示固相萃取柱HLB净化后基质干扰较多;MCX萃取柱净化后用V(氯仿)∶V(异丙醇)=5∶1溶液洗脱,5种药物的回收率及重现性较好,空白提取样品中相同时间不出现与标准物质提取离子峰干扰的杂质峰,净化专属性较强,且省去了有机试剂提取液过萃取柱净化前的浓缩过程,故采用MCX萃取柱净化,具体见1.2.2样品预处理。
2.3 定量方法的建立
2.3.1 标准工作曲线及检出限 准确称量6份(1.00±0.02)g空白饲料于50mL具塞离心管中,加入100μL 1mg/L内标试剂雌三醇试剂后,分别添加系列标准工作液制备醋硝香豆素,香豆素的质量浓度分别为10、20、40、100、200、500ng/g;苄丙酮香豆素,双香豆素的质量浓度为20、40、80、200、500、800ng/g;苯茚二酮的质量浓度为40、80、200、400、800、1 000ng/g的基质加标样品。静置1h后按1.2.2项进行批处理,以饲料样品中添加待测物浓度为横坐标,待测物与内标物的提取定量离子色谱峰面积比值为纵坐标进行回归运算得到标准工作曲线,列于表2。制备系列质量浓度空白加标样品经预处理后连续进样,为保证定性定量的准确性,以不低于10倍信噪比(S/N≥10)对应的基质添加浓度作为方法的检出限,以不低于20倍信噪比(S/N≥20)对应的基质添加浓度作为方法的定量限,最终确定苯茚二酮的检出限为15ng/g,定量限为40ng/g;香豆素和醋硝香豆素的检出限为4ng/g,定量限为10ng/g;华法林和双香豆素的检出限为10ng/g,定量限为20ng/g;5种物质定量下限及内标物提取离子色谱图示于图1。
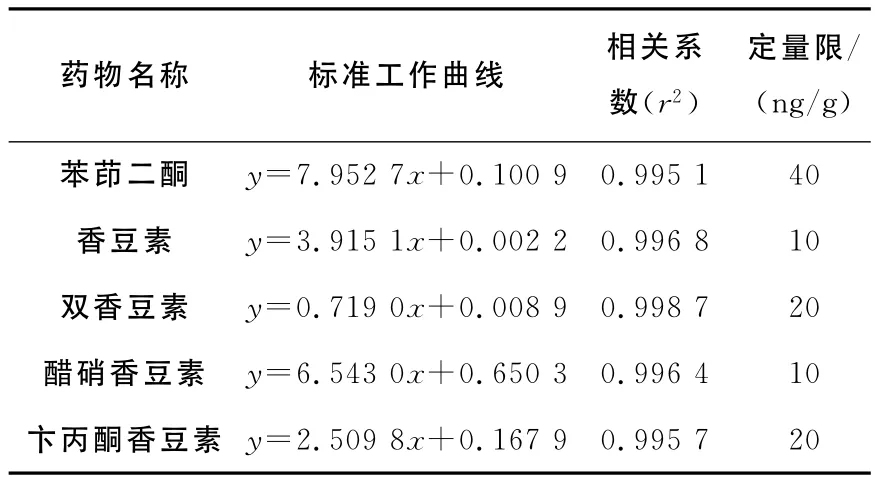
表2 5种药物的工作曲线,相关系数和定量下限Table 2 Linear range,correlation coefficient of calibration curves and LOQ of five drugs
2.3.2 方法的回收率,精密度及准确度 制备5种药物的低、中、高3个浓度的空白基质加标样品,每一浓度进行5样本分析,以当日随行标准曲线计算QC样品的浓度,同时另取空白饲料(1.00±0.02)g,除不加内标溶液外,按1.2.2项的方法制备上清液,向固相萃取柱洗脱溶剂中加入等体积的内标溶液和相应浓度的标准溶液混合后,50℃下氮气挥干,残渣用400μL V(甲醇)∶V(水)=1∶1的混合溶液溶解后进样分析,获得相应峰面积(每个浓度5份样品测定的平均值)。以每一浓度下两份基质加标质量浓度相同的样品待测物与内标峰面积比值计算相对回收率,结果列于表3。连续5天对相同的空白饲料低、中、高3个浓度加标样品进行批处理,计算方法的日内日间精密度和准确度。结果表明,本方法测定马饲料中5类抗凝血药物的日内精密度、日间精密度和准确度良好,可以满足检测的要求,结果列于表4。
2.4 质谱谱图解析
5种药物的主要碎片碎裂途径的推测示于图2~6。
双香豆素的主要碎片离子为m/z 161.1的负离子,将碎裂能量加大至40eV得到较强的脱掉中性碎片CO后的m/z 117.0负离子。苯茚二酮的结构中有2个羰基,分别失掉一个CO分子后得到m/z193.1和m/z164.9的负离子,加大碎裂能量到35eV时得到m/z 145.0的负离子,进一步加大碎裂能量到40eV以上时得到m/z117.0的负离子,推断分别为失掉C6H4中性分子和进一步失掉CO后得到的碎片离子。
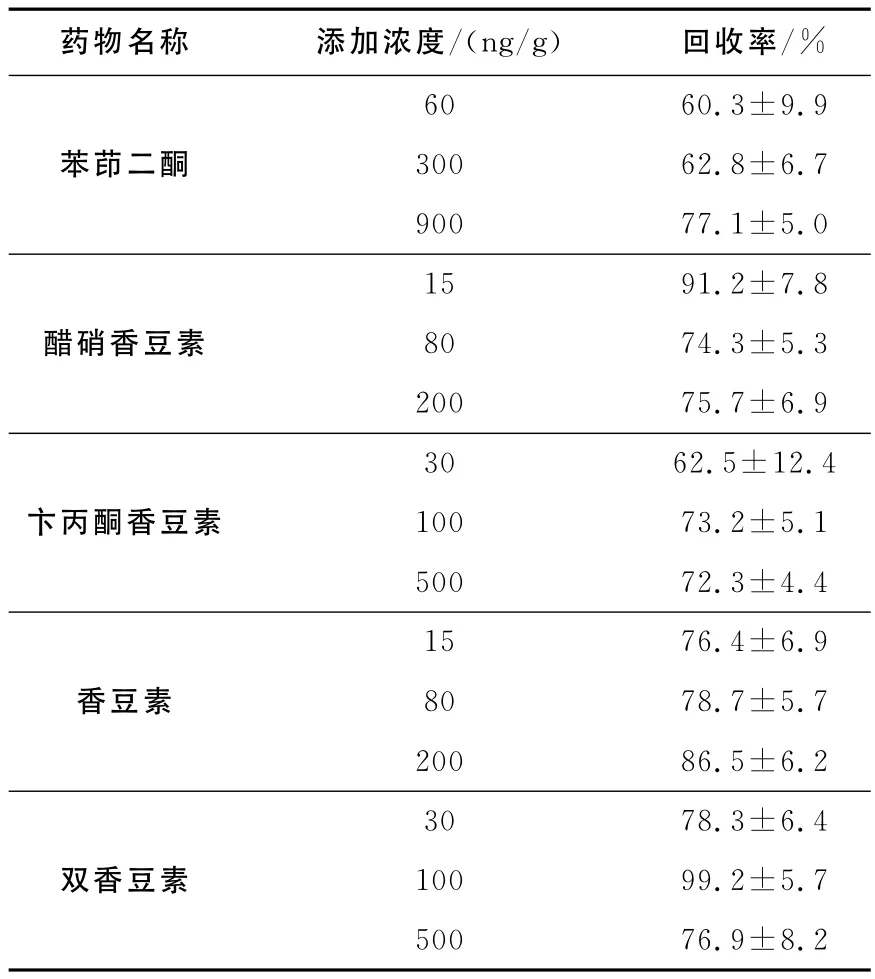
表3 5种药物的加标提取回收率Table 3 The relative recoveries of five drugs in feed(n=5)
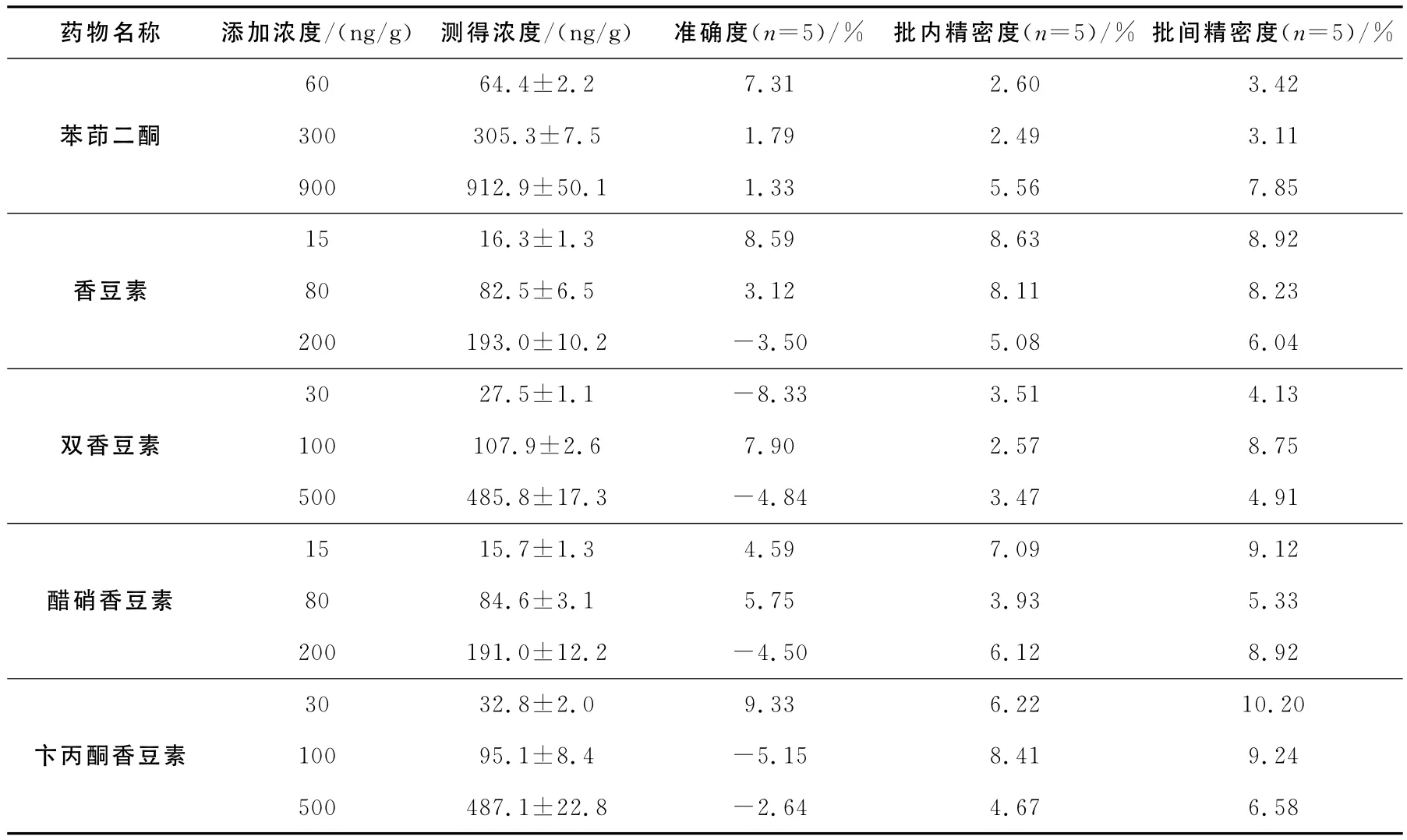
表4 5种药物的日内、日间精密度和准确度Table 4 Inter-day and intra-day assay accuracy and precision data for five drugs
苄丙酮香豆素的主要碎片m/z 250.1为脱掉丙酮奇电子离子后的负离子,当碎裂能量达到25eV时出现明显的m/z161.1离子峰,当碎裂能量达到40eV以上时有明显的m/z 117.0离子峰。香豆素分子在正离子模式下有更好的响应,主要通过脱掉CO和CO2中性分子形成稳定的带有芳香性的m/z91.0和102.9的碳正离子。
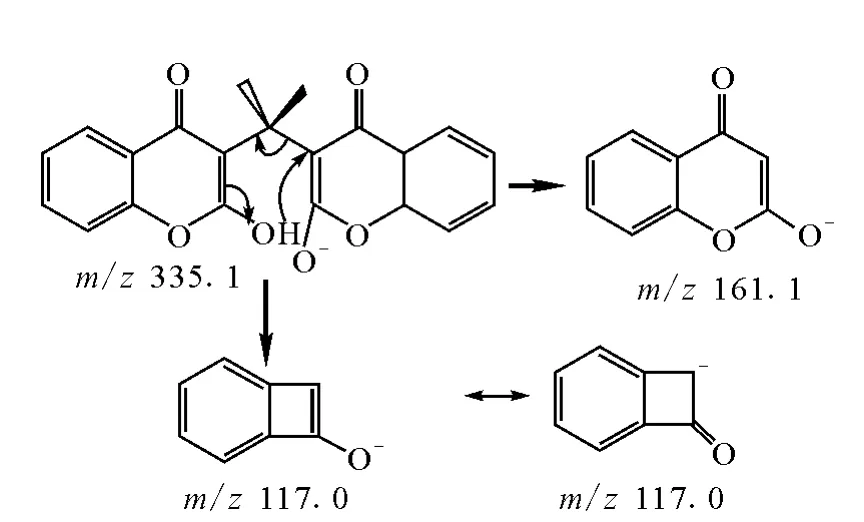
图2 双香豆素的裂解过程Fig.2 Possible fragmentation pathway of dicoumarin

图3 苯茚二酮的裂解过程Fig.3 Possible fragmentation pathway of phenidione
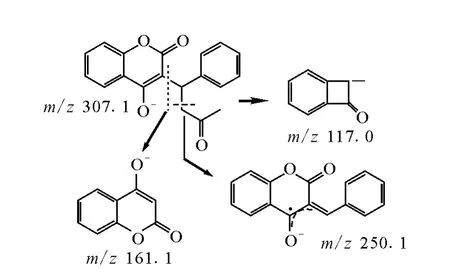
图4 苄丙酮香豆素的裂解过程Fig.4 Possible fragmentation pathway of warfarin
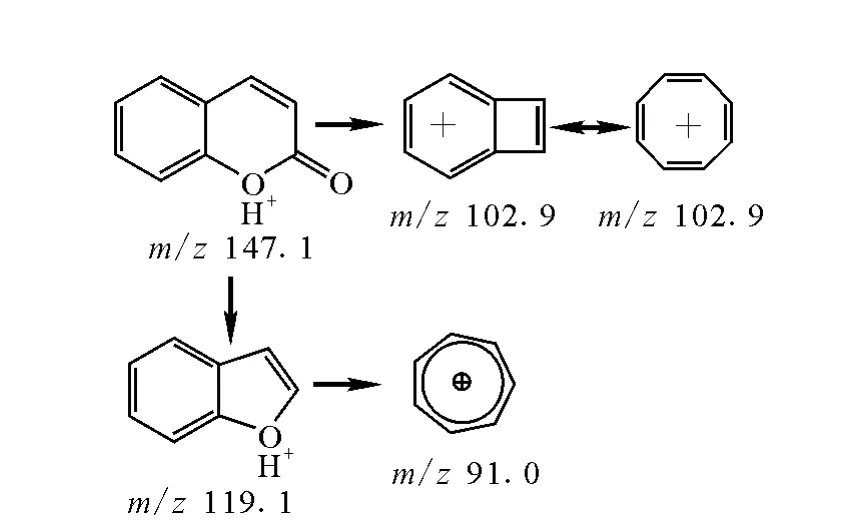
图5 香豆素的裂解过程Fig.5 Possible fragmentation pathway of counarin
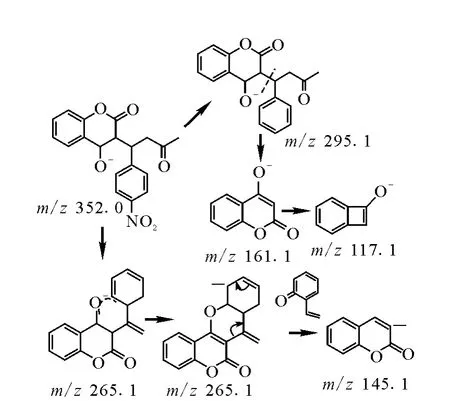
图6 醋硝香豆素的裂解过程Fig.6 Possible fragmentation pathway of acenocoumarin
醋硝香豆素响应最强的碎片离子为m/z 265.1,推测为准分子离子失去一分子O=C=CH-NO2。当碎裂能量加到40eV以上时有明显的 m/z 145.1离子峰,推测为失去一个C8H8O分子,另外还有较强的 m/z 161.1,117.1的离子峰。经过中性丢失扫描(neutral loss)证实在碰撞能量达到20eV,MS1从260到360有一个明显的质量数87(C2HNO3)的中性碎片丢失,MS1从100到260有一个明显的质量数为120(C8H8O)的中性碎片丢失。上述结果表明,m/z161.1,117.1为4-羟基香豆素类抗凝血药物的主要特征碎片,可作为该类抗凝血剂衍生物的特征筛查离子。
3 结论
本实验建立了马饲料中的4种香豆素类抗凝血剂和1种茚二酮类抗凝血剂同时快速筛查和定量分析的液相色谱-质谱法,该方法的预处理较为便捷、高效,且有较好的专属性、重现性和灵敏度,适用于复杂基质中该类药物的痕量分析和测定。
[1]2011FEI Equine Prohibited Substances List.International Equestrian Federation.
[2]AFC(2004).Opinion of the scienti?panel on food additives,flavourings,processing aids and materi-als in contact with food(AFC)on a request from the Commission related to Coumarin.The EFSA Journal,2004,104:1-36.
[3]VANDENBROUCKE V,BOUSQUET-MELOU A,DE BACKER P,et al.Pharmacokinetics of eight anticoagulant rod-enticides in mice after single oral administration[J].Journal of Veterinary Pharmacology and Therapeutics,2008,31(5):437-445.
[4]PIOTR ADAMOWICZ,MARIA KA£A.LC-MS and LC-MS/MS determination of six anticoagulant rodenticides in blood[J].Problems of Forensic Sciences,2009,77:53-63.
[5]秦 旸,徐友宣,杨树民.液相色谱-质谱联用在兴奋剂检测中的应用及进展[J].色谱,2008,26(4):431-436.
[6]MUSILIYU A,KHAN M F,COOPERWOOD J S.Synthesis and antiproliferative activity of coumarin-estrogen conjugates against breast cancer cell lines.Musa[J].Lett Drug Des Discov,2009,6(2):133-138.
[7]VANDENBROUCKE V,DESMET N,DE BACKER P.Multi-residue analysis of eight anticoagulant rodenticides in animal plasma and liver using liquid chromatography combined with heated electrospray ionization tandem mass spectrometry[J].Journal of Chromatography B,2008,869(1/2):101-110.
[8]席海为,马 强,王 超.高效液相色谱法对化妆品中17种香豆素类化学成分的同时测定[J].分析测试学报,2010,29(12):1 168-1 172.
[9]SPROLL C,RUGE W,ANDLAUER C.HPLC analysis and safety assessment of coumarin in foods[J].Food chemistry,2008,109 (2),462-469.
[10]JIN M C,REN Y P,XU X M.Determination of bromadiolone in whole blood by high performance liquid chromatography coupled with electrospray ionization tandem mass spectrometry[J].Forensic Science Internat-ional,2007,171(1):52-56.
[11]JIN M C,CHEN X H.Rapid determination of three anticoagulant rodenticides in whole blood by liquid chromatography coupled with electrospray ionization mass spectrometry[J].Rapid Communications in Mass Spectrometry,2006;20(18):2 741-2 746.
[12]Equine Consulting Services.Protein quality and requirements in exercising and growing horses[2011-06-19][J/OL].http://equineconsultingservices.com.au/admin/images_nutrition_pdf/2009.Dec0465Protein%20quality%20and%20requirements%20in%20exercising%20and%20growing%20horses3.pdf.
[13]YU N H,HO E N M,TANG F P W,et al.Comprehensive screening of acidic and neutral drugs in equine plasma by liquid chromatographytandem mass spectrometry[J].Journal of Chromatography A,2008,1 189(1/2):426-434.
[14]LEUNG G N W,LEUNG D K K,W AN T S M,et al.High throughput screening of sub-ppb levels of basic drugs in equine plasma by liquid chromatography-tandem mass spectrometry[J].Journal of Chromatography A,2007,1 156(1/2):271-279.
