混合溶剂热条件下DL-Trp晶体生成过程的研究*
2011-01-29唐丽娟刘玮炜马卫兴
王 建,唐丽娟,2,刘玮炜,马卫兴,陈 龙
(1.淮海工学院江苏省海洋生物技术重点实验室,江苏 连云港 222005;2.中国矿业大学,江苏 徐州 221116)
1875年Kuhne认为源自生物中一种呈色物质含有吲哚核。1892年Neumeister定名为色氨酸。1907年Ellinger提出色氨酸的结构式,Flamand用化学合成法加以确定。色氨酸以游离或结合态广泛存在于生物中。L-色氨酸呈白色或略带黄色的叶片状结晶或粉末,在稀酸或稀碱中溶解。它与酸在暗处加热或在碱液中都较稳定,但存在其他氨基酸或糖类时则易分解,与水共热则产生少量吲哚。L-色氨酸如在NaOH、CuSO4存在下加热,则产生大量吲哚[1]。目前,国内外有关D-色氨酸的研究报告仍较少[2-4]。
获得高质量色氨酸单晶体的难度很大,至今在剑桥晶体数据库中收录的几个结构数据都是DLTrp的。如Erik Bye等[5]1973年通过 X-射线衍射法测定 DL-Trp 甲酸盐晶体结构。Bakke等[6]1980年将DL-Trp溶于热吡啶冷却后得到的 DL-Trp晶体,将DL-Trp溶于热草酸水溶液,经缓慢冷却制得 D-Trp草酸氢盐晶体。Christian B 等[7]报道 LTrp甲酸溶剂化物晶体在183 K下测定的结构。Hübschle CB 等[8]通过将 DL-Trp 溶于温热的异丙醇-甲酸饱和溶液缓慢冷却得到晶体并在173 K下测定结构。本文作者原打算以L-Trp和碳酸钕为原料,通过混合溶剂热法制得L-Trp和钕的配合物,却意外地得到高产率的DL-Trp单晶体。在反应体系中,Trp分解现象远少于一般过渡金属离子与Trp的反应。经单晶X衍射分析对其结构进行了确定,还进行了红外表征和分析,并运用旋光度测定方法研究了构型的转变过程。该发现对开发和应用新型稳定的氨基酸类药物释放载体结晶材料具有重要价值[9]。
1 实验部分
1.1 试剂与仪器
傅立叶变换红外光谱仪,B型,美国 PE;Bruker SMART 1000 CCD单晶衍射仪。L-Trp为生化试剂 (国药集团化学试剂有限公司),碳酸钕为化学纯 (连云港丽港稀土有限公司),无水甲醇为分析纯。所有试剂使用前未经进一步处理。25 mL压力釜 (上海羌强实业发展有限公司)。101A-2数显电热鼓风干燥箱 (上海浦东欣悦科学仪器厂)。
1.2 实验过程
1.2.1 LD-Trp 的制备 称取 L-Trp(图 1)0.406 4 g(2.0 mmol),加入体积比为1∶1的去离子水和甲醇混合溶剂15 mL,不断搅拌使之完全溶解,形成透明溶液。将0.235 0 g(0.5 mmol)碳酸钕倒入上述溶液中,搅拌均匀。将混合液转入25 mL容量的特氟隆内胆,用不锈钢压力釜密封。置于电热鼓风干燥箱中,升温至150℃,保温72 h后,缓慢以2℃/h降至100℃,再以5℃/h降至室温(30℃)。得到图2所示浅棕黄色长片状晶体,产率97.12%。产物在熔点前分解,熔点低于L-Trp(280~285℃)。该晶体不溶甲醇、乙醇、DMF和DMSO。
1.2.2 红外光谱 DL-Trp单晶的 IR(KBr压片)如图3所示。
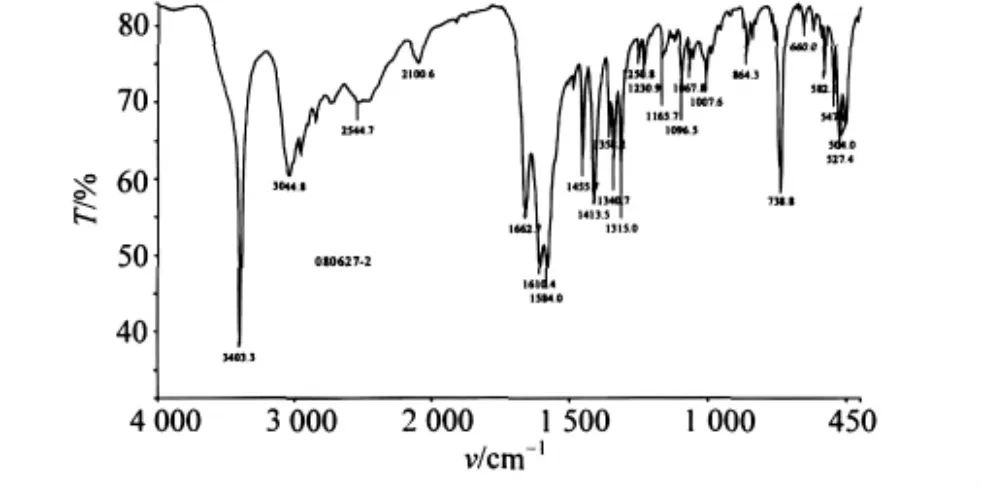
图3 DL-Trp的红外光谱Fig.3 FTIR spectrum of DL-Trp
1.2.3 DL-Trp的晶体结构测定 选取尺寸大小为0.17 mm ×0.15 mm ×0.03 mm 的单晶体置于单晶衍射仪上,在298(2)K下,用经石墨单色器单色化的 MoKα射线 (λ =0.071 073 nm),以 φ-ω 扫描方式收集衍射数据。在2.20°≤θ≤25.01°范围内收集到4 751个衍射点,其中独立衍射点1 720个(Rint=0.167 8),I>2σ (I)的可观测点746个。化合物的结构采用SHELXS-97程序由直接法解出。对非氢原子坐标及其各向异性温度因子进行全矩阵最小二乘法精修,所有计算在PC机上用SHELXL-97程序包完成。其它相关晶体学数据列于表1。

表1 DL-Trp的晶体学数据和结构参数Table 1 Crystallographic data of DL-Trp
产物的选择键长和键角如表2所示。氢键参数如表2所示。
1.2.4 不定形L-Trp固体在混合溶剂热条件下转变为DL-Trp单晶体过程的旋光度测定 称取L-Trp 1.016 g(5.0 mmol),加入体积比为1∶1 的去离子水和甲醇混合溶剂150 mL,搅拌使之溶解形成透明溶液,再加去离子水100 mL定容至250 mL。将0.235 0 g(0.5 mmol)碳酸钕倒入上述溶液中,搅匀。将混合液分成10组转入25 mL容量的特氟隆内胆,用不锈钢压力釜密封。置于电热鼓风干燥箱中,升温至150℃,保温72 h(期间每隔24 h取出一组测旋光度),缓慢以2℃/h降温,每降30℃取出一组测旋光度,降到30℃为止。所得溶液为浅棕黄色,经离心后取清液进行旋光度的测定。观测旋光度随时间的变化情况如图4所示。
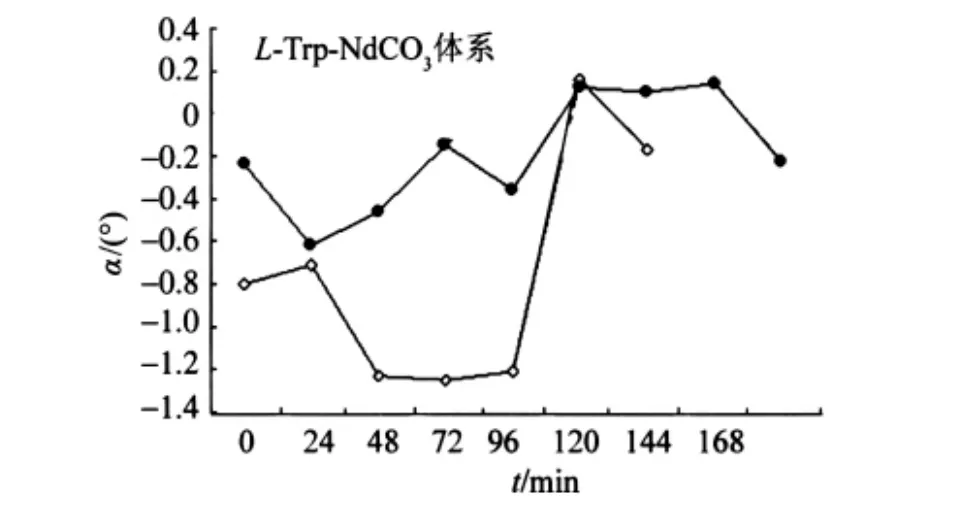
图4 两次测定L-Trp构型转变过程旋光度-时间曲线的对比Fig.4 Curves of optical rotation α and reaction time of L-Trp configuration transforming by twice measurement
将图4所示L-Trp在碳酸钕存在下构型变化过程中两次重复测定体系旋光度α/(°)随时间t/h的变化曲线进行对比,可发现体系旋光度开始均为负值,随时间变化,负值趋小,最后接近为零(水的旋光度)。
2 结果与讨论
2.1 L-Trp 和 DL-Trp 的红外光谱
比较L-Trp和图3的DL-Trp红外光谱,主要相关吸收峰的变化由表3显示。由于分子中有,出现3 403 cm-1N-H伸缩吸收峰,3 030~2 060 cm-1间的的3个峰分别归属于苯环上C-H键的特征吸收,其中主要峰从3 038(S)→3 045(S),波数略增。羧基中强的C=O吸收从1 667→1 663 cm-1,波数略减。1 591(S)cm-1峰则裂分为1 584(S)和1 610(S)cm-1双峰,1 414(m)cm-1峰未变化,分别归属于面内弯曲和。739 cm-1归属于吲哚氮的振动吸收峰,与L-Trp的744 cm-1相比有所减小,但吲哚氮未明显参与氢键作用。
2.2 分子结构
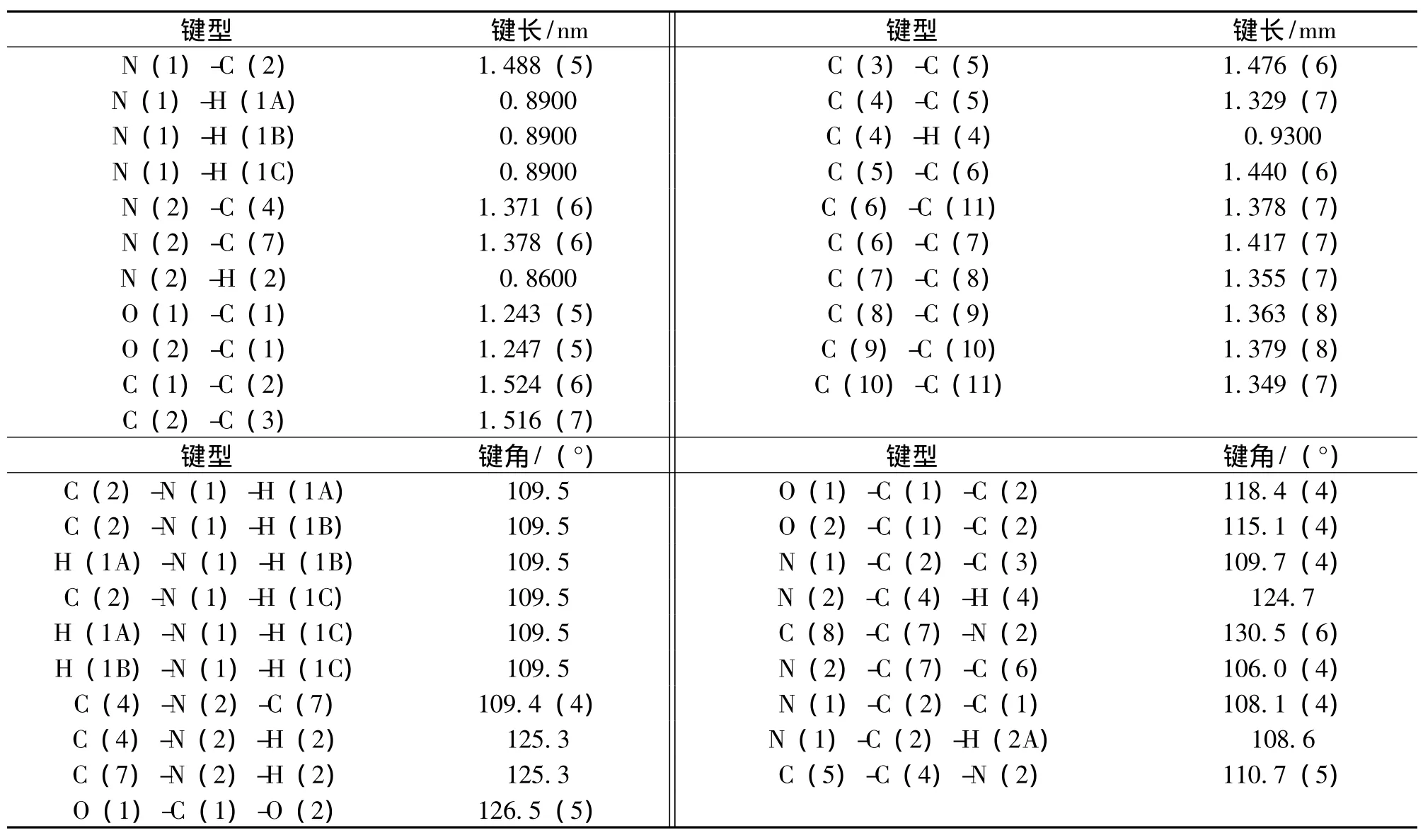
表2 DL-Trp的键长和键角Table 2 Bond lengths and angles of DL-Trp
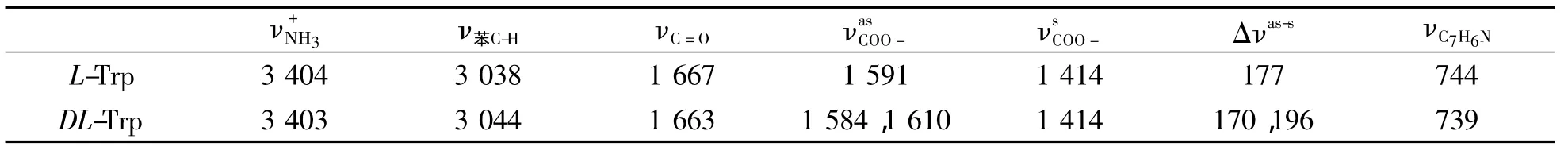
表3 DL-Trp和 L-Trp的红外光谱比较Table 3 FTIR analysis of DL-Trp and L-Trp
2.3 转变机理
为了证明形成DL-Trp型单晶过程中D-Trp是由部分L-Trp转型而来,作者专门对生产厂商的LTrp试剂产品质量进行了核实,并测定了试剂LTrp的比旋光度。结果表明DL-Trp中D-Trp确由部分L-Trp转型而来。有趣的是L-Trp在一般条件下不稳定易分解,而在碳酸钕存在下形成单晶时,不仅发生部分转型,而且依赖NH3+和COO-间的N-H…O氢键缔合作用与D-Trp一起形成很稳定的单晶体。由于量化计算的软硬件条件和技术水平的限制,作者未能对L-Trp与D-Trp形成相应的单晶体结构作理论计算。对于L-Trp转型的原因,虽然LTrp与其他氨基酸相比并不易发生消旋化,但与pH及温度呈现正相关性。有关L-氨基酸在热碱及高温、高压和一定时间等条件作用下发生异构化或消旋化的研究,并从各种L-氨基酸结构特点来探索其变化的规律性曾有报道[10-15]。L-Trp 的杂环基团为吲哚基,由于亚甲基与吡咯环产生σ-π超共轭效应,使β-C原子电子向吡咯环转移。吡咯环氮原子上孤对电子可与苯环产生p-π共轭效应,而使电子进一步向苯环分散。这两个共轭效应使α-C电子密度大为降低,共振为烯胺构型的量也降到最少。
作者认为在Trp与过渡金属离子M2+形成配位聚合物或在碳酸钕存在下形成DL-Trp单晶体时,L-Trp为了满足晶体结构对称性的需要,在溶液的pH值 (弱碱性)及溶剂效应 (超临界)的影响下,克服空间位阻效应,使一定量的L-Trp改变其构型形成D-Trp。这一点也被目前所获得的部分实验事实所证实[16-21]:即通过水热及有机溶剂热法只能得到 [M(D-Trp)(L-Trp)]n型聚合物,而无法得到 [M(L-Trp)2]n或 [M(D-Trp)2]n型聚合物。而且目前色氨酸的单晶体也只能得到外消旋体 DL-Trp。
在水热条件下,适合的过渡金属离子作为模板剂,可使部分L-Trp通过先形成烯胺构型再逐渐转变为D-Trp。在L-Trp和D-Trp之间存在转换平衡,通过结晶和从溶液体系析出方式使该平衡发生移动,因此有利于低能量构型的配位聚合物和外消旋体DL-Trp作为新相形成晶核并生长。
2.4 L-Trp转变为 DL-Trp的过程中旋光度的变化
根据图5所示旋光度-时间曲线变化可以看出,在水和甲醇混合溶剂中加热后,反应体系溶液的旋光度先是负值增加。恒温时旋光度变化很小,且在一定范围内波动。开始降温后,溶液旋光度负值逐渐减小,最后稳定在一定范围内。
所以当温度发生改变时,L-Trp发生了构型变化。L-Trp溶液体系旋光度由负值变为零表明,LTrp构型变化过程是一个渐变过程,该过程与DLTrp结晶的成核和晶体形成过程是一致的,由此推断超分子外消旋体DL-Trp的自组装过程很可能是一个碳酸钕参与下的协同反应过程。
L-Trp在碳酸钕的催化下形成DL-Trp过程在降温阶段,尤其降至90℃左右时,部分L-Trp加速转化为D-Trp,最终降至室温达到平衡,通过成核结晶生成 LD-Trp。
[1]宋文霞,王瑞明.L-色氨酸的研究[J].农产品加工·学刊,2005(3):18-20.
[2]吴妙宗,蔡辉益.色氨酸营养代谢研究进展[J].蓄禽业,2001(11):47-49.
[3]王大慧,韦萍,欧阳平凯.D-色氨酸研究进展[J].化工进展,2002(2):103-105.
[4]李剑欣,张绪梅,徐琪寿.色氨酸的生理生化作用及其应用[J].氨基酸和生物资源,2005(3):58-62.
[5]ERIK B,ARVID M,CHRISTIAN R.Crystal structure of DL-tryptophan formate[J].Acta Chemica Scandinavica,1973(27):471-484.
[6]BAKKE Ø,MOSTAD A.The structure and conformation of tryptophan in the crystal of the pure racemic compound and the hydrogen oxalate[J].Acta Chem Scand:B,1980,34:559-570.
[7]CHRISTIAN B H,BIRGER D,PETER L.L-Tryptophan formic acid solvate at 183 K[J].Acta Crystallographica Section C,2002,C58,o540-o542.
[8]HÜBSCHLE C B,MESSERSCHMIDT M,LUGER P.Crystal structure of DL-Tryptophan at 173 K cryst[J].Res Technol,2004,39:274 -278.
[9]黄岳山,赵修华,吴效明,等.氨基酸类聚合物材料及其在药物控释系统中的应用[J].中国医学物理学杂志,2003(1):39-42.
[10]冯淑华.L-氨基酸消旋化的结构理论探讨[J].安徽师范大学学报:自然科学版,2000,23(2):149-157.
[11]刘志皋.食品营养学[M].北京:轻工业出版社,1991.
[12]袁缨,张旭东.饲料中氨基酸异构体的测定方法及氨基酸异构化研究[J].中国农业科学,2001,34(4):439-444.
[13]PALLA G,MARCHELLI R,DOSSENA A,et al.Occurrence of D-amino acids in food:Detection by capillary gas chromatography and by reversed-phase high-performance liquid chromatography with L-phenylalaninamides as chiral selectors[J].Journal of Chromatography,1989,475:45 -53.
[14]BRUECKNER H,JACK P,LANGER M,et al.Liquid chromatographic determination ofD-aminoacidsin cheese and cow milk.Implication of starter cultures,amino acid racemases,and rumen microorganisms on formation,and nutritional considerations[J]. Amino acids,1992,2:271 -284.
[15]FRIEDMAN M,GUMBMANN R,BOCA R FA.Absorption and utilization of amino acids[J].CRC Press,1989,2:173-190.
[16]王建,许兴友,马卫兴,等.氨基酸配位聚合物[Co(LTrp)(D-Trp)]n[J].无机化学学报,2008,24(9):1514-1918.
[17]WANG J,XU X Y,MA W X,et al.Synthesis and Structure of a two-dimensional double chain iron(Ⅱ)L-Trp coordination polymer[Fe(L-Trp)2(HL-Trp)2]n[J].Chin J Struc Chem,2008,27(2):153-158.
[18]王建,许兴友,马卫兴,等.混合溶剂热法制备[Zn(L-Trp)(D-Trp)]n[J].人工晶体学报,2008,37(5):1199-1204.
[19]XIE Y,WU H H,YONG G P,et al.rac-Poly [bis-(μ-tryptophanato)manganese(II)][J].Acta Cryst E,2006,62:m2089-m2090.
[20]WANG J,XU X Y,MA W X,et al.rac-catena-Poly[nickel(II)-di-μ-tryptophanato][J].Acta Cryst E,2007,63:m2867-m2868.
[21]WANG J,XU X Y,MA W X,et al.An Interesting Complex:[Cd(L-Trp)(D-Trp)]n[J].J Ino &Organometallic Polymers& Materials,2009,19(3):53-58.
