杨木粉接枝β-环糊精的制备与表征
2011-01-29孙羚珊李丽萍
孙羚珊,李 斌,李丽萍
(东北林业大学 理学院 阻燃材料分子设计与制备黑龙江省重点实验室,哈尔滨 150040)
环糊精由淀粉经特定的酶降解所得,而且是由α-1,4葡萄糖苷键相互连接而形成的一系列环状低聚糖,其中β-环糊精最为常见.由于环糊精分子的构型比较特殊,整体形状呈现一种带空腔的桶形结构,因此环糊精分子具有外侧亲水、内侧亲酯的性质.[1-3]
目前,利用木质纤维素设计研究开发功能性木质纤维素材料或其复合材料,实现木质纤维素的高技术化方面的研究很少.如果能利用木质原料中的纤维素、半纤维素、木质素的复杂和疏松结构特点,设计并实现木质纤维素表面的分子化学修饰,制备出木质纤维素功能材料,并对其基础理论及性能展开研究,那么木质纤维素的应用前景将十分诱人.纤维素固载β-环糊精的方法现在主要有交联法、接枝共聚法、反应性纤维素衍生物固载法等.[4-5]在交联法中,由于柠檬酸具有价格便宜、处理简单、无毒等优点,因此大多用于环糊精接枝到织物纤维上的交联剂.[6-7]由于β-环糊精对客体分子的包合能力,可以吸附一定尺寸的香料小分子[8-10],所以将β-环糊精添加到木塑复合材料中具有重要意义.本研究采用柠檬酸为β-环糊精与杨木粉的交联剂,成功制备出杨木粉-β-环糊精衍生物.
1 实验部分
1.1 仪器及试剂
Avatar 360型傅里叶红外光谱仪(美国Thermo Nicolet公司),T6紫外分光光度计(北京普析通用仪器有限责任公司),JHS-1电子恒温搅拌器(杭州仪表电机有限公司),PE Pyris 1热重分析仪(PE公司).β-环糊精(天津市科密欧化学试剂开发中心),柠檬酸、次甲基磷酸钠、氢氧化钠、丙酮、无水乙醇、无水碳酸钠(天津市恒兴化学试剂制造有限公司),酚酞(天津市光复科技发展有限公司),以上试剂均为分析纯.
1.2 柠檬酸-β-环糊精的制备
称取4.0gβ-环糊精、1.48g柠檬酸(CA)和0.38g次甲基磷酸钠催化剂置于烧杯中,根据m(β-CD)∶m(H2O)=1∶0.6加入蒸馏水充分搅拌后置于鼓风烘箱内,在100℃下静置1h后取出冷却.混合物置于索氏提取器中,以无水乙醇为溶剂,90℃下回流提取6h,去除催化剂、未反应的柠檬酸及其他副产物.[11-12]将粗产物溶于蒸馏水中,逐滴加入丙酮,沉淀后过滤,反复操作数次后得到纯CA-β-CD,60℃下真空烘干.样品经红外光谱分析,酯基特征峰为1 730cm-1.CA-β-CD中的—COOH 含量采用滴定法测定[13-15].
1.3 杨木粉接枝β-环糊精的制备
称取5g杨木粉置于250mL烧杯中,加入一定量w=25%的氢氧化钠溶液溶胀1h.将溶胀后的木粉洗至中性,过滤,烘干,待用.
在250mL圆底烧瓶中加入10g洗净烘干的木粉、200mLφ=7%的硝酸溶液,油浴加热回流l h,温度控制在100℃,以除去部分半纤维素、单宁、多糖、色素等溶于酸的杂质及木质素.用稀NaOH溶液吸收反应放出的NO2.抽滤,用蒸馏水洗涤滤渣至滤液呈中性,得滤渣I.
将滤渣I装入250mL的圆底烧瓶中,再加入200mLw=3%的NaOH溶液,机械搅拌回流(防止爆沸)0.5h,以除去木质素.抽滤,用自来水洗涤滤渣至滤液呈中性,滤渣在100℃下烘干.[16]
将0.5g处理过的木粉溶于装有一定量蒸馏水的锥形瓶中,将上步合成的4.5g CA-β-CD加入其中,油浴加热至100℃并在此温度下充分搅拌,反应2.5h.过滤,滤渣即为产品,用蒸馏水洗至中性,60℃下干燥24h,经红外光谱分析,酯基特征峰出现,在1 730cm-1处.样品中β-环糊精的含量可以通过测定不同β-环糊精浓度的碱性酚酞溶液的吸光度的方法来检测[17].
1.4 杨木粉接枝β-环糊精中β-环糊精含量的测定
1)β-环糊精的质量浓度与吸光度的关系曲线的绘制.先向1号容量瓶中加入2.00mL 3.700 6×10-4mol·L-1酚酞溶液和2.00mL 2.814 7×10-2mol·L-1碳酸钠溶液,再加入蒸馏水至25mL定容.分别向编有2~7号的25mL容量瓶中加入0.50,0.70,1.00,1.20,1.50,2.00mL的5×10-4mol·L-1β-环糊精标准溶液以及10mL蒸馏水,再分别加入2.00mL 2.814 7×10-2mol·L-1碳酸钠溶液振荡30s,最后分别加入2.00mL 3.700 6×10-4mol·L-1酚酞溶液并振荡30s,用蒸馏水定容到刻度线.用T6紫外分光光度计在最大吸收波长为552nm处,以蒸馏水作空白,测定其吸光度,以β-环糊精的质量浓度对吸光度作图,绘制出标准曲线:A=0.873 5-5.8×10-3ρ,式中A为吸光度,ρ为环糊精溶液的质量浓度(mg·L-1),线性相关系数为0.991 5,线性范围为10~50mg·L-1.
2)杨木粉接枝β-环糊精中β-环糊精含量的测定.①空白溶液的配制.准确称取0.1g杨木粉接枝β-环糊精于试管中,再加入V(CH3CH2OH)∶V(H2O)=1∶1的乙醇水溶液10.0mL,吸附,过滤;准确移取2mL滤液至25mL容量瓶中,加入2mL 2.814 7×10-2mol·L-1碳酸钠溶液,定容.②样品溶液的配制.准确称取0.1g杨木粉接枝β-环糊精于试管中,再加入3.700 6×10-4mol·L-1酚酞溶液10.0mL,吸附,过滤;准确移取2mL滤液至25mL容量瓶中,加入2mL 2.814 7×10-2mol·L-1碳酸钠溶液,定容.③以上述空白溶液为参照,测定样品溶液在552nm处的吸光度,对照标准曲线,得到样品溶液中β-环糊精的质量浓度,按下式计算出杨木粉接枝β-环糊精中的β-环糊精含量b(单位为μmol·g-1):b(β-CD)=(ρ×V)/(Mr×m),式中ρ为β-环糊精的质量浓度,V 为溶液的体积(mL),Mr为β-环糊精的相对分子质量,m为称取吸附剂的干基质量(g).
1.5 红外光谱分析和差示热解重量分析
样品的红外光谱分析采用KBr压片法,在Avatar 360型傅里叶红外光谱仪上进行.样品的差示热解重量分析在PE Pyris1热重分析仪上进行,仪器的升温速度为10.00℃·min-1,整个测试在氮气氛围下进行[18].
2 结果与讨论
2.1 CA-β-CD中羧基含量的影响因素
由于β-CD中含有的21个羟基都有可能与CA发生酯化反应,而使最终形成的酯化产物CA-β-CD中羧基量减少.CA-β-CD中羧基量的多少将决定其接枝木粉纤维的反应活性和接枝率;因此,在样品制备过程中,须控制一定的反应条件,既使β-CD与CA尽量反应,又保证产物中有尽可能多的羧基含量.通过实验发现次甲基磷酸钠(SHP)浓度、反应时间、β-CD与水的固-液比以及CA浓度都会对产物中的羧基含量产生影响.
本实验依据最佳反应条件制得了CA-β-CD:n(CA)∶n(β-CD)∶n(SHP)=1∶2∶1,m(β-CD)∶m(H2O)=1∶0.6,加入蒸馏水充分搅拌后置于鼓风烘箱内,在100℃下静置的时间是1h.所得产物通过标准氢氧化钠溶液滴定,结果滴定1mol CA-β-CD消耗了2.92mol氢氧化钠.
2.2 不同反应因素对杨木粉接枝β-CD的影响
1)木粉与CA-β-CD的质量比对接枝反应的影响.当m(木粉)∶m(CA-β-CD)=1∶(6~10)时,CA-β-CD质量对杨木粉接枝β-环糊精中β-环糊精含量b(β-CD)的影响不同(如图1).这是由于随着质量比的增大,一开始有利于反应的进行,β-环糊精的质量摩尔浓度有较大幅度的提高,但当质量比达到1∶9后,CA-β-CD本身发生了自聚反应,导致生成的木粉-β-CD产生副反应,所以杨木粉接枝β-环糊精中β-环糊精含量b(β-CD)开始减小;因此,当质量比为1∶9时,杨木粉接枝β-环糊精中β-环糊精含量b(β-CD)最大.图1中1表示未处理的杨木粉,2表示处理过的杨木粉,可以看出2中的β-环糊精含量b(β-CD)大于1,这可能是因为对木粉进行处理后,去除了木质素、半纤维素、果胶等物质,更加有利于接枝反应,所以效果更佳,b(β-CD)值为18.28μmol·g-1.
2)反应温度对接枝反应的影响.以反应温度为(60~110)℃,探讨了不同反应温度对杨木粉接枝β-环糊精中β-环糊精含量b(β-CD)的影响(如图2).随着温度的升高,一开始有利于反应的进行,β-环糊精的质量摩尔浓度有较大幅度的提高,但当温度高于100℃时,CA-β-CD可能发生了开环反应,使生成的木粉-β-CD产生了副反应,杨木粉接枝β-环糊精中β-环糊精含量b(β-CD)开始减小.图2中1表示未处理的杨木粉,2表示处理过的杨木粉,可以看出2中的β-环糊精含量b(β-CD)大于1,这进一步证明了处理过的木粉接枝效果要好于未处理的木粉,最大b(β-CD)值为19.37μmol·g-1.
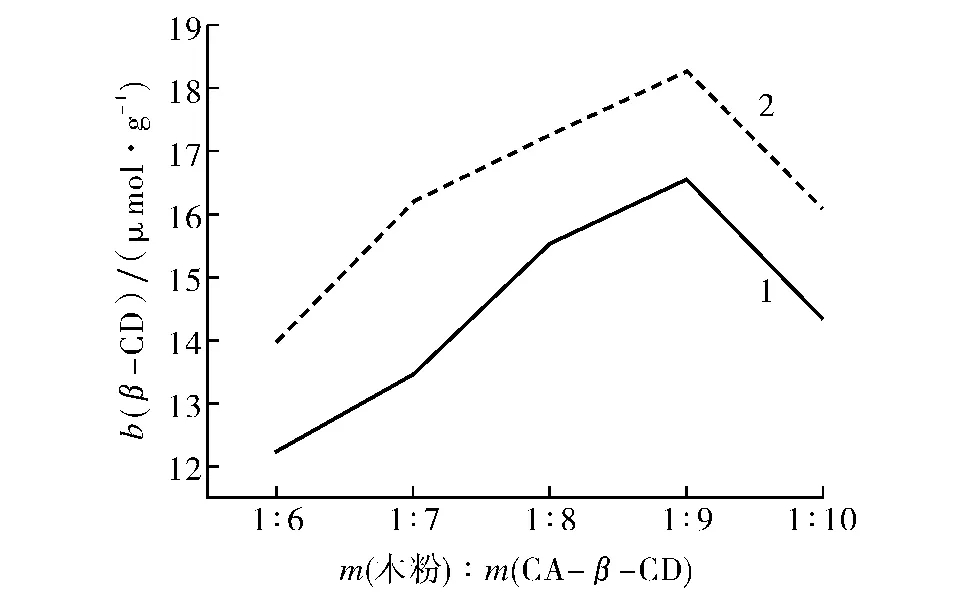
图1 木粉与β-糊精的质量比对b(β-CD)的影响Fig.1 Influence of wood flour to CA-β-CD ratio on b(β-CD)
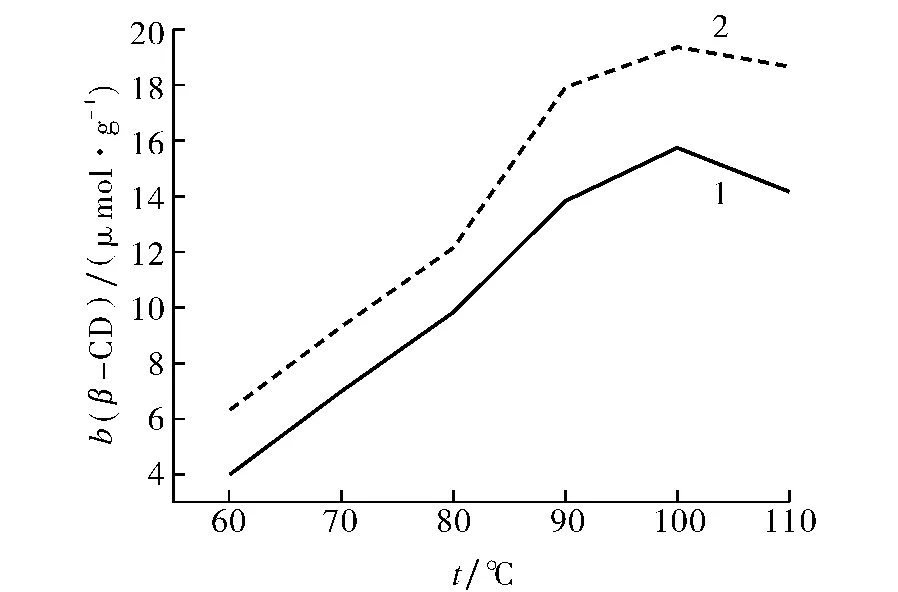
图2 温度对b(β-CD)的影响Fig.2 Influence of temperature on b(β-CD)
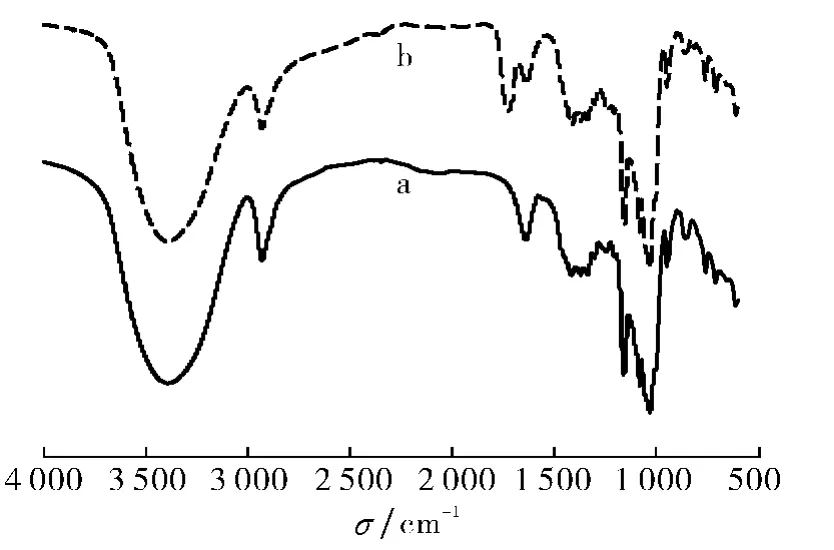
图3 杨木粉(a)与木粉-β-环糊精(b)的红外光谱图Fig.3 FT-IR spectra of wood flour(a)and wood flour-β-CD(b)
2.3 杨木粉和木粉-β-环糊精的红外光谱图
由于β-CD与木粉纤维一样属于多糖,分子结构都是由葡萄糖单元组成,所以接枝前后红外光谱图应无较大差异.从图3中可以看出,在很多相同的波数处,木粉与接枝后的木粉的确都有相似的特征吸收峰出现,3 400cm-1处是—OH的伸缩振动吸收峰,2 928cm-1处是—CH 的伸缩振动峰,1 080cm-1处是—C—C—的伸缩振动吸收峰;但是,在1 730cm-1附近,原木粉(a)没有吸收峰出现,而接枝后的木粉(b)则出现了较强的酯羰基吸收峰,证明产物中存在酯基,说明木粉与β-环糊精接枝成功.
2.4 杨木粉、木粉-β-环糊精、β-环糊精的热重分析图
由图4,5可见,杨木粉、纯β-CD以及木粉-β-CD的最大分解速率及相对应的分解温度各不相同.β-CD的TG曲线有两个峰,而杨木粉和木粉-β-CD则都只有一个强峰.β-CD在70℃处的峰为环糊精的脱水过程,然而纯β-CD和木粉-β-CD在300℃以下都没有明显的峰.图5显示纯β-CD、木粉-β-CD、杨木粉的最大分解点温度分别为348,365,391℃,由此可见包合后杨木粉的分解温度相对于杨木粉提前了.这说明杨木粉与β-CD的分子间相互作用削弱了杨木粉在氮气环境下的热稳定性.
综合前面的红外光谱图分析结果,说明β-环糊精已经与杨木粉接枝成功.
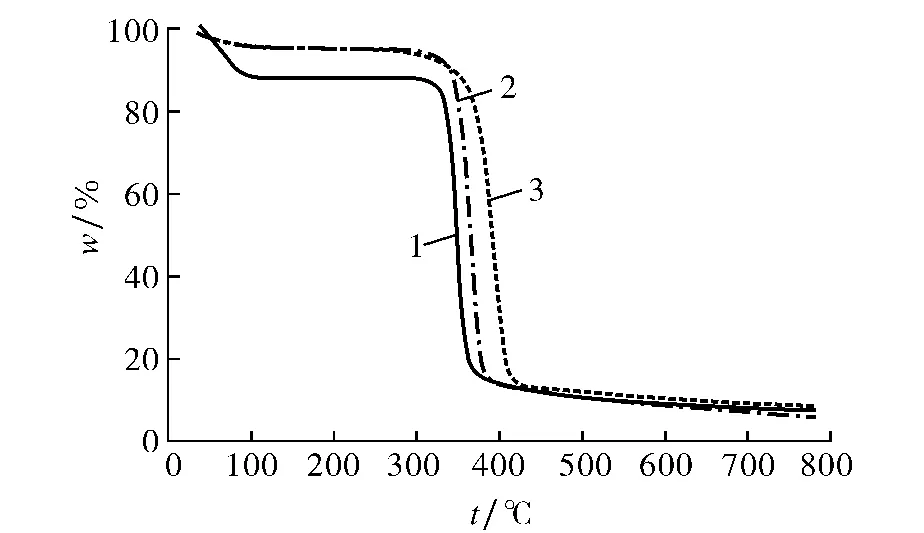
图4 β-CD,木粉-β-CD和杨木粉的热重分析曲线Fig.4 Thermogravimetric curves of β-CD,wood-flour-β-CD,and wood-flour

图5 β-CD,木粉-β-CD和杨木粉在氮气环境下的DTG曲线Fig.5 DTG curves of β-CD,wood-flour-β-CD,and wood-flour in N2atmosphere
[1]童林荟.环糊精化学:基础与应用 [M].北京:科学出版社,2001:1-84.
[2]胡智文,温会涛,王清清,等.β-环糊精接枝壳聚糖功能纤维的合成与包合药物 [J].高分子材料科学与工程,2009,25(3):116-119.
[3]GONIL P,SAJOMSANGw,RUKTANONCHAI U R,et al.Novel quaternized chitosan containingβ-cyclodextrin moiety:synthesis,characterization and antimicrobial activity[J].Carbohydr Poly,2011,83(2):905-913.
[4]双金玲,刘泽华.纤维素固载β-环糊精的研究进展 [J].纤维素科学与技术,2007,15(4):55-59.
[5]DESMET G,TAKACS E,WOJNAROVITS L,et al.Cellulose functionalization via high-energy irradiation-initiated grafting of glycidyl methacrylate and cyclodextrin immobilization [J].Radiat Phys Chem,2011,80(12):1358-1362.
[6]杨玉芳.β-环糊精用于羊毛织物防臭整理研究 [D].上海:东华大学,2010.
[7]DUCOROY L,BACQUET M,MARTEL B,et al.Removal of heavy metals from aqueous media by cation exchange nonwoven PET coated with β-cyclodextrin-polycarboxylic moieties [J].React Funct Polym,2008,68(2):594-600.
[8]NUCHUCHUA O,SAESOO S,SRAMALA I,et al.Physicochemical investigation and molecular modeling of cyclodextrin complexation mechanism with eugenol[J].Food Res Int,2009,42(8):1178-1185.
[9]CRUPI V,FICARRA R,GUARDO M,et al.UV-vis and FTIR-ATR spectroscopic techniques to study the inclusion complexes of genistein with β-cyclodextrins[J].J Pharm Biomed Anal,2007,44(1):110-117.
[10]车音,顾颖,朱霞石.β-环糊精交联包结吸附树脂富集镉 [J].扬州大学学报:自然科学版,2009,12(3):26-29.
[11]ZHAO Dong,ZHAO Liang,ZHU Cheng-shen,et al.Synthesis and properties of water-insolubleβ-cyclodextrin polymer crosslinked by citric acid with PEG-400as modifier[J].Carbohydr Polym,2009,78(1):125-130.
[12]GAFFAR M A,EL-RAFIE S M,EL-TAHLAWY K F.Preparation and utilization of ionic exchange resin via graft copolymerization of β-CD itaconate with chitosan[J].Carbohydr Polym,2004,56(4):387-396.
[13]VONCINA B,MARECHAL A M L.Grafting of cotton with β-cyclodextrin via poly(carboxylic acid)[J].J Appl Polym Sci,2005,96(4):1323-1328.
[14]EL GHOUL Y,BLANCHEMAIN N,LAURENT T,et al.Chemical,biological and microbiological evaluation of cyclodextrin finished polyamide inguinal meshes[J].Acta Biomater,2008,4(5):1392-1400.
[15]EL-TAHLAWY K,GAFFAR M A,EL-RAFIE S.Novel method for preparation of β-cyclodextrin/grafted chitosan and it’s application[J].Carbohydr Polym,2006,63(3):385-392.
[16]杨磊,李坚.木质基高吸水树脂的合成 [J].东北林业大学学报,2003,31(2):11-12.
[17]李明时,张帆.β-环糊精的分光光度测定 [J].分析化学,1998,26(7):912.
[18]SONG Le-xin,GUO Xue-qing,DU Fang-yun,et al.Thermal degradation comparison of polypropylene glycol and its complex with β-cyclodextrin[J].Polym Degrad Stab,2010,95(4):508-515.
