APE1单核苷酸多态性与肺癌易感性关系的研究*
2011-01-26李梦侠
李 峥,李梦侠,廖 玲,王 东
(第三军医大学大坪医院野战外科研究所肿瘤中心,重庆 400042)
APE1单核苷酸多态性与肺癌易感性关系的研究*
李 峥,李梦侠,廖 玲,王 东△
(第三军医大学大坪医院野战外科研究所肿瘤中心,重庆 400042)
目的探讨中国重庆汉族人群脱嘌呤/脱嘧啶核酸内切酶1(APE1)基因单核苷酸多态性与肺癌易感性的关系。方法采用病例对照研究,应用相对的两对引物-聚合酶链反应(PCR-CTPP)技术检测455例肺癌患者和443例健康人APE1―141T/G和APE1 148Asp/Glu单核苷酸多态性(SNP)。结果APE1―141G/G基因型相对于T/T基因型,显著减少了患肺癌的风险(OR=0.62;95%CI为0.42~0.91);单倍体分析中,APE1―141T/148Glu单倍体相对于―141T/148Asp单倍体,显著增加了患肺癌的风险(OR=1.28,95%CI为1.01~1.62)。结论APE1基因与中国重庆汉族人群肺癌易感性密切相关,APE1―141T/148Glu单倍体可能是肺癌的重要遗传易感因素。
肺肿瘤;脱嘌呤/脱嘧啶核酸内切酶 1;单核苷酸多态性
肺癌是中国最常见的恶性肿瘤,也是病死率最高的恶性肿瘤之一,其患病率和发病率随着环境污染及吸烟率的上升在世界上大多数国家逐年上升[1]。据统计,肺癌在中国城市肿瘤死亡顺序中已由第4位上升为第1位。肺癌的发生与环境、遗传等诸多因素有关,其中吸烟是最重要的环境危险因素。然而,同处于吸烟环境的个体并不都患肺癌,这一事实表明,个体是否患肺癌并非单纯取决于环境因素,在很大程度上还取决于个体的遗传易感性[2]。
碱基切除修复(base excision repair,BER)是DNA修复系统中最主要的一种修复途径,在修复DNA损伤、维持DNA完整性中起着不容忽视的作用,其关键的限速酶为脱嘌呤/脱嘧啶核酸内切酶1(apurinic/apyrimidinic endonuclease 1,APE1)。APE1基因具有DNA修复和氧化还原双重功能,其在多种肿瘤组织和细胞株中均呈过表达,APE1基因功能的异常与恶性肿瘤的发生、发展密切相关[3]。APE1基因中存在多个单核苷酸多态性(single nucleotide polymorphism,SNP)位点,某些位点的突变可能改变APE1的功能,从而导致肿瘤的发生。在美国国立生物技术信息中心(NCBI)的dbSNP数据库中报道的APE1基因中存在的SNP有近20个,多数位于内含子,其最小等位基因频率(minor allele frequency,MAF)大于5%的SNP只有两个,分别是位于启动子区的APE1―141T/G(rs1760944)和位于外显子5的APE1 148Asp/Glu(T1394G,rs1130409)。目前国内外研究较多的是APE1 148Asp/Glu,大多数研究报道其与肺癌易感性不相关,最近也有APE1―141T/G与肺癌易感性的研究报道[4-5],但这两个多态性位点联合作用于肺癌易感性方面的研究还未见报道。因此本研究通过病例对照研究的方法,分析在中国重庆汉族人群中APE1―141T/G、APE1 148Asp/Glu的SNP及其联合作用与肺癌易感性的关系。
1 资料与方法
1.1 一般资料 本组病例对照研究包括455例肺癌患者和443名健康人,所有入选者均为重庆地区汉族人群。病例组选取2007年1月至2008年12月在本院经病理学诊断确诊为肺癌的患者,共455例,无年龄、性别、癌症家族史和临床分期的限制。排除标准包括曾经患有其他癌症病史以及未知的放、化疗病史者。入选患者几乎占到同一时期本院诊断为肺癌患者的95%。对照组随机选取同一时期、同一社区的健康体检者443例,并按年龄、性别与病例组频数配对。此研究经大坪医院伦理委员会批准,并且所有研究对象均签署知情同意书。本研究通过调查问卷形式完成了对每个人的信息收集。问卷内容包括人口学特征(如年龄、性别、癌症家族史)、生活方式(如吸烟支数)和药物治疗史等。吸烟每天超过1支,并持续1年以上或者戒烟少于1年者定义为吸烟者;每天吸烟少于1支、且短于1年者定义为非吸烟者。戒烟超过1年者定义为曾经吸烟者。
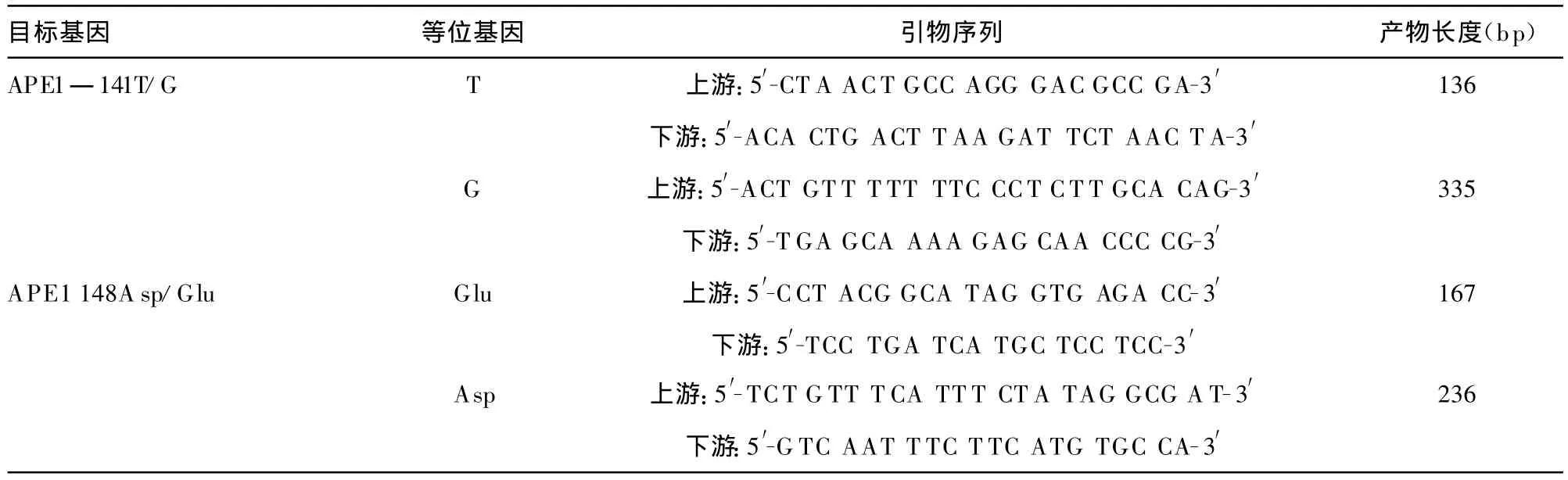
表1 引物序列和产物长度
1.2 样本采集 抽取外周静脉血3 mL,经枸橼酸钠抗凝,于―80℃冰箱保存,常规酚-氯仿抽提法获得外周血白细胞DNA。
1.3 基因分型 采用相对的两对引物-聚合酶链反应技术(polymerase chain reaction with confronting two-pair primers,PCR-CTPP)检测APE1的两个多态性位点APE1―141T/G(rs1760944)以及 APE1 148Asp/Glu(T/G,rs1130409)。本研究针对每条等位基因设计了相应的引物对和产物长度,见表1,等位基因最终通过产物长度来识别。PCR反应体系为25 μ L。 其中模板 DNA 2 μ L,40×Taq-DNA 聚合酶 0.5 μ L,上、下游引物各12.5 pmol,MgCl21.5 mM,5×PCR缓冲液5 μ L,dNTPs 0.30 mM。PCR反应条件为:95℃预变性10 min后,95℃变性1 min,58℃(APE1― 141T/G)或 60℃(APE1 148Asp/Glu)退火1 min,72℃延伸1 min,共30个循环后,72℃继续延伸5 min。2%琼脂糖凝胶电泳鉴定基因型。之后随机选择5%样本进行DNA测序,测序得到的基因型与采用PCR-CTPP技术得到的基因型完全相同,见图1、2。
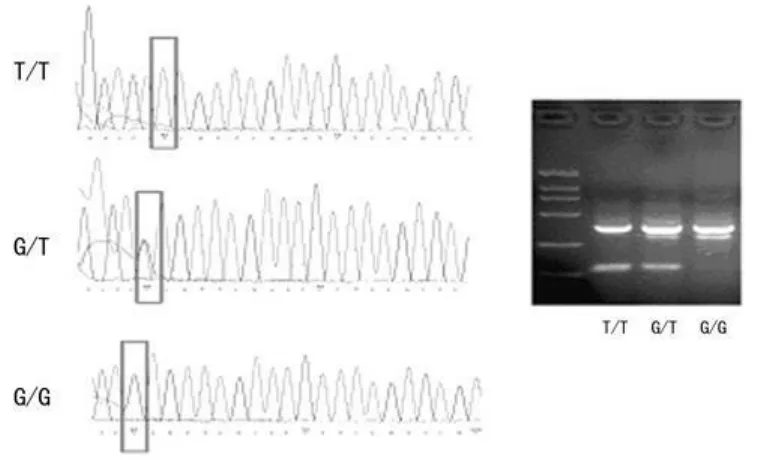
图1 APE1―141T/G琼脂糖电泳及测序结果
1.4 统计学处理 数据统计分析采用SPSS16.0统计软件进行。以χ2检验比较各基因型在病例组与对照组之间的差异,
并应用多元logistic回归模型计算相对风险度的比值比(OR)及其95%可信区间(95%CI),以P<0.05为差异有统计学意义。APE1单倍体重建采用phase软件2.1版。
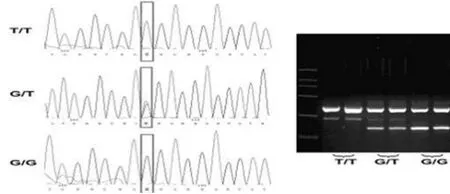
图2 APE1 148Asp/Glu(T/G)琼脂糖电泳及测序结果
2 结 果
2.1 病例组与对照组一般情况的比较 本实验入选对象共898人,见表2,病例组和对照组在性别、年龄、吸烟状态及癌症家族史等方面比较差异均无统计学意义(P>0.05)。经检验对照组基因型频率符合Hardy-Weinberg平衡定律,表明该样本具有群体代表性。
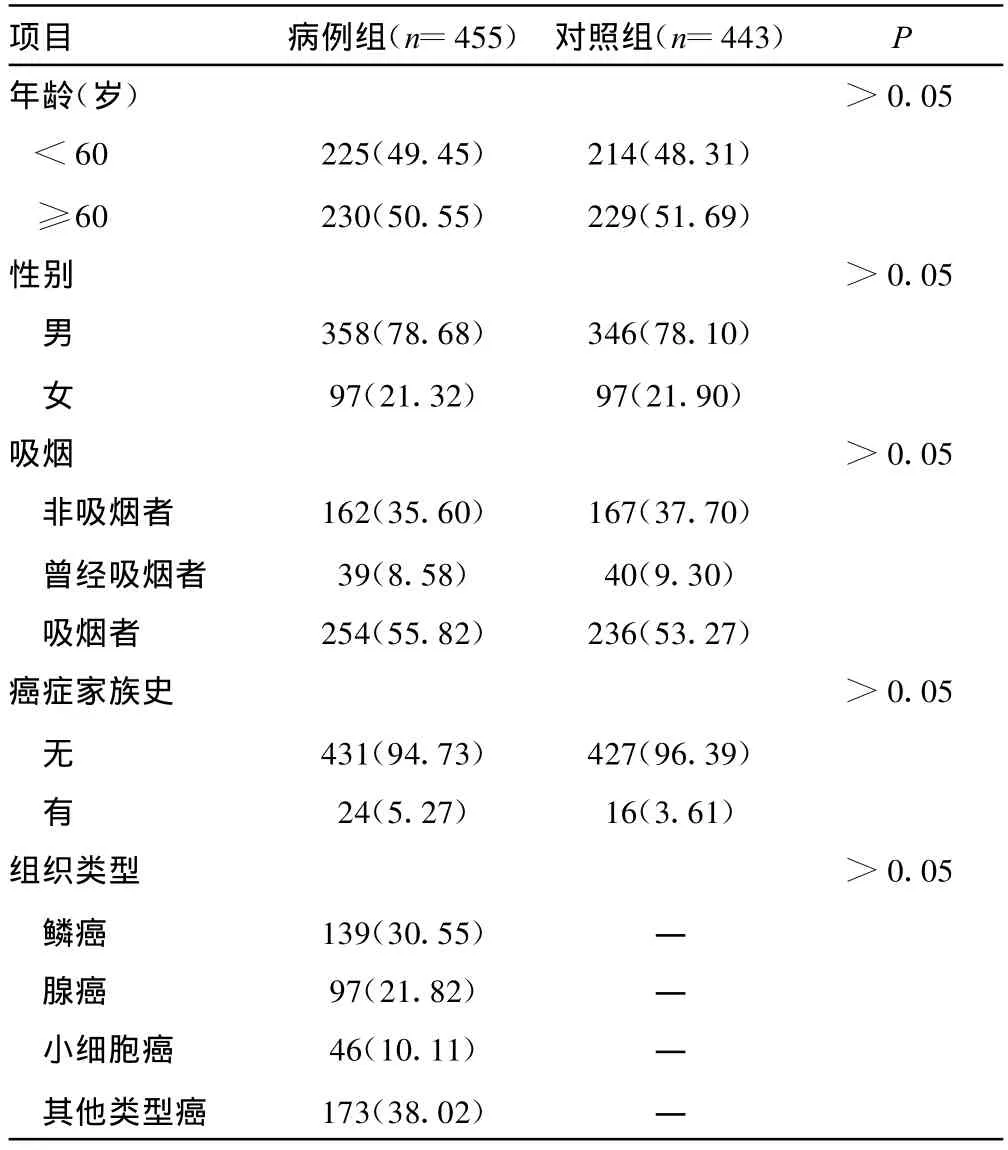
表2 肺癌组及对照组一般情况的比较[n(%)]
2.2 基因型及等位基因分布频率与肺癌患病风险的相关性病例组与对照组APE1基因型及等位基因分布频率见表3。APE1―141G/G相对于T/T基因型,显著减少了患肺癌的风险(OR=0.62;95%CI,0.42~0.91;P=0.02)。进一步 logistic回归分析结果显示,在 APE1―141位点,等位基因G相对于等位基因T,显著降低了患肺癌的风险(OR=0.81;95%CI,0.67~0.98;P=0.03)。与携带 APE1 148Asp/Asp基因型相比,携带APE1 148Glu/Glu基因型的个体并不显著增加患肺癌的风险(OR=1.28;95%CI,0.86~1.91;P>0.05),见表 3、4。

表3 APE1―141T/G基因型及等位基因分布频率与肺癌患病风险的关系
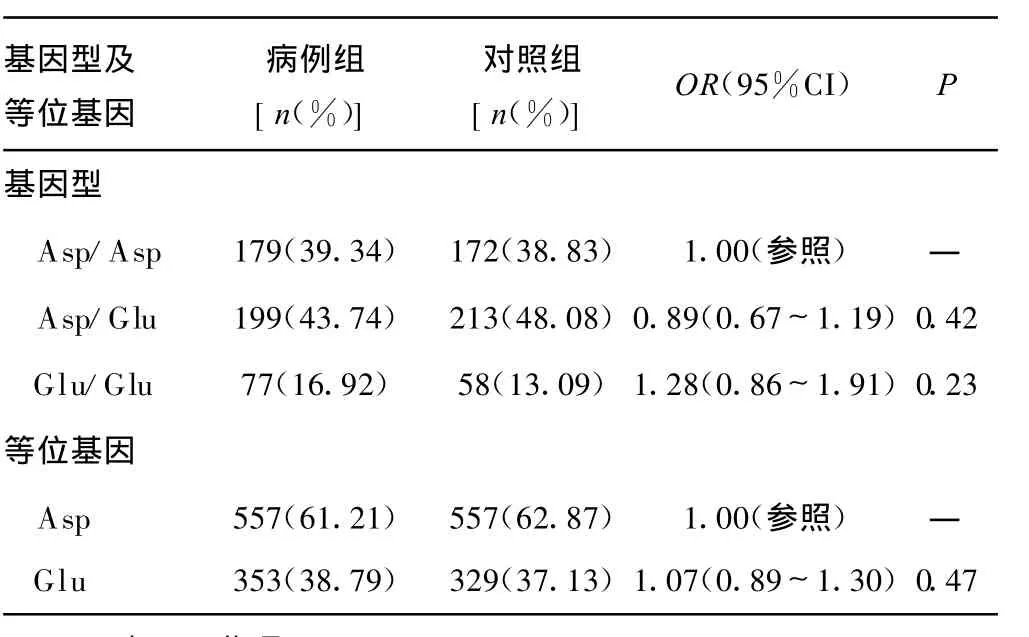
表4 APE1 148Asp/Glu基因型及等位基因分布频率与肺癌患病风险的关系
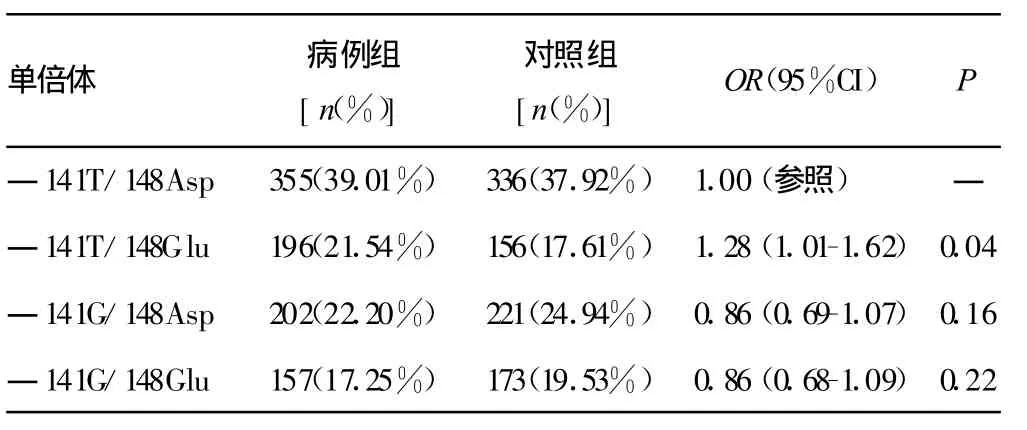
表5 APE1单倍体与肺癌易感性的关系
2.3 APE1单倍体与肺癌患病风险的相关性 为进一步阐明APE1基因多态性与肺癌易感性的关系,本研究用APE1―141T/G和 APE1 148Asp/Glu两个多态性位点构建了4个APE1单倍体,见表5。在这些单倍体中,与最常见的APE1―141T/148Asp单倍体相比,APE1―141T/148Glu单倍体显著增加了患肺癌的风险(OR=1.28,95%CI为1.01~1.62,P=0.04)。
3 讨 论
肺癌是目前中国最常见的恶性肿瘤之一,而且其发病率有逐年增加的趋势,严重影响人类的健康,然而其发病机制尚未完全阐明。目前较一致的观点认为,肺癌的发生是环境危险因素和个体遗传因素共同作用的结果。基因多态性是决定疾病易感性、表型和治疗反应性差异的重要因素,在肺癌的发生、发展中起重要作用。本文通过病例对照研究,对APE1基因单核苷酸多态性与肺癌易感性的关系进行了探讨。
APE1基因,全长2.6 kb,编码318个氨基酸(相对分子质量约为37 kD)。APE1基因是DNA碱基切除修复途径中的关键限速酶,是细胞DNA烷化剂和氧化剂损伤的重要修复因子[6];此外,APE1还能通过氧化还原依赖和非依赖途径,行使氧化还原功能,调节许多转录因子,包括p53、缺氧诱导因子-1α(HIF-1α)、核因子-κ B(NF-kB)等,以及双链复合蛋白(PAX-8)等的DNA结合活性以及相应的特异性目标基因表达,参与细胞内氧化应激反应、细胞周期及凋亡调控等重要作用[7]。
本研究发现 APE1―141G/G基因型相对于T/T基因型,显著减少了患肺癌的风险(OR=0.62;95%CI,0.42~0.91;P=0.02)。Lo等[4]与 Lu等[5]在2009年发表的文章中也得出了相同的结论。APE1―141T/G位于基因启动子区,通常认为启动子区的SNP位点可改变启动子活性,从而调节靶基因的转录,并通过基因表达量的变化而影响其功能。Lo等[4]与Lu等[5]在APE1―141T/G减少患肺癌风险的进一步研究中,却得出了关于APE1―141G/G基因型影响APE1转录活性的不同结论。Lo等[4]认为―141G/G导致APE1转录活性增加,从而增加了APE1的修复能力。这一观点似乎合理,因为APE1在碱基切除修复途径中发挥核心作用,主要修复与人类癌症风险相关的大量细胞毒素和突变引起的碱基损伤[8]。APE1修复能力增加,将修复更多的受损碱基,以确保细胞的完整性,使患肺癌的风险减少。而Lu等[5]则认为―141G/G导致APE1转录活性降低,从而降低了APE1的修复能力。这一观点的理由是若当DNA损伤范围较广,超过了细胞的自我修复能力,通过凋亡来清除受损细胞,相对于不完善的DNA修复将是更好的选择[9]。因此他们认为,对于无法修复的DNA损伤,DNA修复基因的高表达反而会抑制细胞凋亡,使缺陷细胞增加,进而增加患癌症的风险。所以APE1转录活性的降低,降低了 APE1修复能力,增加了细胞凋亡,从而使患癌症的风险减少。以上两个实验结果不同的原因可能是双方选择不同肺癌细胞株造成的。然而关于APE1基因的功能改变与肺癌易感性的关系,还有待于进一步研究。
APE1 148Asp/Glu单核苷酸多态性由碱基T突变成碱基G,可导致单个氨基酸的替换(Asp突变成Glu)[10],其与肺癌易感性的关系已被广泛研究,但结果却不一致[11-15]。迄今为止报道的APE1 148Asp/Glu与患肺癌风险关系的流行病学研究中,仅在日本的吸烟者与不吸烟者中有显著的相关性[13]。而其他大多数的研究中,两者没有显著相关性[14-15]。本研究也表明APE1 148Asp/Glu与肺癌易感性无显著相关。
对于遗传易感因素来说,每个多态性位点的存在对于疾病的发生与发展并不只是起到一个孤立的作用,其相互之间亦存在一定的内在关联与作用,单倍体则是这种遗传关联的体现,所以对于单倍体的研究更易于揭示多个SNP与疾病易感性的关联[16]。在本研究中,两个多态性位点共构建了4种单倍体。其中相对于―141T/148Asp单倍体,―141T/148Glu单倍体显著增加了患肺癌的风险(OR=1.28,95%CI,1.01~1.62,P=0.04),表明―141位点为 T时,148位点由Asp突变到Glu,将导致―141T/148Glu单倍体患肺癌风险增加,可能表明APE1 148Asp/Glu增加患肺癌的易感性。本研究结果同时提示APE1单倍体型―141T/148Glu对于中国重庆汉族人群肺癌的发生可能是重要的遗传易感因素,而关于这两个位点单倍体型与APE1基因功能的关系尚值得进一步研究。
本研究对APE1―141T/G、148Asp/Glu SNP位点与肺癌易感性的关系进行了初步分析,研究结果证明,APE1基因与中国重庆汉族人群的肺癌具有相关性。携带 APE1―141G/G基因型的个体相对于携带APE1―141T/T的个体,明显减少患肺癌的风险。APE1―141T/148Glu单倍体可能是肺癌的重要遗传易感因素。但是由于SNP在肺癌易感性方面的低外显率,不能确定是由单一SNP本身还是与此SNP在同一单倍体上的其他未知位点共同决定或参与了肺癌的易感性,要解决这一问题,还有待于进一步扩大样本量、增加对APE1基因的其他SNP检测,并结合功能研究来验证APE1基因对肺癌的作用。
[1]Kurzepa-Hasan E,Hasan K,Adamek R.Tobacco smoking among population in the United Kingdom of Great Britain and Northern Ireland between years:1950 and 2003[J].Przegl Lek,2008,65(10):740-741.
[2]Andersson U,McKean-Cowdin R,Hjalmars U,et al.Genetic variants in association studies--review of strengths and weaknesses in study design and current knowledge of impact on cancer risk[J].Acta Oncol,2009,48(7):948-954.
[3]Tudek B.Base excision repair modulation as a risk factor for human cancers[J].Mol Aspects Med,2007,28(3-4):258-275.
[4]Lo YL,Jou YS,Hsiao CF,et al.A polymorphism in the APE1 gene promoter is associated with lung cancer risk[J].Cancer Epidemiol Biomarkers Prev,2009,18(1):223-229.
[5]Lu J,Zhang S,Chen D,et al.Functional characterization of a promoter polymorphism in APE1/Ref-1 that contributes to reduced lung cancersusceptibility[J].FASEB J,2009,23(10):3459-3469.
[6]Demple B,Sung JS.Molecular and biological roles of Ape1 protein in mammalian base excision repair[J].DNA Repair,2005,4(12):1442-1449.
[7]Tell G,Damante G,Caldwell D,et al.The intracellular location of APE1/Ref-1:more than a passive phenomenon[J].Antioxidants and Redox Signaling,2005,7(3):367-384.
[8]Hung RJ,Hall J,Brennan P,et al.Genetic polymorphisms in the base excision repair pathway and cancer risk:a HuGE review[J].Am J Epidemiol,2005,162:925-942.
[9]El-Domyati M,Attia S,Saleh F,et al.Proliferation,DNA repair andapoptosis in androgenetic alopecia[J].J Eur Acad Dermatol Venereol,2009,23(1):7-12.
[10]Xi T,Jones IM,Mohrenweiser HW.Many amino acid substitution variants identified in DNA repair genes during human population screenings are predicted to impact protein function[J].Genomics,2004,83:970-979.
[11]Hung RJ,Brennan P,Canzian F,et al.Large-scale investigation of base excision repair genetic polymorphisms and lung cancer risk in a multicenter study[J].J Natl Cancer Inst,2005,97:567-576.
[12]Kiyohara C,Takayama K,Nakanishi Y.Association of genetic polymorphisms in the base excision repair pathway with lung cancer risk:a meta-analysis[J].Lung Cancer,2006,54:267-283.
[13]Ito H,Matsuo K,Hamajima N,et al.Gene-environment interactions between the smoking habit and polymorphisms in the DNA repair genes,APE1 Asp148Glu and XRCC1 Arg399Gln,in Japanese lung cancer risk[J].Carcinogenesis,2004,25:1395-1401.
[14]Shen M,Berndt SI,Rothman N,et al.Polymorphisms in the DNA base excision repair genes APEX1 and XRCC1 and lung cancer risk in Xuan Wei,China[J].Anticancer Res,2005,25:537-542.
[15]Ryk C,Kumar R,Thirumaran RK,et al.Polymorphisms in the DNA repair genes XRCC1,APEX1,XRCC3 and NBS1,and the risk for lung cancer in never-and eversmokers[J].Lung Cancer,2006,54:285-292.
[16]Kim KJ,Lee HJ,Park M H,et al.SNP identification,linkage disequilibrium,and haplotype analysis for a 200-kb genomic region in a Korean population[J].Genomics,2006,88:535-540.
Association of single nucleotide polymorphism of APE1 gene with susceptibility to lung cancer*
Li Zheng,Li Mengxia,Liao Ling,Wang Dong△
(Cancer Center,Daping Hospital and Research Institute of Surgery,Third Military Medical University,Chongqing 400042,China)
ObjectiveTo explore the genetic association between the single nucleotide polymorphism(SNP)of APE1 gene and the susceptibility to lung cancer among Chinese Han people in Chongqing.MethodsA population based case control study was conducted in 443 healthy controls and 445 lung cancer patients.The SNP of APE1―141T/G and APE1148Asp/Glu were detected by polymerase chain reaction with confronting two-pair primers(PCR-CTPP).ResultsFor the APE1―141T/G polymorphism,individuals with G/G genotype significantly decreased the risk of developing lung cancer compared with those harboring T/T genotype(OR=0.62;95%CI,0.42―0.91)and APE1―141T/148Glu haplotype markedly increased the risk,compared to―141T/148Asp haplotype(OR=1.28;95%CI:1.01―1.62),according to haplotype analysis.ConclusionThis study confirms the close relationship between APE1 gene and Lung cancer.APE1―141T/148Glu haplotype may serves as an important genetic susceptibility factor for lung cancer.
lung neoplasm;apurinic/apyrimidinic endonuclease 1;single nucleotide polymorphism
10.3969/j.issn.1671-8348.2011.06.003
A
1671-8348(2011)06-0528-04
国家自然科学基金资助项目(30670628)。△< class="emphasis_bold">通讯作者,
,Tel:(023)68757151;E-mail:dongwang64@hotmail.com。
2010-05-09
2010-09-22)
·临床研究·
