反转录巢式多重聚合酶链式反应体系检测单细胞中时钟基因表达
2011-01-25袁艳鹏关云谦林庆玲薛金花蔡彦宁
袁艳鹏 关云谦 林庆玲 薛金花 蔡彦宁*
(1.首都医科大学宣武医院神经生物学研究室,北京 100053;2.首都医科大学宣武医院细胞治疗室,教育部神经变性病重点实验室,北京 100053)
昼夜节律的产生依赖于时钟基因间在“转录-翻译-翻译后加工”水平相互作用而形成的负反馈环路。其核心涉及 bmal1,clock,npas2,cry1,cry2,per1,per2,per3等多个时钟基因[1-3]。clock(或 npas2)和 bmal1翻译后产物能够形成 clock/bmal1异源二聚体,结合于时钟基因 per(per1、per2和 per3)和 cry(cry1和 cry2)的启动子区,激活其转录,为正向调节因子;转录后的 per1、per2和 cry1、cry2在细胞质中得到翻译,继而形成 per/cry复合体转位返回细胞核,通过直接相互作用,干扰 clock/ bmal1异源二聚体的转录活性,充当反向调控因子从而抑制 per和 cry自身的转录,由此形成负反馈调节环路[4-5]。由此,时钟基因间构成环路,产生并维持了表达、生理以及行为学水平的昼夜波动。
时钟基因广泛表达于多种组织、器官,甚至永生化细胞系中。其表达丰度常呈昼夜波动。但时钟基因是否表达于每个细胞中?不同细胞中波动时相是否相同?这些问题仍有待回答。为此,本研究建立了一种基于反转录巢式多重 PCR的、高度灵敏的、能够在单细胞水平检测多种时钟基因表达的体系,成功检测到单细胞水平时钟基因的表达情况。
1 材料和方法
1.1 材料
主要试剂:SuperScript.Ⅲ First-Strand Synthesis System for RT-PCR RNA抽提试剂 TR Izol,0.25%胰蛋白酶 (美国 invitrogen公司);Qiagen○RMultiplex PCR Kit(德国 Qiagen公司);PCR MasterMix,Riboprobe○Rin vitro Transcription Systems(美国 Promega公司); Transcript RNA clean up kit,SYBR Green Master Mix (日本 TaKaRa公司);DMEM(Dulbecco’s modified eagle’smedium,high glucose);胎牛血清 FBS;内外侧引物(引物序列见表 1)及 T7正向引物 (上海生物工程公司合成)。
仪器和耗材:PTC-100PCR仪,实时定量 PCR仪(美国MJ research公司);MM-33手动显微操纵器 (美国WPI公司);紫外分光光度计(美国 GE公司);细胞培养皿(美国 Corning公司);玻璃电极 (中国医学科学院提供)。
1.2 方法
1.2.1 N I H/3T3细胞培养
细胞培养的具体方案详见文献[6]:以1×106个N I H/3T3细胞接种在直径10 cm的普通培养皿中,加入8~10 mL含 10%FBS的DME M培养基,2 d换液 1次,直至细胞生长覆盖培养皿的 90%~100%,用0.25%胰蛋白酶消化细胞,得到单细胞悬液。高浓度血清 50% FBS刺激铺满培养皿的细胞分别持续 24 h和 36 h[7]。

表1 时钟基因及内参基因引物序列、扩增长度Tab.1 Pr im er sequence and amplicon size of clock genes and housekeeping gene
1.2.2 N I H/3T3单细胞及群体细胞的获取
胰酶消化后的单细胞悬液稀释至 50~100个细胞/10 cm培养皿。在显微镜监测下,使用手动显微操纵器移动玻璃电极接近目的细胞,给予一定的负压将悬浮的细胞吸进电极内,取下电极将尖端折断进 0.2 mL PCR管内,电极吸入无细胞培养基作为阴性对照[8]。将高血清刺激后的细胞用 0.25%胰蛋白酶消化后收集到 15 mL离心管内离心弃上清,得到约 5× 106群体细胞。
1.2.3 体外转录制备基因 RNA模板
以各基因质粒为模板,使用外侧反向引物与带 T7的正向引物,扩增出带 T7的各基因片段。按照使用说明书,应用 Riboprobe○Rin vitro Transcription Systems制备相应 RNA模板,并使用 Transcript RNA clean up kit纯化 RNA模板。
1.2.4 单细胞反转录
7种基因外侧反向引物等浓度混合为 GSP引物(gene specific primer),每种基因引物浓度为 2μmol/ L。在含单细胞的 PCR管中,加入 GSP引物,dNTP (10 mmol/L)各 0.5μL,加水至 5μL,混匀。65℃孵育 5 min,按照操作手册加入 superscriptⅢ反转录酶[9]及 RNAase out、10×缓冲液、MgCl2和 DTT进行反转录,得到 10μL cDNA产物。
1.2.5 群体细胞 RNA获取及反转录
应用 TR Izol对群体细胞进行 RNA抽提,检测RNA完整性良好进行反转录,与单细胞反转录过程相同,不再赘述。
1.2.6 巢式多重 PCR体系扩增条件
巢式外侧多重 PCR扩增:反应体系25μL,7对基因外侧引物等浓度混合,终浓度 0.1μmol/L,2×Qiagen○RMultiplex PCR MasterMix 12.5μL,预变性 95℃15 min,3步扩增法 94℃ 30 s,57℃ 3 min,72℃1 min,15个循环[10],循环后增加延伸 72℃10 min。
巢式内侧单重 PCR扩增:反应体系 20μL,取外侧扩增产物 1μL为模板,引物终浓度为 0.5μmol/L, 2×Promega PCRMasterMix 10μL,预变性 95℃10 s, 3步扩增法 95℃5 s,58℃12 s,72℃12 s,35个循环。群体水平巢式内侧单重 PCR扩增换用 SYBR GreenMasterMix,余试剂及步骤相同。
1.2.7 扩增产物检测
单细胞水平结果应用 2%琼脂糖凝胶电泳及测序双重检测扩增条带。群体水平应用实时定量 PCR检测体系Opticon monitorⅡ检测。
1.3 统计学方法
所有数据均应用 SPSS 11.5统计学软件处理,不同组间表达差异比较采用单因素方差分析。P<0.05为差异有统计学意义。
2 结果
2.1 巢式 PCR外、内侧扩增产物凝胶电泳
使用小鼠肝脏 cDNA为模板,使用各基因内、外侧引物进行扩增。电泳显示扩增出预期目的条带(图1),清晰、单一、无非特异条带。扩增产物克隆入 pGMT载体,得到相关质粒,测序证实序列正确无误 (结果未示)。
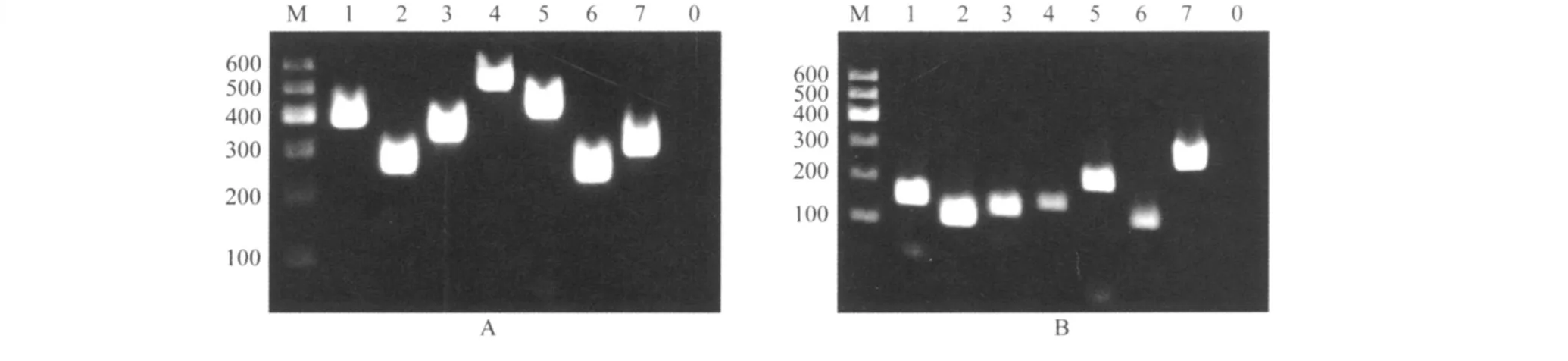
图1 特异性引物扩增出时钟基因外、内侧单一条带Fig.1 Single band of clock genes amplification w ith specific pr im ersA:gel electrophoresis of external PCR products;B:gel electrophoresis of internal PCR products;M:indicatesDNA marker; 1:actin;2:bmal1;3:clock;4:cry1;5:cry2;6:per1;7:per;0:negative control.
2.2 巢式多重 PCR检测体系灵敏度检测
使用紫外分光光度计定量各种质粒。混合稀释至所需浓度,用于灵敏度分析。对于每个基因,分别使用 10、5、1个拷贝质粒为模板,进行 10个巢式 PCR扩增。如表 2,10或 5拷贝的各种基因均可得到100%检测。1拷贝的 actin,bm al1,clock,per1,per2能够得到 100%的检测。1拷贝的 cry1检出率为 80%, cry2检出率为 90%。
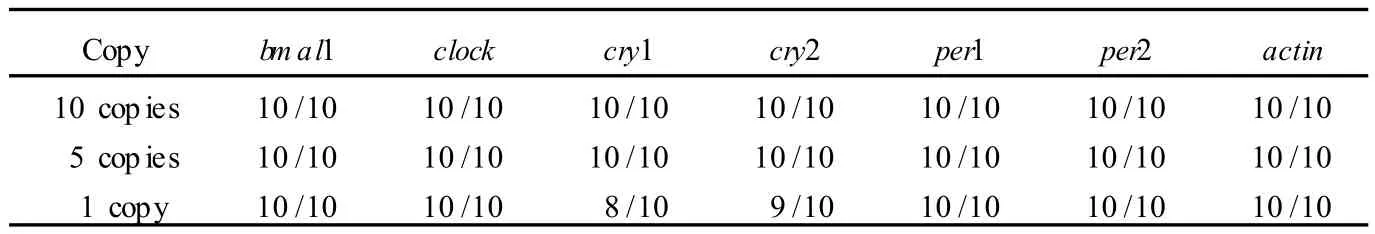
表2 巢式多重 PCR检测体系 DNA水平灵敏度Tab.2 DNA sensitivity of nested multiplex PCR
2.3 反转录巢式多重 PCR灵敏度检测
在单个细胞中检测基因表达,需要先将细胞中的mRNA反转录为 cDNA。为了 能在评估灵敏度时将反转录也纳入考量,为此我们体外合成了各基因的RNA模板,电泳显示 RNA完整(结果未示)。使用紫外分光光度计定量各种 RNA浓度,混合稀释至所需浓度。分别使用 20、10、4个拷贝 RNA为起始模板,进行反转录和巢式多重 PCR扩增。如表 3所示,4个RNA拷贝的 cry2其检出率达到 80%,其他基因均达到100%。
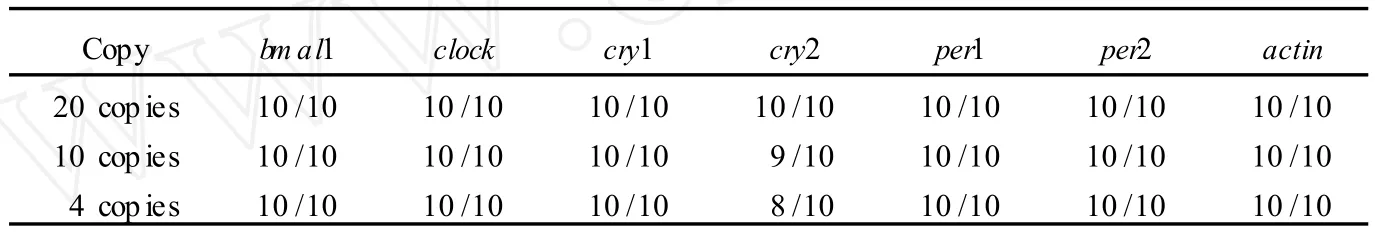
表3 巢式多重 RT-PCR检测体系RNA水平灵敏度Tab.3 RNA sensitivity of nested multiplex RT-PCR
2.4 N IH/3T3单细胞时钟基因检测结果
使用显微操作器,分别取出 10个单个 N I H/3T3细胞。细胞获取过程如图 2所示。对 10个单细胞及随机的单细胞混合进行反转录多重巢式扩增,结果见表 4,每个细胞中时钟基因表达谱差异明显。

图2 显微镜下单个目的细胞的获取Fig.2 Co llecting single cellw ith m icroscope(10×)A:Glass electrode approaching the target cell;B:Single cell disappeared from the medium;C:Single cell in the glass electrode;Arrow points to single cell(magnification 10×).
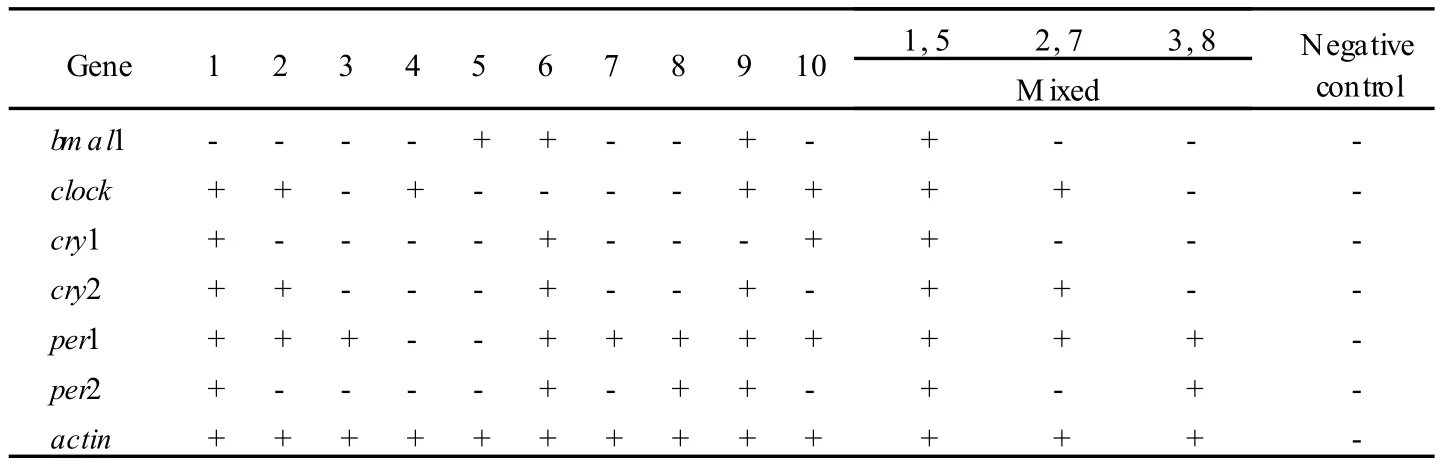
表4 10个单细胞中时钟基因检测结果Tab.4 10 single cell results of clock genes
2.5 per1和 per2基因在群体水平和单细胞水平的表达差异
为了分析群体水平和单细胞水平是否存在差异。本研究利用实时定量 PCR和巢式多重RT-PCR分别研究了N I H/3T3细胞在群体和单细胞水平,时钟基因per1和 per2在其表达高峰和低谷的表达。群体水平per1和 per2的表达量设定为 100%,相应低谷表达量分别为28.5%和 17.1%。高峰与低谷间差异均有统计学意义(P<0.001)。在单细胞水平,per1表达高峰时阳性细胞率为 84.8%;表达低谷时阳性细胞率为 74.3%,差异无统计学意义 (P=0.128)。单细胞水平,per2表达高峰时阳性细胞率为 72.7%;表达低谷时阳性细胞率为 40.0%,差异有统计学意义(P<0.001)。
3 讨论
近年来,单细胞中基因表达的解析日益受到重视。同质细胞群体中的不同单细胞个体,其功能、结局却千差万别,这种差异是由不同细胞个体中的基因表达决定的。尽管众多时钟基因在组织、器官、细胞群体中的表达得到了广泛的关注和研究,但针对单个细胞的研究仍然缺乏。为此,本研究建立了一种基于巢式多重PCR的、高度灵敏的、能够在单细胞水平检测多种时钟基因表达的体系。结果显示,该体系能够检出单拷贝DNA的各种时钟基因。为了将反转录的因素也纳入考量,我们还体外合成了不同时钟基因的 RNA模板。结果显示该体系能够检出至少4拷贝RNA的各种时钟基因。将此体系应用于N I H/3T3细胞,成功地分析了单个细胞中时钟基因的表达。该体系可以应用于诸多领域,并回答相应的生物学问题。如 Alvarez J D等[11]发现,时钟基因在睾丸和胸腺组织中的表达不发生昼夜波动。组织化学分析显示 per1和 clock并不在同一细胞中共表达。因此认为,非共表达的时钟基因不能形成相互调控的网络,从而阻碍了表达的昼夜波动。最近,Yagita K等[12]和 Kowalska E等[13]分别发现,胚胎干细胞中时钟基因的表达也呈恒定状态,再次提出非共表达的时钟基因不能形成相互调控的网络而阻碍了表达的昼夜波动的可能性。作为一种高度灵敏的检测手段,本研究方法将能最终检验上述理论的正确与否。利用此体系,我们还初步比较了群体水平和单细胞水平 per1和 per2在不同时相的表达,结果显示群体水平per2的昼夜波动伴随着单细胞水平的阳性细胞的减少,而 per1则无此特点。提示两者表达调控上的差异。
在所检测的 10个 N IH/3T3细胞中,时钟基因表达谱差异有统计学意义。提示不同细胞间节律的非同步化。这一结论尚有待检测更多的单细胞加以验证。bm al1和 clock能够形成异源二聚体,是一对功能伙伴。per1和 per2、cry1和 cry2也分别构成功能对。研究[14-16]表明,只有 per1和 per2或 cry1和 cry2同时敲除掉,小鼠才彻底丧失节律。但各个功能对中基因两两表达是否相似,一直没有定论。通过检测单个N IH/3T3细胞,我们发现,功能对中两基因表达差异有统计学意义。
总之,本实验建立了高灵敏度的巢式多重 PCR检测体系并成功地用于单细胞中时钟基因表达的检测,揭示了单细胞水平时钟基因环路的异质性。
[1] Okamura H,Yamaguchi S,Yagita K.Molecularmachinery of the circadian clock in mammals[J].Cell Tissue Res, 2002,309:47-56.
[2] Ebisawa T.Circadian rhythms in the CNS and peripheral clock disorders:human sleep disorders and clock genes [J].J Pharmacol Sci,2007,103:150-154.
[3] Mignot E,TakahashiJ S.A circadian sleep disorder reveals a complex clock[J].Cell,2007,128:22-23.
[4] Leloup J C,Goldbeter A.Modeling the circadian clock:from molecular mechanis m to physiological disorders[J]. Bio Essays,2008,30:590-600.
[5] Yamazaki S,Numano R,Abe M,et al.Resetting central and peripheral circadian oscillators in transgenic rats[J]. Science,2000,288:682-685.
[6] Balsalobre A,Damiola F,Schibler U.A serum shock induces circadian gene expression inmammalian tissue culture cells[J].Cell,1998,93:929-937.
[7] Allen G,Rappe J,EarnestD J,et al.Oscillating on borrowed time:diffusible signals from immortalized suprachias matic nucleus cells regulate circadian rhythmicity in cultured fibroblasts[J].J Neurosci,2001,21:7937-7943.
[8] 关云谦,蔡彦宁,谢淑,等.利用巢式聚合酶链反应检测单个胚胎小体细胞中时钟基因的表达[J].基础医学与临床,2006,26:1313-1318.
[9] BengtssonM,HembergM,Rors man P,et al.Quantification ofmRNA in single cells and modelling of RT-qPCR induced noise[J].BMCMolBiol,2008,9:63-73.
[10]Peixoto A,Monteiro M,Rocha B,et al.Quantification of multiple gene expression in individual cells[J].Genome Res,2004,14:1938-1947.
[11]Alvarez J D,Chen D,Storer E,et al.Non-cyclic and developmental stage-specific expression of circadian clock proteins during murine spermatogenesis[J].Biol Reprod, 2003,69:81-91.
[12]Yagita K,Horie K,Koinuma S,et al.Development of the circadian oscillator during differentiation ofmouse embryonic stem cells in vitro[J].ProcNatlAcad SciU SA,2010, 107:3846-3851.
[13]Kowalska E,Moriggi E,Bauer C,et al. The circadian clock starts ticking at a developmentally early stage[J].J Biol Rhythms,2010,25:442-449.
[14]Viswambharan H,Carvas J M,Antic V,et al.Mutation of the circadian clock gene Per2 alters vascular endothelial function[J].Circulation,2007,115:2188-2195.
[15]Anea C B,ZhangM,Stepp D W,et al.Vascular disease in mice with a dysfunctional circadian clock[J].Circulation,2009,119:1510-1517.
[16]Turek FW,Joshu C,Kohsaka A,et al.Obesity and metabolic syndrome in circadian clock mutant mice[J].Science,2005,308:1043-1045.
