第43届国际食品添加剂法典委员会会议概况
2011-01-25樊永祥,田静,刘秀梅

樊永祥 田 静 刘秀梅中国疾病预防控制中心营养与食品安全所
第43届国际食品添加剂法典委员会会议于2011年3月14~18日在厦门召开。来自54个法典成员国、1个成员组织(欧盟)及27个国际非政府组织的200余名代表参加了会议。中国工程院院士陈君石作为国际食品添加剂法典委员会主席主持会议。



卫生部食品安全综合协调与卫生监督局陈锐副局长到会并代表陈啸宏副部长致辞。他强调中国政府历来高度重视食品安全工作,当前正在通过完善食品安全监管制度、开展食品安全整顿工作、加快食品安全国家标准体系建设、加强食品安全技术能力建设、加强国际合作,积极参与国际食品安全网络等一系列措施强化食品安全工作。并表示中国愿意积极参与国际食品安全事务,与世界各国一道,在推进国际食品安全、贸易和技术合作方面发挥作用,为维护全球人民的健康做出努力。
会议议程
此次会议共包括12项议题,涉及22项具体事宜。为了在有限的时间内完成所有议题的讨论,会议于11~12日召开了国际食品添加剂法典通用标准(GSFA)的实际工作组会议,由工作组组长,美国的Dennis Keefe博士主持进行了逐项讨论。会议期间组织召开了三个会间工作组会议,包括审查通过其他分委员会提交的标准文本中的添加剂条款(澳大利亚牵头);食品添加剂国际编码系统(芬兰牵头);JECFA优先评估的添加剂名单(加拿大牵头)。全体会议期间讨论的议题如下:
(1)通过议程(议题1);
(2)由食典委大会和其他法典委员会及特设工作组提出的事宜(议题2);
(3)FAO/WHO及第73届JECFA会议提出的事项(议题3);
(4)审查通过其他分委员会提交的标准文本中的添加剂条款(议题4a);
(5)婴幼儿配方食品及特殊医用膳食类食品中添加剂的使用(议题4b);
(6)肉类食品标准中添加剂条款与GSFA的一致性工作(议题4c);
(7)食品添加剂法典通用标准(GSFA)相关条款的修订(议题5a,5b,5c);
(8)含铝食品添加剂规定(议题5d);
(9)食品分类体系5.1,5.2和5.4的拟议修订草案(议题5e);
(10)食品分类16.0的名称及描述的修订(议题5f);
(11)注释161使用的讨论稿(议题5g);
(12)GSFA前言第4节“食品添加剂带入原则“修订的讨论稿(议题5h);
(13)食品级盐标准(CODEX STAN 150-1995)的拟议修订草案(议题6);
(14)食品添加剂国际编码系统(INS)(议题7);
(15)来自第73届JECFA会议食品添加剂特性和纯度的质量规格标准(议题8);
(16)JECFA优先评估的添加剂名单(议题9a);
(17)JECFA再评估物质机制讨论稿(议题9b);
(18)建立加工助剂数据库的讨论稿(议题10);
(19)其他事宜和未来工作(议题11);
(20)下届会议的时间和地点(议题12)。
主要议题进展情况
婴幼儿配方食品及特殊医用膳食类食品中添加剂的使用
营养与特殊膳食法典委员会(CCNFSDU)就婴幼儿配方食品及特殊医用膳食类食品中添加剂的使用问题请本委员会进行讨论。委员会基于瑞士提供的讨论文本进行了讨论。讨论同意以下结论:
(1)JECFA1971年建立的原则“婴幼儿食品的生产应当尽可能不使用食品添加剂。当必须使用时,在选择添加剂的品种及设定用量时需非常谨慎”仍然适用。
(2)由于12周以下小婴儿的特殊性,申请在这类人群食品中使用添加剂的请求应由JECFA进行个案评估。JECFA依据EHC240和EHC70建立的评估原则和方法进行评估。
(3)委员会没有通过CCNFSDU提交审查的添加剂名单,建议请CCNFSDU进一步研究。
肉类食品标准中添加剂条款与GSFA的一致性工作
针对商品标准中添加剂条款和GSFA相关条款的一致性问题,委员会对澳大利亚牵头电子工作组提出的决定树的工作模式进行了讨论。讨论同意采用决策树的模式推进协调工作,目标是在确保添加剂的安全使用和技术必要性的前提下,使得GSFA成为法典标准中添加剂使用的唯一参考标准。委员会同意由澳大利亚继续牵头建立电子工作组,就这一问题开展工作。
GSFA相关条款的修订
在会前举行GSFA工作会议上,工作组讨论了第42届CCFA未能讨论的添加剂名单,包括:八种色素胭脂红4R(胭脂虫红 A)(Ponceau 4R (Cochineal Red A))(INS124)、角黄素(Canthaxanthin)(INS161g)、焦糖色III –氨法(Caramel III – ammonia process)(INS150c)、焦糖色IV –亚硫酸氨法(Caramel IV– ammonia sulfite process)(INS150d)、β-胡萝卜素(Carotenes, beta(vegetable))(INS160a(ii))、类胡萝八素(Carotenoids)(INS160(i),160(iii),160e,160f)、赤藓红(Erythrosine)(INS127)、葡萄皮提取物(Grape skin extract)(INS163(ii))。工作组还提交了对于以下添加剂使用要求的讨论建议,供GSFA工作组会议讨论。四种添加剂包括:月桂酸精氨酸乙酯(lauric arginate ethyl ester) (INS 243)、甜菊糖甙(steviol glycosides) (INS 960)、亚硫酸盐(sulfites) (INS 220-225, 227, 228,539)、赤藓红(erythrosine) (INS127)。
委员会讨论通过了工作组会议提出的通过审查、终止工作、取消条款、进一步征求意见的建议。
欧盟等代表团出于本地区评估结果和技术必要性原因考虑,对于相关食品类别中使用角黄素、焦糖色等色素以及使用甜菊糖甙、月桂酸精氨酸乙酯的相关条款持保留意见。JECFA代表解释了基于JECFA的评估结果,相关添加剂的使用均不会导致安全问题。
GSFA中含铝添加剂的相关条款
鉴于JECFA对于铝的风险评估现实由于含铝添加剂的使用可能导致铝的膳食暴露过高,第42届CCFA成立了由巴西牵头的电子工作组,对GSFA中含铝添加剂的相关条款进行讨论。委员会讨论了电子工作组提出的各项建议,并做出以下结论:
(1)委员会同意所有含铝添加剂在GSFA中应为具体的使用限量,表示为“以铝计”,并取消所有按生产需要适量使用(GMP)的添加剂条款。鉴于本次会议并未提出具体的修改数值,委员会同意在下届会议决定取消或者终止相关工作事宜。
(2)委员会同意提请第34届大会取消硅酸铝钠(INS554)、硅酸铝钙(INS556)以及硅酸铝(INS559)在GSFA表三中的条款。
委员会同意成立由巴西牵头的电子工作组,对GSFA中涉及含铝添加剂的条款进一步征求意见。
修改食品分类5.1、5.2和5.4
第42届CCFA成立了由美国牵头的电子工作组,对糖果巧克力类食品项下的食品分类5.1、5.2和5.4名称及表述进行修订。经过讨论,委员会通过了相关修订建议,详细内容见会议报告。委员会同意将修改后的食品分类内容提交第34届大会通过。
修改食品分类16.0
第42届CCFA对食品分类中16.0“复合型食品,1.0-15.0类别未能包含的食品”存在合理性及表述进行了讨论,但没有达成一致意见。本次会议对这一问题继续进行讨论,部分意见认为,这一食品类别表述不清楚,会导致其涵盖的食品范围过宽从而导致食品添加剂的滥用;部分意见认为,鉴于1-15类别不能完全涵盖目前市场的所有食品类型,仍有必要设定这一分类。
委员会最终未就这一问题达成一致意见。委员会同意成立由美国牵头的电子工作组,继续就16.0类别设置与否、如何表述名称等征集意见。
GSFA中注释161问题
在第41届CCFA会议上,委员会同意就注释161“取决于进口国的规定,并于GSFA前言3.2部分相一致”的合理性与否、如何使用这一注释进行讨论。42届CCFA成立了由荷兰牵头的电子工作组就这一问题进行讨论。
委员会就工作组提出的讨论内容继续进行了讨论,但仍未达成一致意见。一些成员国的观点是有必要使用注释161,但需要尽可能地限制其使用,需要逐一考虑;另一些成员国的观点是反对使用注释161,建议将其从GSFA中删除,因为其使用可能会产生国际贸易壁垒,会对法典的协调一致及科学基础的价值产生不良影响。最终,委员会同意成立由南非牵头的电子工作组,对注释161的适用性继续讨论。工作组的讨论重点放在GSFA前言3.2部分的应用及对相关条款的分析上。
带入原则
由于原法典标准汇编第一卷中“食品添加剂带入原则”与GSFA前言第4部分中带入原则存在不同,第42届CCFA成立了由巴西牵头的电子工作组对GSFA前言部分进行修订。委员会讨论了电子工作组提出的建议,并同意对带入原则涉及由原料、配料等带入添加剂的表述文本进行修改。委员会同意请CCNFSDU进一步明确食品类别13.1、13.2不适用于带入原则及相关商品标准中涉及婴幼儿食品不适用于带入原则的情况。委员会同意将修改后的文本提交第34届大会通过。
委员会同意成立由美国牵头的实体工作组,在下次委员会会议前对上述涉及GSFA的相关遗留内容及需要继续工作的内容进行讨论。
焰火渠村外,牌坊下,官道上,齐刷刷站着两队人马。秦铁崖一行离牌坊尚有几十步,就听队前一人高声道:“我乃李太嶂,江湖人称呼啸山君,今日得见搜神手秦大人,实乃幸事。”
对食用盐法典标准的修订
委员会对食用盐法典标准修订稿进行了讨论,修订稿对污染物、分析采样方法等内容进行了修订。委员会同意将修订后的标准提交第34届大会在第5步通过,并提交采样与分析方法委员会(CCMAS)通过修订后的分析方法。
国际编码系统
委员会讨论了芬兰牵头的工作组提出的对食品添加剂类别及国际编码系统(INS)标准内容中关于INS列表及解释部分的修改建议。委员会同意了工作组提出的修改焦糖色、硫酸钠、硫酸钾、磷酸二氢镁、硬脂酸镁、阿拉伯胶的INS号的修改建议,并同意将修改后的内容提交第34届大会通过。
委员会同意继续成立由伊朗牵头的INS电子工作组,收集食品添加剂名称和编码信息及相关建议。
JECFA优先评估的添加剂名单
委员会同意了加拿大牵头的会间工作组提交的申请JECFA优先评估的物质名单,包括10个添加剂及186个新香料物质。
JECFA对已评估物质的再评估机制
JECFA秘书处介绍了自JECFA成立以来评估过的物质有60%以上评估时间超过了30年,针对对于部分通过评估的食品添加剂安全性的担心,有必要建立再评估机制。在对CCPR/JMPR和EFSA评估机制进行参考的基础上,委员会同意成立由加拿大牵头的电子工作组,讨论再评估优先物质名单的纳入原则、对1956年以来评估过的107中色素物质进行整理并提出优先再评估的色素名单,以供下届会议讨论。
加工助剂数据库
委员会对新西兰提出的加工助剂数据库的背景、数据库结构的建议及数据库应包括的内容进行了讨论。委员会同意由中国继续承担加工助剂数据库的建设工作,并提出数据库结构和功能展示版本,供下届会议讨论。
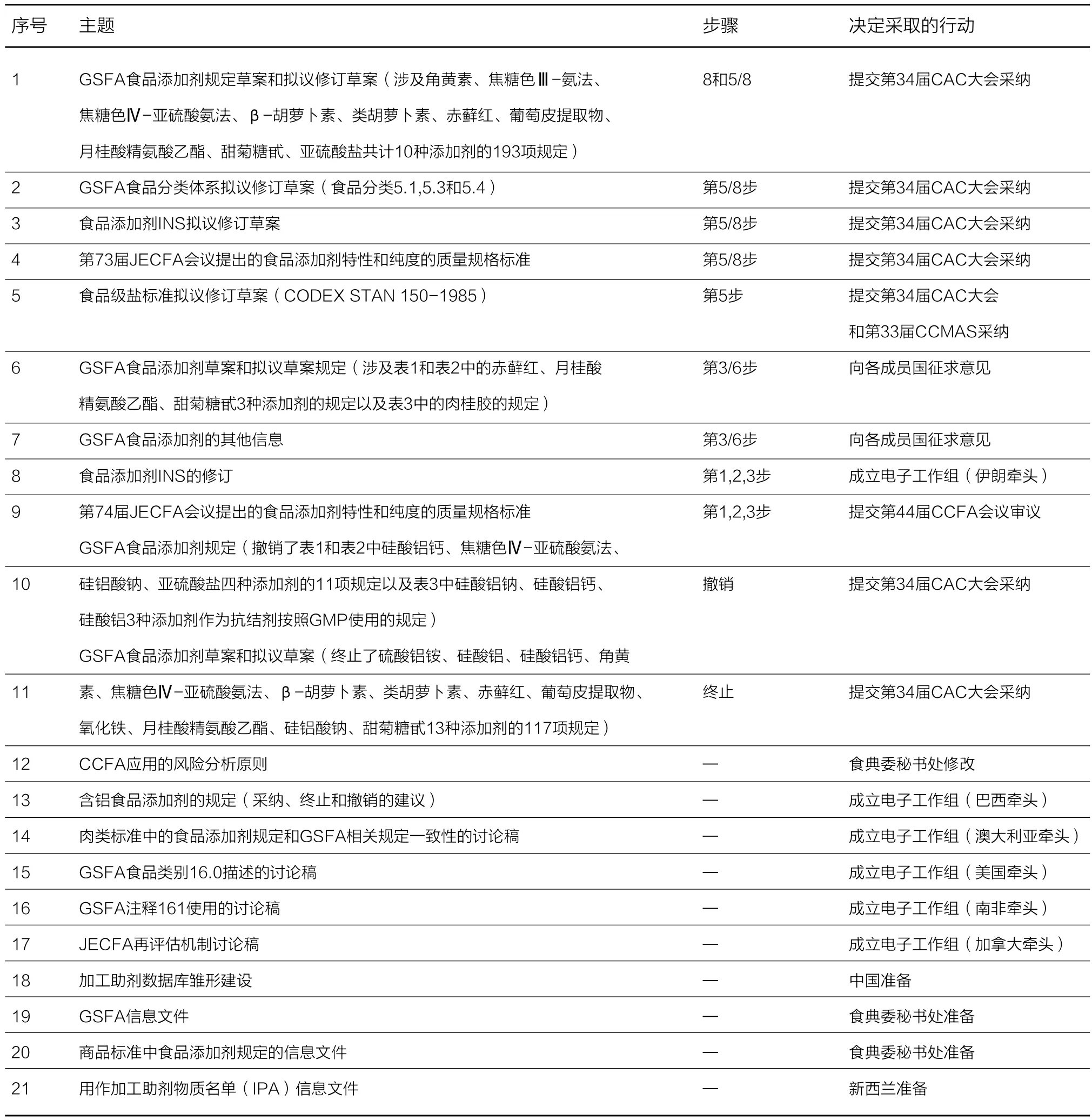
表1. 第43届CCFA会议的主要结论
会议结论
经会议讨论后,委员会决定将GSFA食品添加剂规定草案和拟议修订草案、GFSA食品分类体系拟议修订草案、食品添加剂INS拟议修订草案、第73届JECFA会议提出的食品添加剂特性和纯度的质量规格标准以第8步或5/8步提交给第34届CAC大会采纳。将食品级盐标准拟议修订草案以第5步提交给第34届CAC会议和第33届CCMAS采纳。同时将撤销和终止的GSFA食品添加剂规定提交给第34届CAC大会采纳。此外,为了加快标准制修订进展,委员会决定成立7个电子工作组在相关领域继续开展工作。并在下届会议召开之前仍然召开GSFA实际工作组会议,由美国牵头(详见表1)。
中国代表团的主要活动及影响
中国派出了来自卫生部、农业部、商务部、工信部、质检总局、食品药品监管局及香港食环署的17名代表参加会议,由中国疾病预防控制中心营养与食品安全所王竹天副所长任团长。来自地方食品安全监管部门、行业协会和部分食品企业的三十余名代表列席了会议。中国代表团会前对各项议题进行了充分的准备并参加了会前召开的食品添加剂通用标准(GSFA)工作组会议。
本次会议期间,中国代表团对部分添加剂条款、16.0食品类别的设置、注释161的适用性、含铝添加剂的进展等重点议题都进行了深入研究,并对部分内容表达了中国的立场。
中国代表团承担了加工助剂数据库的建立和维护工作,将在下届会议前完成这一工作,并征求各代表团意见。
在会议间歇,中国疾控中心营养食品所与国际食品添加剂协会(IFAC)进行了会谈,双方同意建立常规合作机制,在食品添加剂生产通用规范、食品添加剂标签标准、食品添加剂质量规格及相关国家食品添加剂法规标准信息等领域开展合作,以促进我国食品添加剂的标准和管理工作。
中国代表团与美国代表团进行了交流,同意与美国建立常规的会前沟通机制。此外,还与新西兰、德国、国际口香糖协会等代表进行个别交流, 促进了双方的了解。
本次中国代表团的成员既包括监管部门,也包括来自行业协会、食品企业的代表。针对议题讨论的内容,代表之间进行了充分的交流,扩大了相关人员对食品法典工作的认识。同时,会议讨论的各项内容对我国食品添加剂标准体系建设,特别是对食品添加剂法规标准制定、食品添加剂使用管理以及食品安全保障体系的建设具有重要意义。
此届会议是中国政府担任主持国以来,在中国组织承办的第5届会议。CCFA秘书处在卫生部的领导下,充分履行主持国的职责,承担了会场安排、同声传译、会议文件的翻译和复印等各项工作。会议期间,为各国代表提供周到的服务,安排宴请等,受到代表们的一致好评。会上,澳大利亚代表团发表了热情洋溢的讲话,对陈君石主席的专业知识、主持会议的策略和幽默表示赞赏,对第43届CCFA会议的成功举办表示衷心的祝贺。
3月18日,本届会议成功落下帷幕,但会议成立的7个电子工作组和加工助剂数据库的建设工作仍需CCFA秘书处和中国代表团持续付出巨大的辛劳,同时,也为2012年3月将在北京召开的第44届CCFA会议的顺利筹备带来新的挑战。
樊永祥简介:
博士,副研究员。负责中国食品法典委员会秘书处、食品安全国家标准审评委员会秘书处的日常管理工作。明。请附U盘或光盘。来稿需附单位推荐信。推荐信应注明对稿件的评审意见以及无一稿两投、不涉及保密、署名无争议等项。
3、根据《著作权法》并结合本刊具体情况,凡来稿在接到本刊回执后满1个月未接到稿件处理通知者,系仍在审阅中。作者如欲投他刊,请先与本刊联系,切勿一稿两投。一旦发现一稿两投,将立即退稿;而一旦发现一稿两用,本刊将刊登该文系重复发表的声明,并在两年内拒绝以该文第一作者为作者的任何来稿。请自留底稿,对不用稿件本刊恕不退还,但原始照片一律平信退还。若需退还原稿,请在投稿时说明。
4、来稿一律文责自负。依照《著作权法》有关规定,本刊可对来稿做文字修改、删节,凡有涉及原意的修改,则提请作者考虑。修改稿逾3个月不寄回者,视作自动撤稿。
5、 经审核初步拟定刊用的稿件按退修意见修改整理后,为缩短刊出周期和减少错误,请将修改稿以纯文本或word格式发送至本刊编辑部公示邮箱,修改稿打印件寄回本刊编辑部,同时注明联系电话、传真号码。
6、来稿无需付稿件处理费。稿件确认刊载后需按通知数额支付版面费(版面费收取标准:500元/1500字)。版面费可由作者单位从课题基金、科研费或其他费用中支付。确有困难者或特约作品可申请减免。稿件刊登后另致稿酬,赠第一作者当期杂志两册并发论文证书一份。
7、来稿一经接受刊登,由作者亲笔签署论文专有使用权授权书,专有使用权即归本刊所有,本刊有权以电子期刊、光盘版等其他方式出版接受刊登的论文,未经中国卫生标准管理杂志社同意,该论文的任何部分不得转载他处。
8、本刊录用的所有稿件均另以电子期刊、光盘版等方式出版。所付稿酬中已含电子期刊及光盘版稿酬。
9、具体格式要求见附件2。
10 、来稿请寄:北京市宣武区红莲南路3 0 号7 层,邮政编码:100055。请勿寄给个人。电子版稿件请寄:chinastandard@163.com。
