Keggin型铬取代杂多离子*PW11O39Cr(Ⅲ)(H2O)4-的电化学性质
2011-01-23华英杰王崇太李天略毛彦超黄永龙
华英杰,王崇太,李天略,毛彦超,黄永龙,彭 婷,于 丹
(1.海南师范大学化学与化工学院,海南海口571158;2.中山大学化学与化学工程学院,广东广州510275)
Keggin型过渡金属取代的杂多化合物因具有独特的光、电和氧化-还原性质,以及较宽的pH稳定范围,在绿色合成、电分析、药物化学、环境水污染控制和能源等领域潜在着广泛的应用前景,近年来备受关注,尤其在电催化方面,已经成为研究的热点之一[1-13]。
在取代的金属离子中,由于Cr(Ⅲ)/Cr(Ⅴ)电对具有比较正的氧化-还原电位,氧化能力比较强,20世纪90年代,美国的Rong等[14]就研究了PW11O39Cr(Ⅲ)(H2O)4-(P W11Cr)在0.5 mol·L-1NaHSO4(pH 1.0)水溶液中对苯甲醇等有机分子的间接电催化氧化作用,结果发现,PW11Cr在电极上氧化产生的产物PW11Cr(Ⅴ)(O)4-和底物之间反应的速率常数太小,限制了PW11Cr作为间接氧化电催化剂的进一步应用。PW11Cr(Ⅴ)(O)4-对底物的惰性可归结为结合氧与金属键合的稳定性,即原子氧的氧化活性在一定程度上被高价态的铬离子束缚了,因此,依靠Cr(Ⅴ)-O中结合原子氧的转移来氧化有机底物在动力学上不是十分有利,除非改变反应途径。在先前的研究中[15],我们曾利用PW11Cr的“内球电子转移机制”对4-甲基吡啶的电催化氧化进行了研究,提出了一个新颖的分子内电子转移电催化机理,本文在此基础上试图更详细地研究PW11Cr的电化学性质,为其作为电催化剂的进一步应用提供实验和理论依据。
1 实 验
1.1 试剂与仪器
钨酸钠:北京化工厂;磷酸氢二钠:天津市化学试剂一厂;丙酮:广州化学试剂厂;硫酸亚铁:天津市福晨化学试剂厂;硝酸铬:天津市科密欧化学试剂开发中心;氯化钠:广州化学试剂厂;磷酸:广州化学试剂厂;硝酸:广州化学试剂厂;硫酸氢钠:广洲化学试剂厂;硫酸:广州化学试剂厂;硫酸钠:天津福晨化学试剂厂;氢氧化钠:天津市河北区海晶精细化工厂。以上所用试剂均为分析纯。实验用水为二次蒸馏水。Na7P W11O39按文献[16]方法合成。
Na4PW11O39Cr(Ⅲ)(H2O)的元素分析在JXA-8800R电子探针微分析仪(日本)上进行;红外光谱在BRUKER EQU INOX 55傅立叶变换红外光谱仪(德国)上记录,样品经KBr压片;紫外-可见光谱在TU1810紫外-可见光谱仪(北京)上进行扫描;循环伏安测量在CH I电化学工作站(660b,上海辰华)上进行,使用单室电解池,玻碳(GC)为工作电极(约0.07 cm2),铂丝为辅助电极,Ag/AgCl(3 mol·L-1KCl)为参比电极。扫描前,GC表面用0.05μm的Al2O3抛光,然后在二次蒸馏水中超声2 min,溶液用纯氮气赶氧10 min。除非指明,实验温度为298 K。
1.2 Na4PW11O39Cr(Ⅲ)(H2O)的合成
在30 mL含有0.88 g Cr(NO3)3·9H2O的水溶液中加入6.07 g Na7PW11O39,然后在磁搅拌下于硅油浴上加热至沸,并回流1 h,此时溶液的颜色由蓝紫色变成暗绿色。冷却,在323 K下蒸发至溶液的体积约剩10 mL,加入大约1 g NaCl,过滤除去CrCl3沉淀,在所得滤液中加入大约80 mL丙酮,搅拌然后过滤除去NaNO3和NaCl沉淀,接着把滤液放在353 K的油浴上蒸去丙酮,剩下少量含水的溶液,将它置于323 K的烘箱中烘干,研磨得到绿色粉末。产品经元素分析、红外、紫外-可见、差热-热重、循环伏安表征,确定其组成为Na4P W11O39Cr(Ⅲ)(H2O)·(4-13)H2O。
2 结果与讨论
2.1 PW11Cr的循环伏安行为
图1是PW11Cr在H3PO4-HAc-H3BO3(pH 2.16)缓冲溶液中的循环伏安扫描结果。从图中可以看到,除了-0.553/-0.505 V(E1/2=-0.529 V)和-0.782/-0.725 V(E1/2=-0.754 V)处两对可逆的W-O骨架双电子还原-氧化波之外[14],在~1.30/0.631 V处,还出现了一对分得比较开的准可逆波,对应于杂多骨架中Cr(Ⅲ)/Cr(Ⅴ)电对的氧化-还原响应,Rong等的研究已证实Cr(Ⅲ)在这个电位下的氧化产物不是Cr(Ⅳ),也不是Cr(Ⅵ),而是Cr(Ⅴ),其电极反应为:
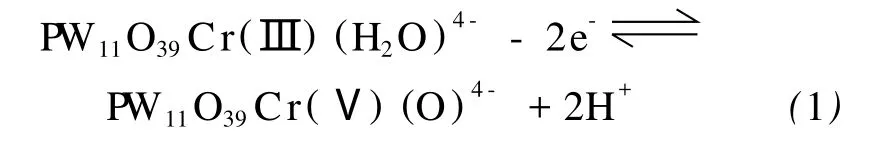

图1 1.0mmol·L-1P W11Cr溶液的循环伏安曲线,支持电解质为H3PO4-HAc-H3BO3缓冲溶液(pH 2.16),扫描速度为10mV·s-1Fig.1 Cyclic voltammogram of 1.0mmol·L-1P W11Cr in the H3PO4-HAc-H3BO3buffer solution(pH 2.16)with scan rate of 10mV·s-1
根据反应(1),Cr(Ⅲ)/Cr(Ⅴ)电对的氧化-还原电位与溶液的pH有关,为了考察它们的相关性,改变溶液的pH,在0.3~1.5 V的电位范围内对PW11Cr溶液进行了循环伏安扫描,结果如图2所示。从图2中可以看到,Cr(Ⅲ)的氧化波与背景电流重叠,其峰电位不容易确定,但Cr(Ⅴ)的还原峰电位随着溶液pH的增大而向负方向移动,这个现象从反应方程式(1)的平衡移动很容易得到理解。因为溶液的pH值增大,反应平衡向右移,Cr(Ⅲ)的氧化变得容易,而Cr(Ⅴ)的还原则变得困难。取Cr(Ⅴ)的还原峰电位EP对溶液的pH值作图,得到一条直线(图2插图),从直线的斜率55 mV/pH可知参与电极反应的H+数目为2,与反应方程式(1)一致。这种峰电位与pH的相关性在W-O骨架的还原-氧化过程中也被观察到,如图3(A)所示,增大溶液的pH,W-O骨架的两个还原波的峰电位均向负方向移动,其峰电位随pH的变化也服从线性关系(图3(B)),由斜率62 mV/pH和118 mV/pH可以推断,第一个还原-氧化波涉及的H+数目为2,第二个还原-氧化波涉及的H+数目则为4,其相应的电极反应为:
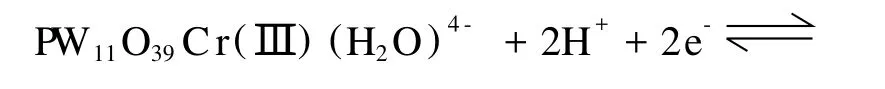
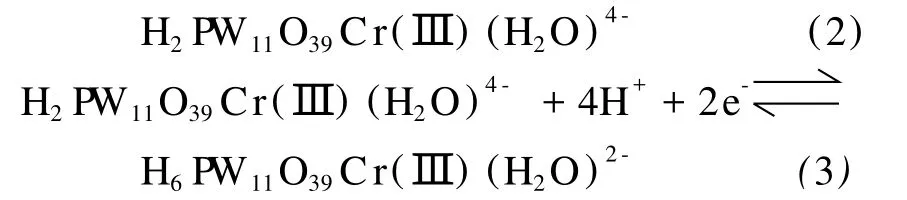

图2 1.0 mmol·L-1PW11Cr溶液在不同pH下的循环伏安曲线,支持电解质为H3PO4-HAc-H3BO3缓冲溶液,pH:(a)1.82;(b)2.16;(c)3.01;(d)3.80;(e)4.58和(f)5.74,扫描速度为10 mV·s-1。插图为Cr(Ⅴ)的还原峰电位与溶液pH值的关系Fig.2 Cyclic voltammograms of 1.0 mmol·L-1PW11Cr in the H3PO4-HAc-H3BO3buffer solution with different pH of(a)1.82,(b)2.16,(c)3.01,(d)3.80,(e)4.58 and(f)5.74 with scan rate of 10 mV·s-1

图3 (A)1.0 mmo·lL-1PW11Cr溶液在0~-1.25 V电位范围的循环伏安曲线,支持电解质为H3PO4-HAc-H3BO3缓冲,pH:(a)1.82、(b)2.16、(c)3.01和(d)3.80,扫描速度为10 mV·s-1(B)PW11Cr的W-O骨架波还原峰电位与溶液pH值的关系Fig.3 (A)Cyclic voltammograms of 1.0 mmo·lL-1P W11 Cr in the H3PO4-HAc-H3BO3buffer solution with pH value of:(a)1.82;(b)2.10;(c)3.01 and(d)3.80.Scanning potential range,0~-1.25 V;Scan rate,10 mV·s-1(B)Dependence of the reduction peak potential of W-O cage of PW11Cr on pH
反应(2)和(3)中H的作用,实际上是与PW11Cr的还原产物(PW11Cr)2-和(PW11Cr)4-形成“紧密离子对”[17],中和这些阴离子过多的负电荷,使PW11Cr和(PW11Cr)2-的还原在动力学上变得有利。因此,当溶液的pH值升高时,还原波的峰电位负移,电流下降,并且还原波和氧化波的峰电位差增大,电极反应的可逆性降低,图3(A)中还原-氧化波的波形随溶液pH的变化说明了这一点。溶液pH对PW11Cr还原的这种影响在交流伏安实验中也明显地观察到,如图4所示。
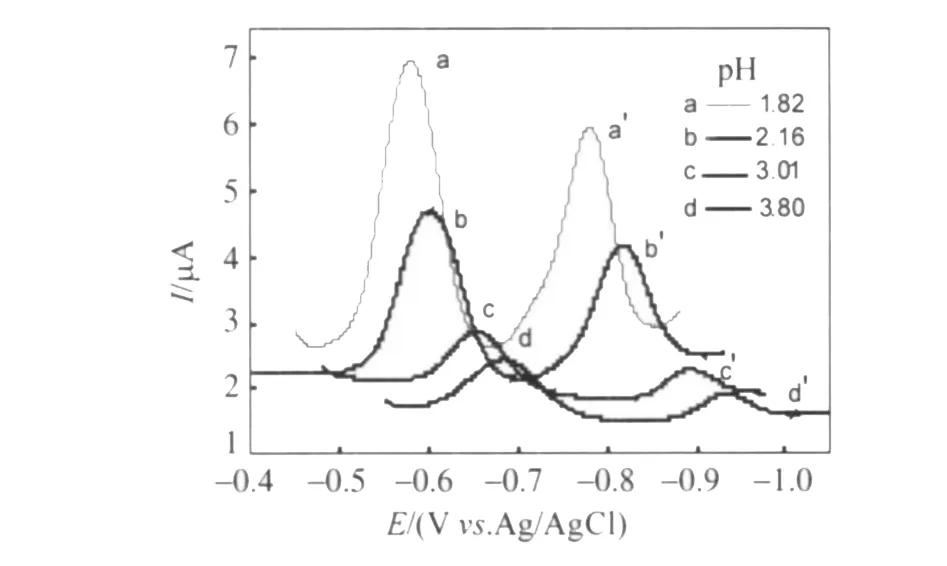
图4 1.0 mmol·L-1PW11Cr溶液在-0.4~-1.05 V电位范围内还原的交流伏安曲线。支持电解质为H3PO4-HAc-H3BO3缓冲,pH:(a)1.82;(b)2.16;(c)3.01;(d)3.80,ΔE=5 mV,频率为100 HzFig.4 AC voltammograms of 1.0 mmol·L-1P W11Cr in the H3PO4-HAc-H3BO3buffer solution with pH of:(a)1.82;(b)2.16;(c)3.01;(d)3.80 in the scanning potential range from-0.4 to-1.05 V.ΔE=5 mV;F=100 Hz
在强酸性条件下,由于H+参与形成“紧密离子对”的促进作用,使W-O骨架在电极界面的电子传递过程可逆性提高,利用这种可逆性,通过改变电位扫描速率可以求出P W11Cr的扩散系数。图5是W-O骨架第一对还原-氧化波在不同扫速下的循环伏安扫描结果。从图中可以看到,还原-氧化波的峰电流随扫描速率的增加而增大,但峰电位几乎不变,取还原波的峰电流对扫描速度的平方根作图,得到一条通过原点的直线(图5插图),表明电极过程受扩散控制。根据298 K时能斯特电极过程峰电流与扫描速率的关系式[18]:

结合图5插图中直线的斜率1.122 7×10-4,得到PW11Cr在H3PO4-HAc-H3BO3(pH 2.16)缓冲溶液中的扩散系数为4.4×10-6cm2·s-1。与文献[14]报道的PW11Cr在0.5 mol·L-1NaHSO4溶液中的扩散系数(4.0×10-6cm2·s-1)十分接近。

图5 1.0 mmol·L-1P W11Cr的W-O骨架的第一对还原-氧化波在不同扫速下的循环伏安曲线。支持电解质为H3PO4-HAc-H3BO3(pH 2.16)缓冲溶液。扫速为(a)5;(b)10;(c)15;(d)20;(e)25;(f)30;(g)35;(h):40;(i)45;(j)50(mV·s-1)。插图是第一个骨架还原波的峰电流与扫描速度平方根的关系Fig.5 Cyclic voltammograms of the first pair of W-O redox wave in the H3PO4-HAc-H3BO3(pH 2.16)buffer solution containing 1.0 mmol·L-1P W11Cr at different scan rate of:(a)5;(b)10;(c)15;(d)20;(e)25;(f)30;(g)35;(h):40;(i)45 and(j)50(mV·s-1).Inset is the relationship of the peak currentIpwithν1/2
2.2 PW11Cr的交流阻抗谱
为了测定电极反应(1)的异相电子传递动力学参数-标准速率常数ko,测量了1.0 mmol·L-1PW11Cr在H3PO4-HAc-H3BO3(pH 2.16)缓冲溶液中的交流阻抗谱,结果如图6所示。由图6可见,Cr(Ⅲ)(H2O)在Edc=1.35 V电位下氧化为Cr(Ⅴ)(O)的阻抗谱在测量频率范围内(0.1~105Hz)为一条阻抗很大的近乎于半圆的曲线,表明电极反应过程受异相电子传递动力学控制。取cotθ对频率ω的平方根作图,得一条直线(图6插图)。

图6 1.0 mmol·L-1PW11Cr在H3PO4-HAc-H3BO3(pH 2.16)缓冲溶液中的交流阻抗谱,ΔE=5 mV;ω=0.1~105Hz;Edc=1.35 V。插图是Cr(Ⅲ)(H2O)氧化的cotθ与频率平方根ω1/2的关系Fig.6 EIS of 1.0 mmol·L-1PW11Cr in the H3PO4-HAc-H3BO3buffer solution(pH 2.16).(ΔE=5 mV;ω=0.1~105Hz;Edc=1.35 V).Inset is the dependence of cotθonω1/2in Cr(Ⅲ)(H2O)oxidation
根据下列关系式:
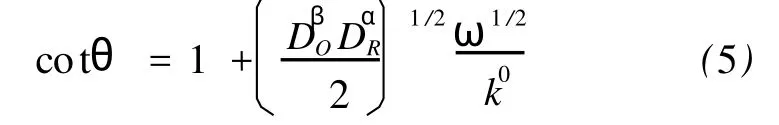
假设DO=DR=D,则=D,(5)式简化为
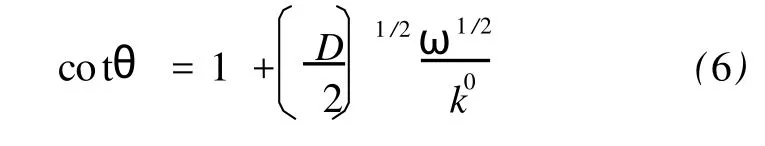
结合图6插图中直线的斜率和上述测定的扩散系数,可得ko=0.67 cm·s-1。
虽然P W11Cr的阳极氧化过程受动力学控制,但改变施加的电位Edc,可以改变电荷迁移的速率,从图7可以看到,随着Edc从1.20 V增加到1.35 V时,PW11Cr氧化的电荷传递阻抗减小,表明电极反应的速率增大。
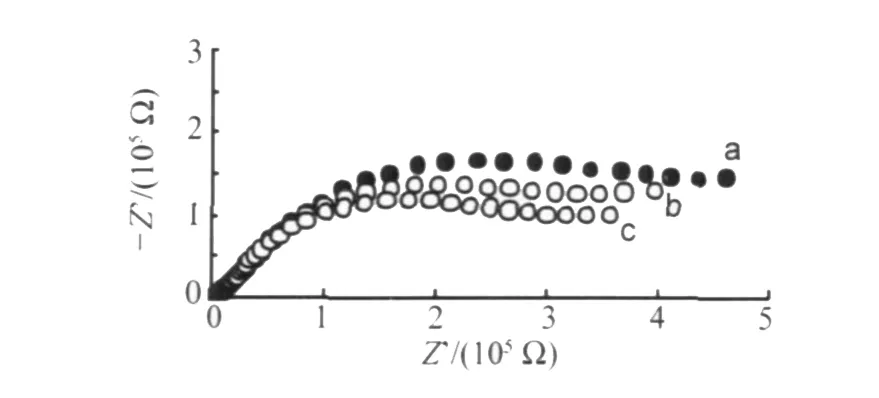
图7 1.0 mmol·L-1PW11Cr在不同电位下的交流阻抗谱,支持电解质为H3PO4-HAc-H3BO3(pH 2.16)缓冲。ΔE=5 mV;ω=0.1~105Hz;Edc=(a)1.20,(b)1.30,(c)1.35 VFig.7 EIS of 1.0 mmol·L-1PW11Cr at different potential.Thesupportingelectrolyteis H3PO4-HAc-H3BO3(pH 2.16);ΔE=5 mV;ω=0.1~105Hz;Edcat(a)1.20,(b)1.30 and(c)1.35 V
对于W-O骨架的两个还原-氧化波,分别测定Edc=-0.530和-0.755 V处发生电极反应的交流阻抗谱,结果如图8所示。
从图8(a)和(b)中均可以看到,在高频区出现一个对应于异相电荷传递阻抗的小半圆,而在低频区则出现一条对应于扩散阻抗的沃伯格直线,这是典型的可逆电极过程的阻抗谱。与沃伯格阻抗相比,异相电荷传递阻抗很小,表明电极过程受扩散控制。此外,在小半圆之前可以观察到一条和小半圆起点相切的短线,说明PW11Cr的电极过程存在表面吸附作用。这种吸附现象可以认为是体积较大和带负电荷较多的PW11Cr与荷负电的电极表面之间存在着静电斥力,PW11Cr必须通过特性吸附(形成化学键作用)才能在电极界面上进行电荷交换。交流伏安实验进一步证实了这种吸附行为,如图9所示,随着频率的增加,PW11Cr骨架还原的峰电流不是增大,而是减小,与能斯特体系所预示的峰电流与交流频率ω的关系(7)式并不一致,说明其中存在吸附步骤。
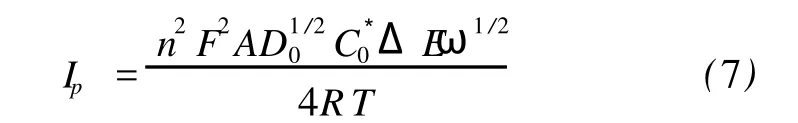
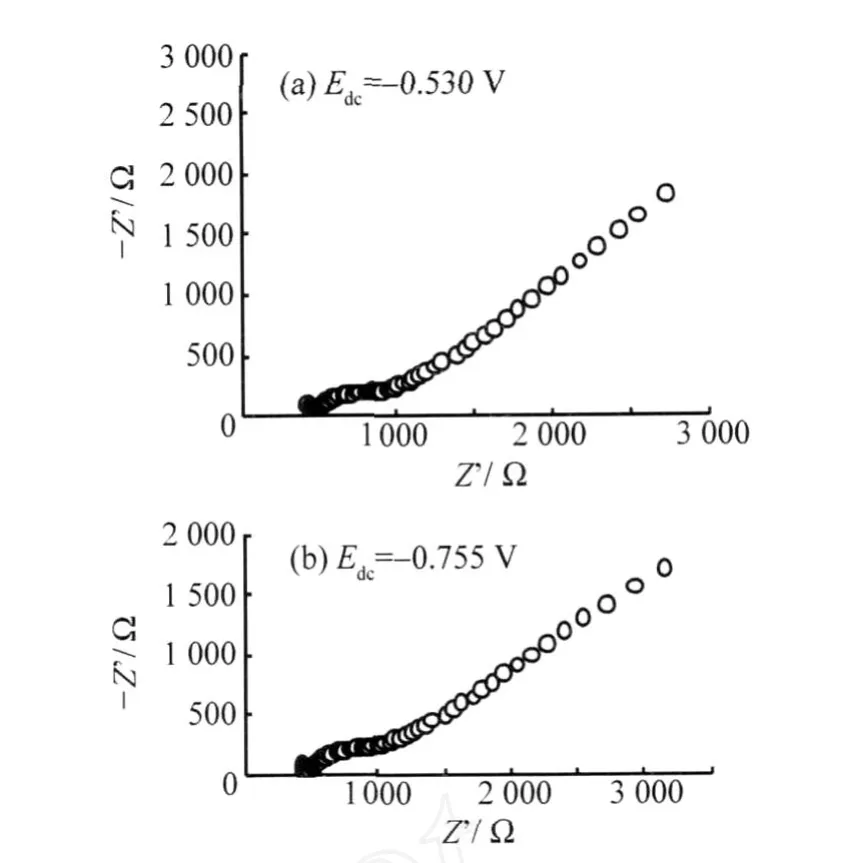
图8 1.0 mmol·L-1PW11Cr在(a)-0.530 V和(b)-0.755 V处发生骨架还原的交流阻抗谱。支持电解质为H3PO4-HAc-H3BO3(pH 2.16)缓冲;ΔE=5 mV;ω=0.1~105HzFig.8 EIS of theW-O skeleton reduction in the H3PO4-HAc-H3BO3buffer solution(pH 2.16)containing 1.0 mmol·L-1P W11Cr at the potential of(a)-0.530 V and(b)-0.755 V(ΔE=5 mV;ω=0.1~105Hz)
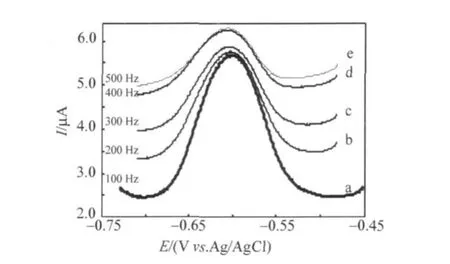
图9 1.0 mmol·L-1PW11Cr骨架还原的交流伏安曲线;支持电解质为在H3PO4-HAc-H3BO3(pH 2.16)缓冲溶液;电位扫描范围为-0.45~-0.73 V;交流电压幅值ΔE=5 mV;频率为(a)100,(b)200,(c)300,(d)400,(e)500 HzFig.9 AC voltammograms of the skeleton reduction in the H3PO4-HAc-H3BO3buffer solution(pH 2.16)containing 1.0 mmol·L-1PW11Cr in the potential scan range of-0.45~-0.73V withΔEat 5 mV andωat(a)100,(b)200,(c)300,(d)400 and(e)500 Hz
3 结 论
PW11Cr的H3PO4-HAc-H3BO3(pH 2.16)缓冲溶液在玻碳电极上有3个电极反应过程,分别为Cr(Ⅲ)/Cr(Ⅴ)电对的氧化-还原反应和W-O骨架的两个双电子还原-氧化反应。这3个电极反应过程的可逆性均与溶液的pH有关,随着溶液pH的增大,峰电位负移,阴极和阳极峰电位差加大,电极过程的可逆性降低。Cr(Ⅲ)/Cr(Ⅴ)电对的电极反应过程受异相电荷传递动力学控制,W-O骨架的两个电极反应过程受扩散控制,而且PW11Cr的电极反应过程存在吸附步骤。这些实验结果为PW11Cr作为电催化剂的应用提供了理论和实验依据。
[1] JORGENSEN K A.Transition-metal-catalyzed epoxidations[J].Chem Rev,1989,89:431-458.
[2] JORGENSEN K A,SCH ISTT B.Metallaoxetanes as intermediate in oxygen-transfer reactions-reality or fiction[J].Chem Rev,1990,90:1483-1506.
[3] DRAGO R S.Homogeneousmetal-catalyzed oxidations by O2[J].Coord,Chem Rev,1992,117:185-213.
[4] SADAKANEM,STECKHAN E.Electrochemical properties of polyoxometalates as electrocatalysts[J].Chem Rev,1998,98:219-237.
[5] B INETA K,ESSAD IKA,LOU ISN,et al.Cooperativity of copper and molybdenum centers in polyoxometalatebased electrocatalysts:cyclic voltammetry,EQCM,and AFM characterization[J].Langmuir,2006,22(25):10416–10425.
[6] SADAKANE M,STECKHAN E.Investigation of the manganese-substitutedα-Keggin-heteropolyanion K6S iW11O39Mn(H2O)by cyclic voltammetry and its application asoxidation catalyst[J].JMolCatalA:Chemical,1996,114:221-228.
[7] ESSAAD I K,KEITA B,NADJO L,et al.Oxidation of NADH by oxometalates[J].J ElectroanalChem,1994,367:275-278.
[8] BART J C,ANSON F C.Coordination,electron transfer and catalytic chemistry of a ruthenium-substituted heteropolytungstate anion as revealed in its electrochemical behavior[J].J Electroanal Chem,1995,390:11-19.
[9] WANG C T,HUA Y J,TONG Y X.A novel E-fentonlike system using PW11O39Fe(Ⅲ)(H2O)4-as an electrocatalyst for wastewater treatment[J].Electroch imica Acta,2010,55:6755-6760.
[10] 华英杰,王崇太,韦吉崇,等.Keggin型缺位杂多阴离子PW11O7-39电催化降解硝基苯[J].化学学报,2010,68(19):1961-1964.
[11] 王崇太,孙振范,华英杰,等.Keggin型铁取代杂多阴离子PW11O39Fe(Ⅲ)(H2O)4-光催化降解硝基苯[J].化学学报,2010,68(11):1037-1042.
[12] 华英杰,王崇太,童叶翔,等.Keggin型杂多阴离子PW11O39Fe(Ⅲ)(H2O)4-电催化降解硝基苯[J].化学学报,2009,67(23):2650-2654.
[13] WANG C T,HUA Y J,L I G R,et al.Indirect cathodic electrocatalytic degradation of dimethylphthalate with PW11O39Fe(Ⅲ)(H2O)4-and H2O2in neutral aqueous medium[J].Electroch imica Acta,2008,53:5100-5105.
[14] RONG C Y,ANSON F C.S implified preparations and electrochemical behavior of two chromium-substituted heteropolytungstate anions[J].Inorg Chem,1994,33:1064-1070.
[15] 王崇太,华英杰,李高仁,等.Cr(Ⅲ)-取代磷钨杂多配合物对4-甲基吡啶的电催化氧化作用[J].化学学报,2008,66(8):835-840.
[16] BREVARD C,SCH IMPF R,TOURNE G,et al.Tungsten-183 NMR:A complete and unequivocal assignment of the tungsten-tungsten connectivities in heteropolytungstates via two-dimensional183W NMR techniques[J]J Am Chem Soc,1983,105:7059-7063.
[17] KHENK INT A M,H ILL C L.Transfer from high-valent totally inorganic oxometalloporphyrin analogs,[Xn+W11O39CrVO](9-n)-(Xn+=P5+,Si4+),to hydrocarbons[J].J Am Chem Soc,1993,115:8178-8186.
[18] A J巴德,L R福克纳.电化学方法-原理及应用[M].北京:化学工业出版社,1986.
