NCAM L1小基因模型的建立及其剪接模式研究
2011-01-23彭正羽
张 薇,沈 权,彭正羽
NCAM L1小基因模型的建立及其剪接模式研究
张 薇1,沈 权1,彭正羽2
(1.浙江大学城市学院医学与生命科学学院,浙江杭州310015;2.复旦大学生物医学研究院,上海200032)
目的:建立可用于前体mRNA可变剪接分析的NCAM L1小基因模型。方法:以人基因组DNA为模板,通过PCR扩增获得NCAM L1小基因片段,并将其克隆至真核表达载体中,构建小基因的质粒。在此基础上,用NCAM L1小基因模型转染HeLa、COS-1、PFSK及R28细胞,并用RT-PCR进行被剪接的小基因产物的半定量检测。结果:NCAM L1小基因在4种细胞中的剪接模式不同,在PFSK以及Hela细胞中,存在2种剪接亚型,而在COS-1以及R28细胞中只有一种剪接亚型存在。结论:所构建的NCAM L1小基因可用于细胞水平的基因剪接分析。
Hela细胞;质粒;遗传载体;剪接体;NCAM L1;小基因;前体mRNA;可变剪接
[JZhejiang Univ(Medical Sci),2011,40(4):427-431.]
前体mRNA的剪接是基因表达调控中的重要环节,目前已知两种互相关联的剪接方式:组成性剪接和可变剪接[1]。在组成性剪接中,剪接位点不因细胞种类发育阶段或环境而改变,因而最终形成的基因及其表达产物也是不变的。而可变剪接则不然,通过可变剪接过程可以将前体mRNA的外显子选择性地组合、连接在一起,并最终表达出功能各异的、甚至完全相反的蛋白质亚型[2]。前体mRNA的剪接是在“剪接复合体”中进行的,剪接复合体包含snRNPs(small nuclear ribonucleoproteins)、hnRNPs(hetero-geneous nuclear ribonucleoproteins)和 SR(serine/arginine-rich)蛋白及其相关蛋白[3-4]。调控可变剪接的因素包括顺式元件和反式调节因子[5-6]。
在前体mRNA可变剪接的研究中,小基因模型是一种新发展起来的有效的研究手段[7-8]。所谓小基因是基因中的一个片段,可用于基因的功能以及表达调控机制研究,因其片段短而得名。用于组成型剪接分析的小基因模型通常仅包含2个外显子和它们之间的1个内含子;用于可变剪接分析的小基因除包含2个相邻的在剪接时被二选一剪接的外显子外,还包含它们两侧的外显子及这些外显子之间的内含子。
人神经细胞黏附分子(Human Neural cell adhesion molecule L1,NCAM L1)属于免疫球蛋白超家族的成员[9],其在神经元细胞以及其它细胞中的表达存在差别,表现在对2号外显子以及27号外显子的可变剪接方式不同。在神经元细胞中,成熟的NCAM L1 mRNA包含2号外显子以及27号外显子,而在非神经元细胞中,成熟的NCAM L1 mRNA不包含2号外显子和27号外显子[10]。研究者已经证实,NCAM L1在神经细胞的分化以及迁移中发挥重要作用,同时,在肿瘤的发生以及转移中也有作用[11-12]。
为深入研究NCAM L1的可变剪接机制,本研究建立了NCAM L1其2号外显子可被可变剪接的小基因模型(小基因结构及其剪接模式见图1),并研究了该小基因模型在Hela、COS-1、PFSK及R28等几种不同细胞系中的可变剪接模式,证实该小基因模型可以用于细胞水平的基因剪接分析。

图1 NCAM L1小基因结构及其剪接模式Fig.1 The structure and splicing pattern of NCAM L1 minigene
1 材料与方法
1.1 实验材料
1.1.1 试剂 Taq酶、XbaⅠ、BamHⅠ内切酶和T4 DNA连接酶购自New England公司;MLV-RT酶以及 RNasin,dNTPs购自 Promega公司;oligo(dT)18购自上海生工生物工程有限公司;细胞转染用 Lipofectiamine试剂盒购自GIBCO/BRL公司;PCR引物由上海生工生物工程有限公司合成。
1.1.2 质粒 pCRII质粒以及 pcDNA3.1/myc-His(-)A表达载体购自Promega公司。
1.1.3 菌株 DH5α 为Clontech公司产品。
1.1.4 细胞株 Hela、COS-1、PFSK 及 R28细胞均来源于 ATCC,Hela、COS-1及 R28用含10%小牛血清的RPMI 1640培养液,37℃,5%CO2培养。PFSK用含10%小牛血清的DMEM高糖培养液,37℃,5%CO2培养。
1.2 实验方法
1.2.1 小基因质粒的构建和验证 在NCAM L1小基因两端设计相应的引物,其中正向引物含有内切酶BamHⅠ的酶切位点,反向引物含有内切酶XbaⅠ的酶切位点。引物序列为:正向(L1-F):5'-ACGGATCCGATGGTCGTGGCG CTGCGG-3';反向(L1-R):5'-GCTCTAGAGGCT GAGACGGCAGATCAC-3'。以胎儿脑组织基因组DNA为模板,上述序列为引物进行PCR扩增,反应条件为 94℃变性5 min;94℃,30 s;64℃,30 s;72℃,5 min;35 个循环,72℃,7 min,扩增出一条约3.3 kb的小基因序列,将其克隆到载体pCRⅡ中并测序验证。用这两种内切酶对PCR产物进行酶切后即可克隆入pCDNA3.1质粒载体。质粒经过酶切以及测序鉴定为含有 NCAM L-1的 Exon1、2、3以及Intron的小基因。
1.2.2 细胞的短暂共转染 将含有NCAM L1小基因的表达质粒pcDNA3.1-NCAM L1,转染Hela、COS-1、PFSK及 R28细胞,以观察在不同类型细胞中小基因的剪接情况。实验中以小基因的空载体pcDNA3.1转染的细胞作为阴性对照。细胞转染通过lipofectamine介导,方法参见GIBCO/BRL公司操作说明。大致步骤为:在直径6 cm的细胞培养皿中以5×105细胞/皿的密度接种细胞,次日以小基因质粒2 mg分别转染不同细胞,30 h后收集细胞,抽提RNA,经逆转录获得相应的cDNA。以上述cDNA为模板,载体上的T7 primer作为正向引物,上述的反向引物通过PCR扩增细胞外源性的NCAM L1的剪接产物。通过电泳条带以及测序鉴别其可变剪接结果。
2 实验结果
2.1 用于剪接分析的小基因的构建和验证所构建小基因表达质粒pcDNA3.1-His-NCAM L1的酶切验证结果见图2。用BamHⅠ+XbaⅠ双酶切后,得到3.3 kb的小基因片段和5.4 kb的载体片段,两个片段的分子量均和理论上预期的相符,且与PCR扩增目的条带大小一致。上述结果表明,所构建的小基因表达质粒准确无误。
2.2 在不同细胞中NCAM L1小基因的剪接模式 用我们构建的小基因分别转染Hela、COS-1、PFSK及R28细胞后,NCAML 1小基因的可变剪接结果见图3。如图所示,在PFSK细胞以及Hela细胞中,NCAM L1小基因的剪接产物为大小分别约为190 bp以及170 bp的两个条带,测序结果证实这两个条带中,分子量较大的条带包含2号外显子,而另一条带不含2号外显子。结果说明在这两种细胞中,小基因可以被剪接产生两种亚型,即包含2号外显子以及不含2号外显子的剪接亚型。而在R28以及COS-1细胞中,只存在一种大小为170 bp的条带,说明小基因在这两种细胞内通过剪接只能产生一种亚型,即不含2号外显子的剪接亚型。
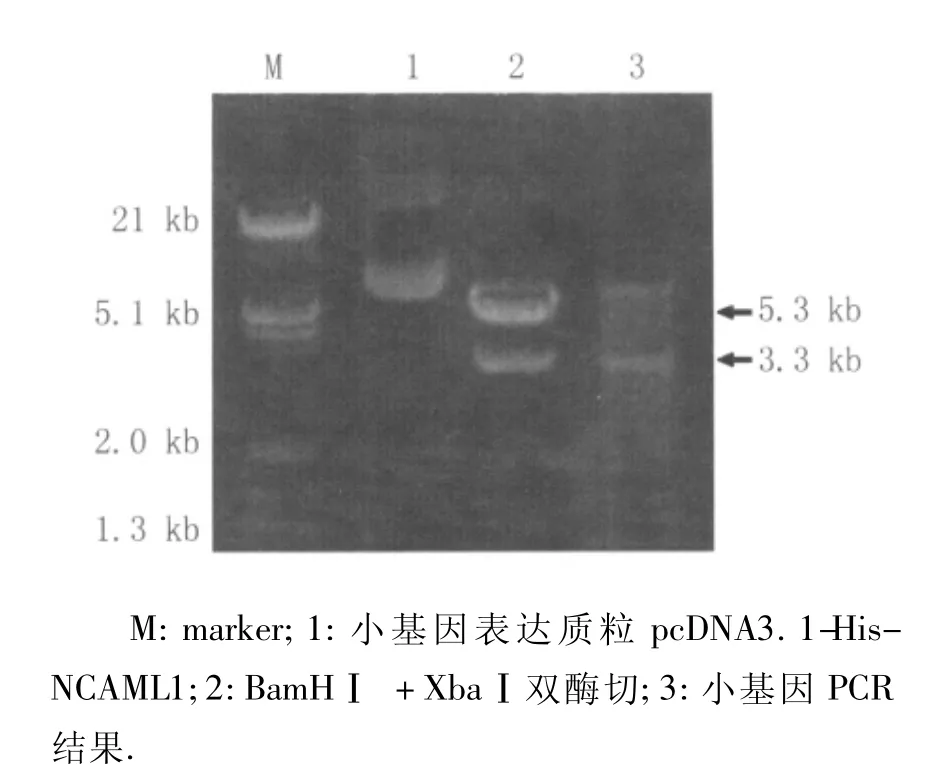
图2 小基因质粒酶切电泳鉴定Fig.2 NCAM L1 minigene identification by BamHⅠ and XbaⅠ digestion
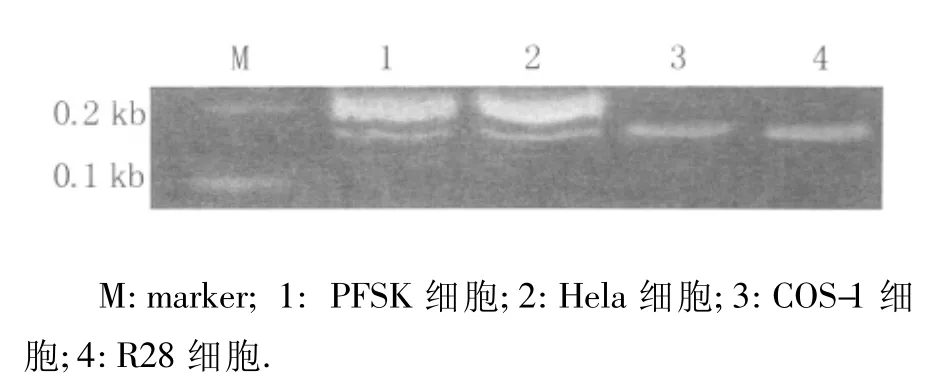
图3 NCAM L1小基因在不同细胞中的剪接模式Fig.3 The splicing pattern of NCAM L1 minigene in 4 cell lines
3 讨论
人类基因组计划研究表明,人类的基因组包含约40 000个基因[13],但是人体内蛋白的种类远远多于此数。其主要原因即在于基因可变剪接的多样性,使这些基因的编码容量大大增加。研究证实,同一基因在不同的条件下,可以编码的亚型最多可达数千个[14]。最近的研究表明,超过70%的人类基因都有两个或更多的剪接亚型存在[15]。可变剪接不仅存在于生命体的正常生理活动,如发育、分化以及性别决定等过程中,还在一些疾病特别是肿瘤的发生中也扮演着重要角色。如多位作者证实,成纤维细胞生长因子受体(FGFR)信号转导途径可能在星形胶质瘤的恶化过程中发挥重要作用[16]。FGFR1的α外显子经过可变剪接可以产生两种亚型,即包含α外显子的FGFR1α以及不含α外显子的FGFR1β。FGFR1在正常的蛋白质以及低级别的星形细胞瘤中表达很少或无表达,但在恶性胶质瘤中的表达较高且只表达可变剪接亚型FGFR1β。中间程度的胶质瘤FGFR1的表达则是由 FGFR1α到 FGFR1β变化[17]。
NCAM L1主要以同亲和或异亲和等多种方式实现神经元间相互作用,从而影响细胞迁移和神经元轴、树突投射及突触定位,以及作为辅助受体参与细胞内信号传导[18]。NCAML1细胞黏附分子缺陷的小鼠会出现发育迟滞、空间学习和探索能力不足等表现[19]。此外,NCAM L1还参与肿瘤细胞侵袭[20],在神经胶质瘤中,Izumoto等人在胶质瘤细胞中检测到了NCAM L1的剪接亚型NCAM L1cs的表达,并发现该亚型可能在胶质瘤细胞的黏附以及迁移中发挥重要作用[21-22],提示 NCAM L1的可变剪接与胶质瘤的生物学特性相关。相比体外基因剪接分析模型,体内小基因剪接分析方法建立在细胞水平上,更接近其在生物体内的真实情况。因此,本研究构建了NCAM L1的小基因模型,并将其转染到 PFSK、Hela、R28以及COS-1细胞中。R28是一种永生化的视网膜前体细胞,而COS-1细胞来源于非洲绿猴肾细胞,均非肿瘤细胞,NCAM L1小基因通过可变剪接后只存在一种不含2号外显子的剪接亚型,与其在正常组织中的剪接一致。而PFSK是来源于人类的原始神经外胚层肿瘤细胞,Hela是人类宫颈癌细胞,NCAM L1小基因通过剪接后能产生两种剪接亚型,提示这种剪接形式可能与肿瘤相关。因此,通过研究NCAM L1小基因在不同的细胞中不同的剪接模式,将有助于我们研究NCAM L1在正常生理条件下以及包括神经胶质瘤在内的疾病中的作用及其分子机制。
[1] GREEN M J.Biochemical mechanism of constitutive and regulated pre-mRNA splicing[J].Annu Rev Cell Biol,1991,7:559-599.
[2] REED R.Mechanisms of fidelity in pre-mRNA splicing[J].Curr Opin Cell Biol,2000,12(3):340-345.
[3] GRAVELEY B R.Alternative splicing:increasing diversity in the proteomic world [J].Trends Genet,2001,17(2):100-107.
[4] NILSEN T W.The spliceosome:the most complex macromolecular machine in the cell [J].Bioessays,2003,25:1147-1149.
[5] JURICA M S AND MOORE M J.pre-mRNA splicing:awash in a sea of proteins[J].Mol Cell,2003,12:5-14.
[6] BLACK D L.Mechanism of alternative premessenger RNA splicing[J].Annu Rev Biochem,2003,72:291-336.
[7] THANARAJ T A,STAMM S.Prediction and statisticalanalysis of alternatively spliced exons[J].Prog Mol Sub Biol,2002,31:1-31.
[8] GREGORY M H.Alternative splicing as a novel of means of regulating the expression of therapeutic genes[J].Cancer Gene Therapy,2002,9:133-141.
[9] FIELDSR D AND ITOH K.Neural cell adhesion molecules in activity-dependent development and synaptic plasticity[J].Trends Neurosci,1996,19(11):473-480.
[10] CHEN S,MANTEI N,Dong L,et al.Prevention of neuronal cell death by neural adhesion molecules L1 and CHL1 [J].J Neurobiol,1999,38(3):428-439.
[11] MARETZKY T,SCHULTE M,LUDWIG A,et al.L1 is sequentially processed by two differently activated metalloproteases and presenilin/gammasecretase and regulates neural cell adhesion,cell migration,and neurite outgrowth [J].Mol Cell Biol,2005,25(20):9040-9053.
[12] BAO S,WU Q,LI Z,et al.Targeting cancer stem cells through L1 CAM suppresses glioma growth[J].Cancer Res,2008,68(15):6043-6048.
[13] VENTER JC,ADAMSM D,MYERSE W,et al.The sequence of the human genome[J].Science,2001,291:1304-1351.
[14] GRAVELEY B R.Alternative splicing:increasing diversity in the proteomic world [J].Trends Genet,2001,17(2):100-107.
[15] JOHNSON J M.Genome-wide survey of human alternative pre-mRNA splicing with exon junction microarrays[J].Science,2003,302(5653):2141-2144.
[16] JIN W,MCCUTCHEON I E,FULLER G N,et al.Fibroblast growth factor receptor-1 alpha-exon exclusion and polypyrimidine tract-binding protein in glioblastoma multiforme tumors[J].Cancer Res,2000,60(5):1221-1224.
[17] DEL GATTO F,PLET A,GESNEL M C,et al.Multiple interdependent sequence elements control splicing of a fibroblast growth factor receptor 2 alternative exon [J].Molecular and Cellular Biology,1997,17:5106-5122.
[18] SCHMID R S,MANESS P F.L1 and NCAM adhesion molecules as signaling coreceptors in neuronal migration and process outgrowth [J].Curr Opin Neurobiol,2008,18(3):245-250.
[19] CREMER H,CHAZAL G,LLEDO P M,et al.PSA-NCAM: an important regulator of hippocampal plasticity[J].Int J Dev Neurosci,2000,18(2-3):213-220.
[20] GAVERT N,BEN-SHMUEL A,RAVEH S.L1-CAM in cancerous tissues[J].Expert Opin Biol Ther,2008,8(11):1749-1757.
[21] IZUMOTO S,OHNISHI T,ARITA N,et al.Gene expression of neural cell adhesion molecule L1 in malignant gliomas and biological significance of L1 in glioma invasion [J].Cancer Res,1996,56(6):1440-1444.
[22] SENNER V,KISMANN E,PÜTTMANN S,et al.L1 expressed by glioma cells promotes adhesion but not migration [j].Glia,2002,38(2):146-154.
Establishment of NCAM L1 minigene model and its splicing patterns in different cell lines
ZHANG Wei1,SHEN Quan1,PENG Zheng-Yu2
(1.School of Medicine and Life Science,Zhejiang University City College,Hangzhou 310015,China;2.Institute of Biomedical Sciences,Fudan University,Shanghai 200032,China)
Objective:To establish a minigene model of neural cell adhesion molecule L1(NCAM L1)gene and to study its aplicing patterns in different cell lines.Methods:Using human genetic cDNA as template,the NCAM L1 minigene fragment was amplified and inserted into eukaryotic expression vector.The minigene was transfected into 4 cell lines and the splicing patterns of NCAM L1 minigene in these cell lines were studied.Results:The splicing patterns of NCAM L1 minigene were different in individual cell lines.In PFSK and Hela cell lines,two splicied isoforms were generated but in COS-1 and R28 cell lines,only one isoform existed.Conclusion:NCAM L1 minigene model can be used in alternative splicing analysis.
Hela cells;Plasmids;Genetic vectors;Spliceosomes;NCAM L1;Mini-gene;Pre-mRNA;Alternative splicing
Q 753
A
1008-9292(2011)04-0427-05
http:∥www.journals.zju.edu.cn/med
10.3785/j.issn.1008-9292.2011.04.014
2011-04-18
2011-05-15
浙江省教育厅科研资助项目(Y201017203).
张 薇(1976-),女,硕士,讲师,主要从事分子生物学和细胞免疫学研究.
彭正羽(1970-),男,博士,主要从事分子生物学研究;E-mail:zhypeng@fudan.edu.cn
[责任编辑 张荣连]
