FUT2基因单核苷酸位点多态性与母乳中性寡糖水平关联性研究
2011-01-22张卓君王艳艳ArdytheMorrow彭咏梅
张卓君 张 磊 姚 文 王艳艳 Ardythe Morrow 彭咏梅
母乳喂养是可减少儿童患病率和死亡率的一种健康促进行为。而许多健康促进的效应都可归因于母乳中发现的各种生物活性因子。一些局限于特定人群的研究已经表明母乳中生物活性因子的差别可以影响儿童的健康和发育[1~4]。
寡糖是母乳中仅次于乳糖和脂肪的第三大固体组分,是近年来母乳生物活性因子研究的热点之一。中性寡糖是保护婴儿胃肠道的天然屏障,能降低早期婴儿腹泻和肠道感染[3,5~8],可能降低泌尿道和呼吸道的感染[9,10]。近来有研究报道,母乳寡糖特别是2位连接的岩藻糖基寡糖有可能减少HIV感染的风险[11,12]。
母乳中性寡糖主要为岩藻糖基寡糖,岩藻糖基通过酶的作用连接到乳酰基或半乳糖上构成其基本结构,其连接可以有α1,2、α1,3和α1,4等形式。不同种族的母亲母乳中性寡糖的种类和水平差异很大,认为编码酶的基因可能存在人群多态性并影响母乳中性寡糖的表达。在前期研究中发现FUT2的SNP位点rs601338的基因型是美国母亲控制母乳ɑ1,2岩藻糖基寡糖水平的关键位点,但该位点的基因型并不影响中国母亲母乳α1,2岩藻糖寡糖的表达。本次选取了FUT2的另一个SNP位点rs1047781进行研究,以进一步探究中国母亲母乳中性寡糖水平与FUT2的SNP位点基因型之间的关系。
1 方法
1.1 纳入标准 ①健康足月儿的母亲;②母亲年龄18~49岁;③计划在产后3个月内至少75%以母乳喂养婴儿。
1.2 排除标准 ①双胞胎或多胞胎的母亲;②早产儿(胎龄<37周或出生体重<2 500 g)。
1.3 样本收集 产后2周收集母乳和母亲唾液样本。收集母乳时吸空一侧乳房所有乳汁,充分混匀后,分装至2 mL冻存管,-80℃保存。用Oragene试剂盒收集母亲唾液,4℃保存。
1.4 中性寡糖水平测定 共测定9种中性寡糖的水平,9种寡糖的相对分子质量和连接形式如表1所示。
1.4.1 仪器与设备 制备液相色谱分析仪LC-8A (日本Shimadzu公司),示差检测器RID-10A(日本Shimadzu公司),紫外检测器SPD-20A(日本Shimadzu公司),液相色谱分析仪LC-20AD(日本Shimadzu公司),ODS-100Z色谱分析柱(4.6 mm×250 mm)(日本Tosoh公司),冷冻干燥仪1-2LD (德国Christ公司),真空浓缩仪RVC 2-2S(德国Christ公司),Bio Gel P-2(Extra fine,<45 μm)(美国Bio Rad公司),Milli-Q超纯水系统(美国Millipore公司)。
表1 9种中性寡糖的相对分子质量和连接形式
Tab 1 Molecular weight and connective type of 9 neutral oligosaccharides
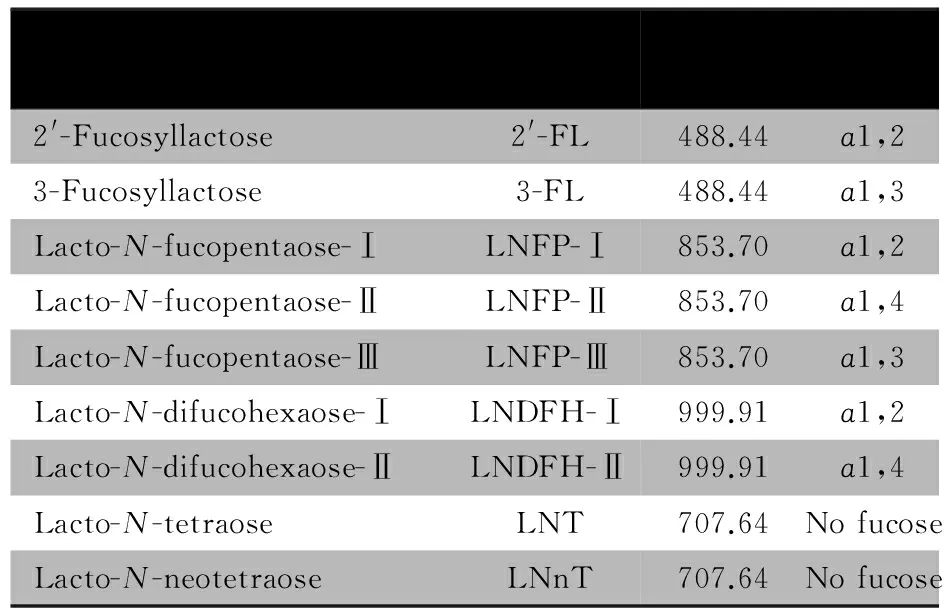
OligosaccharideAbbreviationMolecualarWeightLocationoffucose2'-Fucosyllactose2'-FL488.44ɑ1,23-Fucosyllactose3-FL488.44ɑ1,3Lacto-N-fucopentaose-ⅠLNFP-Ⅰ853.70ɑ1,2Lacto-N-fucopentaose-ⅡLNFP-Ⅱ853.70ɑ1,4Lacto-N-fucopentaose-ⅢLNFP-Ⅲ853.70ɑ1,3Lacto-N-difucohexaose-ⅠLNDFH-Ⅰ999.91ɑ1,2Lacto-N-difucohexaose-ⅡLNDFH-Ⅱ999.91ɑ1,4Lacto-N-tetraoseLNT707.64NofucoseLacto-N-neotetraoseLNnT707.64Nofucose
1.4.2 试剂 PMP(美国Sigma公司),乙腈(德国Fisher公司),寡糖标准品(英国Dextra实验室)。
1.4.3 实验步骤 依据文献[13,14] 建立的HPLC法测定母乳中性寡糖水平。方法如下:取母乳1 mL融化后用氯仿/甲醇萃取,用Bio Gel P-2(<45 μm)柱(2.6 cm×100 cm)层析,用示差检测器记录洗脱图,峰值部分,分Pool1(3糖)和Pool2(4-6糖)混合并冻干(图1)。再用PMP行柱前衍生[1,2]。衍生后最终样品先冻干,再溶解为1 mL,实际上样量为10 μL,检测波长245 nm。色谱条件:Pool1:缓冲体系:KH2PO40.1 mol·L-1,用KOH调pH至7.0,流速1 mL·min-1;A相含16%乙腈,B相含30%乙腈;洗脱梯度:0~30 min B相0~50%。Pool2:缓冲体系:NH4AC 0.1 mol·L-1,用CH3COOH调pH至4.5,流速0.8 mL·min-1;A相含10%乙腈,B相含25%乙腈;洗脱梯度:0~40 min B相40%~100%。寡糖标准品按同样步骤衍生,并根据浓度(1 、2、5、10和20 μg)与峰面积绘制标准曲线,标准曲线的r2>0.99,计算实际样品中的寡糖水平(图2)。
1.5 Lewis表型的确定 Lewis表型与α1,2、α1,3和α1,4岩藻糖基转移酶的表达关系见表2。
表2 Lewis表型与岩藻糖转移酶表达关系
Tab 2 Relationship between Lewis phenotypes and the expression of fucosyltransferase
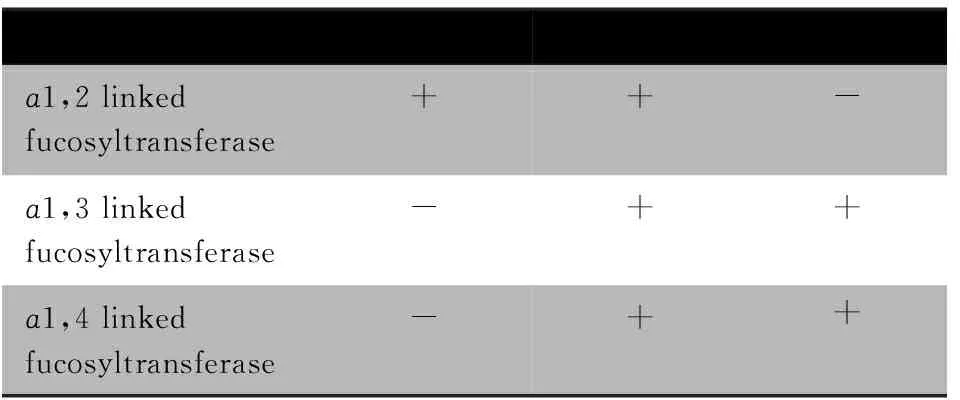
LewistypeLe(a-,b-)Le(a-,b+)Le(a+,b-)ɑ1,2linkedfucosyltransferase++-ɑ1,3linkedfucosyltransferase-++ɑ1,4linkedfucosyltransferase-++
母乳的Lewis表型可以分为3类[15]。Le(a-,b-)型:,因缺少ɑ1,3和ɑ1,4岩藻糖基转移酶,母乳中3-FL,LNFP-Ⅱ,LNFP-Ⅲ,LNDFH-Ⅱ的水平较低;因存在ɑ1,2岩藻糖转移酶2′-FL,LNFP-Ⅰ和LNDFH-Ⅰ水平较高。Le(a-,b+):母乳可检测出所有的岩藻糖基寡糖;Le(a+,b-):因不表达ɑ1,2岩藻糖基转移酶,而表达ɑ1,4和ɑ1,3岩藻糖基转移酶,母乳中2′-FL,LNFP-Ⅰ和LNDFH-Ⅰ的水平较低,3′-FL,LNFP-Ⅱ,LNFP-Ⅲ,LNDFH-Ⅱ的水平较高。亚洲人群中存在Le(a+,b+)型,其FUT2酶部分失活[16],但依据母乳中性寡糖的水平中难以判断,这可能导致在分型时将该型也归为Le(a+,b-)。
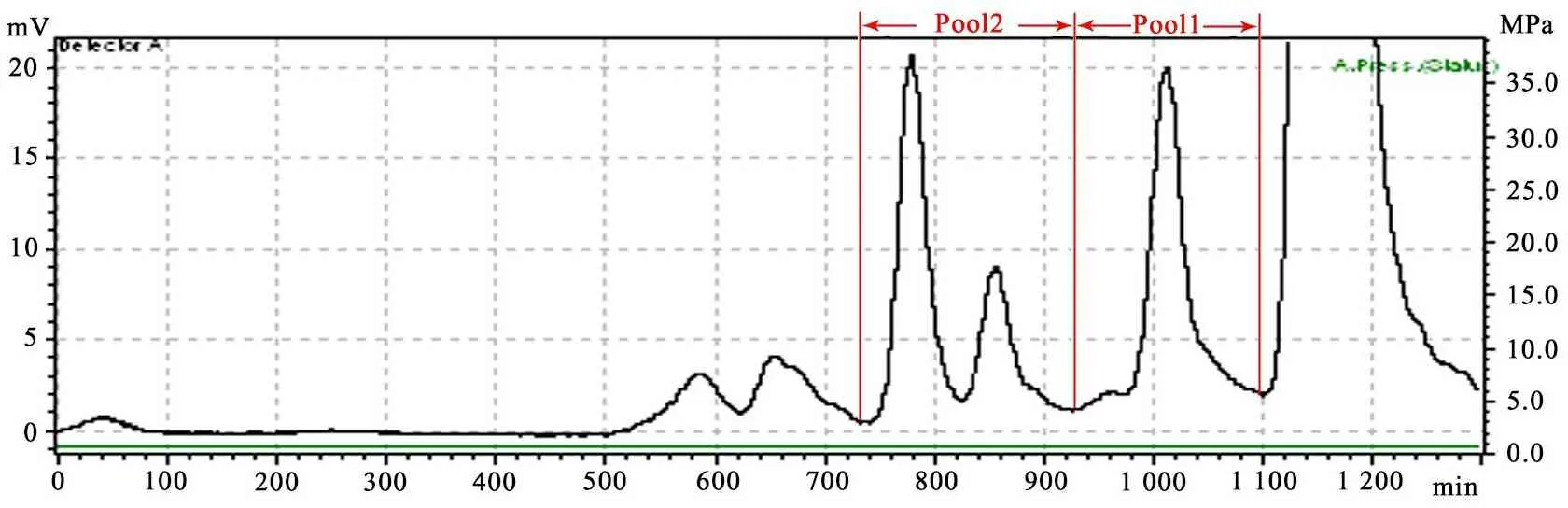
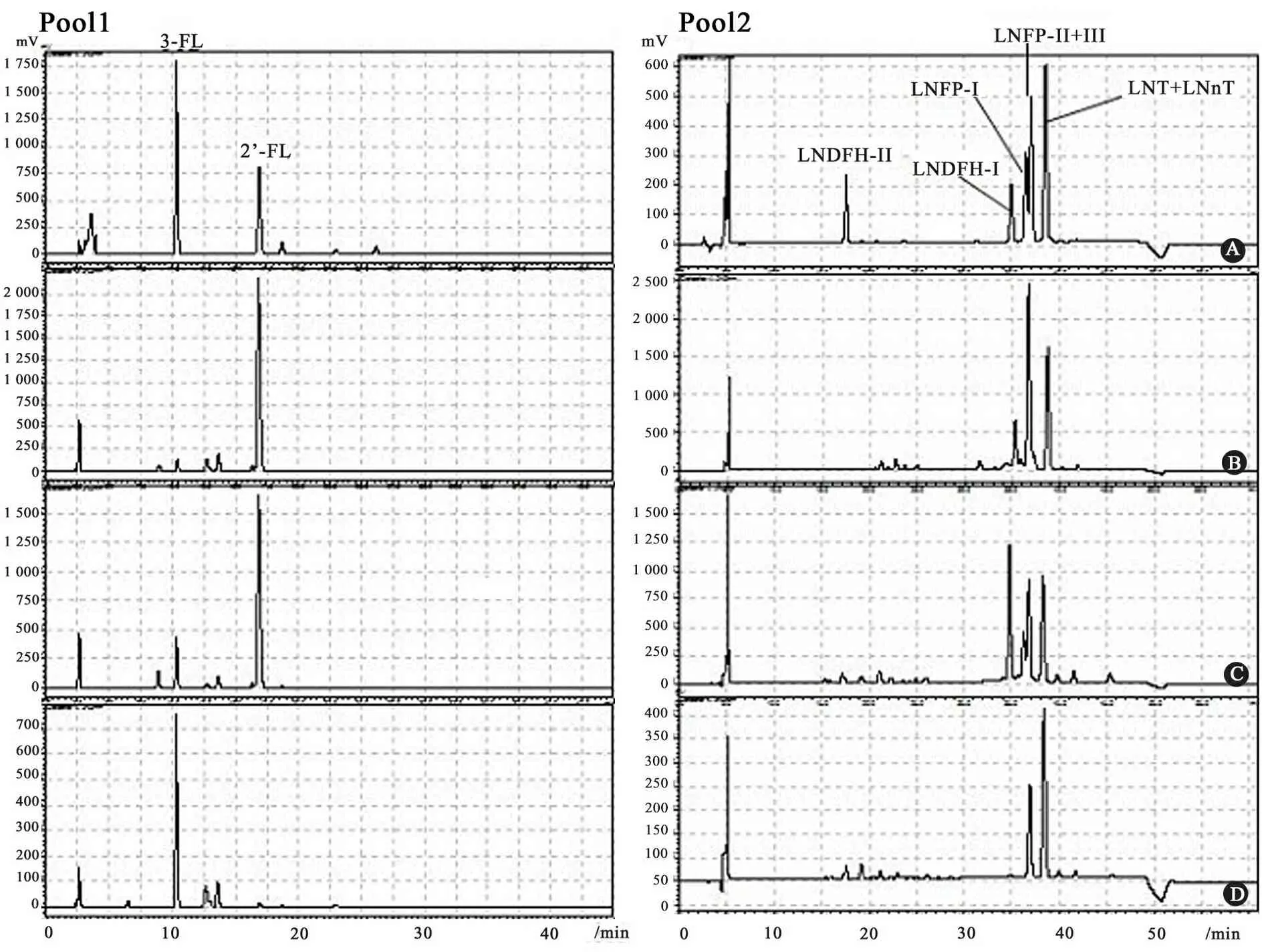
图1 凝胶层析提纯中性寡糖
图2 中性寡糖色谱分析示意图
Fig 2 HPLC analysis of neutral oligosaccharide
Notes A: standard; Pool1:B:little 3-FL in Le(a-,b-);C:3-FL and 2′-FL in Le(a-,b+);D:little 2′-FL in Le(a+,b-). Pool2:B:little LNDFH-Ⅱ、LNFP-Ⅱ+Ⅲ in Le(a-,b- );C:LNDFH-Ⅱ,LNDFH-Ⅰ,LNFP-Ⅰ and LNFP-Ⅱ+Ⅲ in Le(a-,b+);D:little LNDFH-Ⅰ and LNFP-Ⅰ in Le(a+,b-)
1.6 FUT2的SNP位点rs1047781多态性检测
1.6.1 仪器与设备 NanoDrop ND-1000紫外分光光度计(美国NanoDrop Technologies公司);PCR仪2700(美国Applied Biosystem公司);3130测序仪(美国Applied Biosystem公司)。
1.6.2 试剂 DNA Self-collection Kit(加拿大DNA Genotek公司);Hidi(美国Applied Biosystem公司);Bigdye(美国Applied Biosystem公司);5×seqbuffer(美国Applied Biosystem公司);10×buffer(瑞士Roche公司);EXONI(美国Promega公司);SAP(美国Promega公司)。
1.6.3 实验步骤 母亲唾液按标准流程提取DNA。扩增FUT2基因引物序列:正向: 5′-GCCCCCATC-TTCAGAATCAC-3′; 反向:5′-AGCAAACACCACATCACCGT-3′。测序反应体系96℃预变性10 s,进入热循环,变性96℃10 s,退火50℃ 5 s,延伸64℃ 4 min,共循环25次,64℃终延伸4 min。经洗涤烘干,离心后用ABI 3130测序仪测序,获取测序结果。
1.7 统计学方法 用SPSS 17.0进行统计分析。多样本均数之间的比较采用多个独立样本的Kruskal-Wallis检验,两样本均数的比较采用两个独立样本的Mann-WhitneyU检验。P<0.05为差异有统计学意义。
2 结果
2.1 一般情况 2008年3~12月在上海国际和平妇婴保健院产科住院的健康母亲110名进入研究。年龄22~44岁,平均(29.4±3.8)岁;身高143~179 cm,平均(167±6)cm。
78/110名进行母乳中性寡糖水平检测,其中30例在复旦大学生物医学研究院采用本研究建立的方法测定,余48例由美国麻省总医院实验室采用其实验室的方法进行分析;考虑实验方法及仪器可能存在差异,且本研究的方法缺乏内参行回收率校正,故在按基因分型分组比较时,将数据转化为各中性寡糖水平占所测总中性寡糖水平的比值再行分析。
2.2 Lewis表型的分布 根据母乳中性寡糖检测结果确定Lewis表型,Le(a-,b-)占21.8%(21/78名),Le(a-,b+)占51.3%(17/78名),Le(a+,b-)占26.9%(40/78名)。
2.3 FUT2 的SNP位点rs1047781多态性检测 FUT2是编码α1,2连接键的岩藻糖基转移酶的基因,该基因上的SNP位点rs1047781存在A/T两种变异,在人群中存在AA,AT和TT 3种基因型(图3)。105/110名母亲的唾液样本成功提取DNA完成测序,48.6%(51名)为杂合AT基因型,26.7%(28名)为纯合AA基因型,24.8%(26名)为TT基因型。任意选取其中的50例样本进行重复检测,误差率为0。
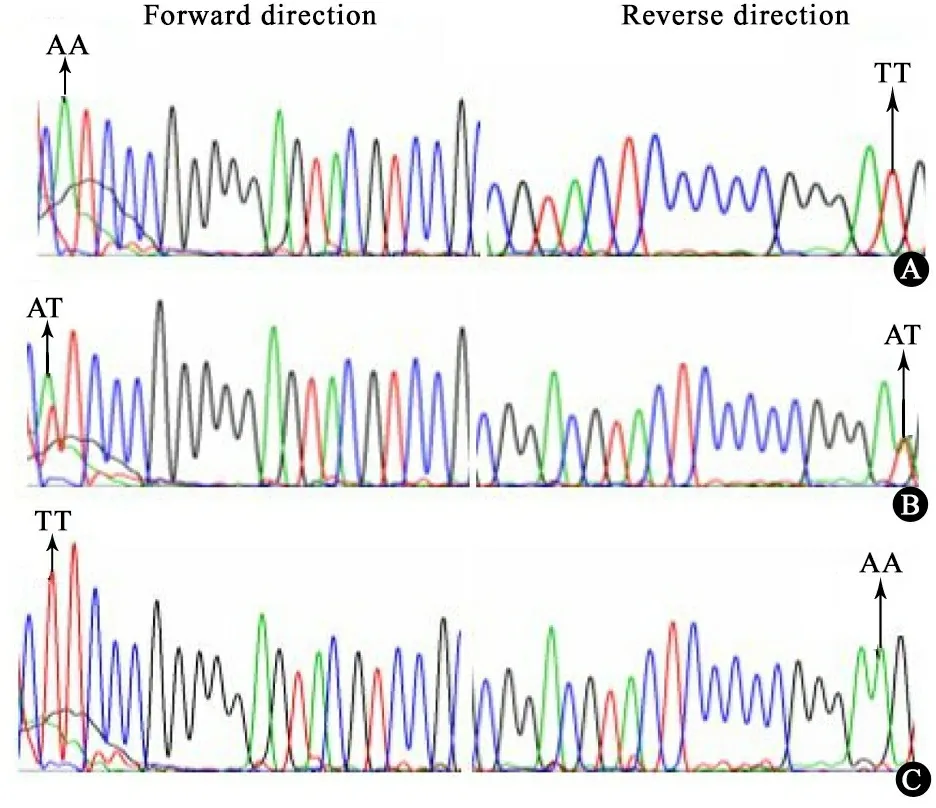
图3 SNP位点rs1047781测序图
Fig 3 Sequence containing SNP on gene FUT2
Notes A:AA;B:AT;C:TT
2.4 母亲SNP位点rs1047781多态性与中性寡糖水平关系 同时完成母乳中性寡糖检测及SNP多态性分析的样本共60例。行Hardy-Weinberg平衡检测(P=0.78),提示符合Hardy-Weinberg平衡。按不同基因型分组分析,AA型母亲α1,2连接的岩藻糖寡糖含量丰富;TT型母亲α1,2连接的岩藻糖寡糖含量很少(P<0.01);AT型母亲α1,2连接的岩藻糖寡糖浓度介于两者之间(图4)。
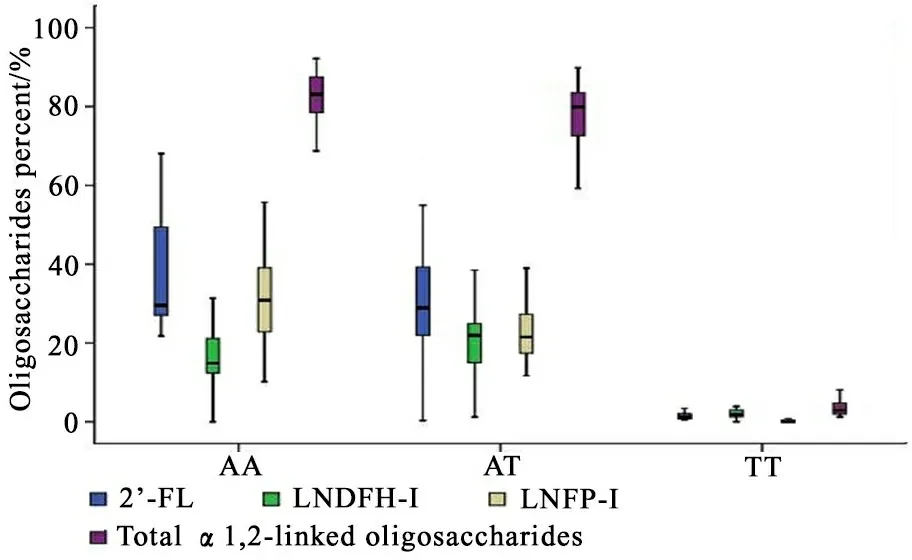
图4 不同基因型母乳α1,2连接岩藻糖基寡糖水平/总中性寡糖水平
Fig 4 ɑ1,2-linked oligosaccharides/total oligosaccharides of human milk
3 讨论
3.1 母乳中性寡糖的Lewis表型 母乳寡糖健康促进作用的基础很大程度上依赖于特殊的寡糖基序。结构变化可以产生无数母乳寡糖的不同结构,人类母乳至少含有数千种寡糖。Ninonuevo等[17]指出,在人类母乳总样本中已鉴定出大约200种母乳寡糖分子,其中主要是含有岩藻糖基的中性寡糖,岩藻糖基的连接可以有ɑ1,2、ɑ1,3和ɑ1,4等方式,完成不同连接方式相应的酶为ɑ1,2、ɑ1,3和ɑ1,4连接酶。研究认为ɑ1,2连接酶是由FUT2基因编码合成,而ɑ1,3和ɑ1,4连接酶可以由FUT3基因编码合成[18]。
本研究和其他的相关研究都发现,不同泌乳期母亲母乳中性寡糖水平存在很大的个体差异和人群差异[15,19],而且即使是同一人在不同泌乳期也有很大的不同[20,21]。Erney等[22]分析了不同地理分布泌乳期人群的乳汁样本,发现中性寡糖的水平存在地域性差异。在本研究前期发现,与课题合作方提供的美国母亲的数据相比,中国母亲母乳中性寡糖的水平明显偏低。
根据母乳中性寡糖种类和水平分类,本研究中检测的母乳样本中Lewis表型Le(a-,b-)、Le(a-,b+)和Le(a+,b-)分布与中国浙江省人群[23]的分布相似,而根据母乳中性寡糖分布特点会将Le(a+,b+)也归为Le(a+,b-),故导致本研究中Le(a+,b-)母亲的比例偏高。
因Le(a-,b-),Le(a-,b+)型约占总人群的80%,而该两型的母亲体内均有α1,2岩藻糖基转移酶的表达,故整体而言,母乳中ɑ1,2连接的岩藻糖基寡糖的水平明显高于α1,3和α1,4岩藻糖基寡糖。有国外相关文献报道证实α1,2连接的岩藻糖基寡糖具有更重要的生物学意义[24,25],其在哺乳期早期的高表达可能也与其重要的生物学功能相关。在前期研究中发现中国母亲母乳中各中性寡糖在产后2、4 和13 周变化差异很大[21],其中2′-FL与3′-FL 持续上升,而LNFP-Ⅰ则持续下降,LNFP-Ⅱ,LNFP-Ⅲ,LNDFH-Ⅰ无明显变化。母乳中性寡糖随时间变化产生的差异,也提示了某些特定种类的中性寡糖对婴儿健康可能具有更重要的促进作用。
3.2 FUT2的SNP位点rs1047781多态性对母乳岩藻糖寡糖水平的影响 本研究选取了FUT2的另一个SNP位点rs1047781进行研究。观察到FUT2的SNP位点rs1047781 A/T多态性可影响母乳中α1,2连接岩藻糖基寡糖的表达。AA基因型母亲因为不能编码α1,3和α1,4岩藻糖基转移酶,因此母乳中α1,3或α1,4连接岩藻糖基寡糖水平非常低;另外,母乳中可能由于缺乏与α1,2岩藻糖基转移酶竞争底物的酶,使α1,2连接岩藻糖基寡糖水平较高。相反,TT基因型母亲母乳中α1,3和α1,4连接岩藻糖基寡糖水平丰富,而α1,2连接岩藻糖基寡糖水平较低。AT基因型母亲α1,3和α1,4连接岩藻糖基寡糖的水平,α1,2连接岩藻糖基寡糖的水平都介于AA型和TT基因型母亲之间。本研究结果可以推测,FUT2基因SNP位点rs1047781具A/T多态性,是控制中国母亲表达α1,2连接岩藻糖基转移酶的关键位点。
本研究的不足之处和局限性:本课题在实验方法学上进行了尝试,但检测效率较低,单样本耗时太长,完整分析一个样本约需24 h,且无内参进行回收率校正,仅为半定量检测。同时,母乳样本收集的时间,母乳的保存时间,母亲的身体状态,都有可能对母乳中性寡糖水平产生影响。故在实验方法学上尚需进一步完善。目前针对中国母亲母乳中性寡糖的研究报道罕见,进一步的研究有赖于更大样本及较长时间的纵向随访。
[1]Gartner LM, Morton J, Lawrence RA, et al. Breastfeeding and the use of human milk. Pediatrics, 2005, 115(2): 496-506
[2]Newburg DS, Walker WA. Protection of the neonate by the innate immune system of developing gut and of human milk. Pediatr Res, 2007, 61(1): 2-8
[3]Morrow AL, Ruiz-Palacios GM, Altaye M, et al. Human milk oligosaccharides are associated with protection against diarrhea in breastfed infants. J Pediatr, 2004,145(3):297-303
[4]Newburg DS, Ruiz-Palacios GM, Morrow AL. Human milk oligosaccharides protect against enteric pathogens. Annu Rev Nutr, 2005, 25(1): 37-58
[5]Macfarlane GT, Steed H, Macfarlane S.Bacterial metabolism and health-related effects of galacto-oligosaccharides and other prebiotics.J Appl Microbiol, 2008,104(2):305-344
[6]German JB, Freeman SL, Lebrilla CB, et al.Human milk oligosaccharides: evolution, structures and bioselectivity as substrates for intestinal bacteria.Nestle Nutr Workshop Ser Pediatr Program, 2008,62:205-218
[7]Gusils C, Morata V, Gonzalez S. Determination of bacterial adhesion to intestinal mucus. Methos Mol Biol, 2004, 268: 411-415
[8]Boehm G, Stahl B,Jelinek J, et al. Prebiotic carbohydrates in human milk and formulas. Acta Pediatrica, 2005, 94(S 449): 18-21
[9]Arslanoglu S, Moro GE, Schmitt J, et al. Early dietary intervention with a mixture of prebiotic oligosaccharides reduces the incidence of allergic manifestations and infections during the first two years of life. J Nutr, 2008, 138 (6): 1091-1095
[10]Stepans MB, Wilhelm SL, Hertzog M, et al.Early consumption of human milk oligosaccharides is inversely related to subsequent risk of respiratory and enteric disease in infants.Breastfeed Med,2006,1(4):207-215
[11]Van Liempt E, Bank CM, Mehta P, et al. Specificity of DC-SIGN for mannose- and fucose-containing glycans. FEBS Lett, 2006, 580(26): 6123-6130
[12]Hong P, Ninonuevo MR, Lee B, et al. Human milk oligosaccharides reduce HIV-1-gp120 binding to dndritic cell-specific ICAM3-grabbing non-integrin(DC-SIGN). Br J Nutr, 2009, 101(4): 482-486
[13]Leo F, Asakuma S, Nakamura T, et al. Improved determination of milk oligosaccharides using a single derivatization with anthranilic acid and separation by reversed-phase high-performance liquid chromatography. J Chromatogr, 2009, 1216(9): 1520-1523
[14]Asakuma S, Urashima T, Akahori M, et al.Variation of major neutral oligosaccharides levels in human colostrum.Eur J Clin Nutr, 2008,62(4):488-494
[15]Musumeci M, Simpore J, D'Agata A, et al.Oligosaccharides in colostrum of Italian and Burkinabe women.J Pediatr Gastroenterol Nutr, 2006,43(3):372-378
[16]Chang JG, Yang TY, Liu TC, et al. Molecular analysis of secretor type A(1,2) fucosyltransferase gene mutations in the Chinese and Thai populations. Transfusion, 1999, 39 (9): 1013-1017
[17]Ninonuevo MR, Park Y, Yin H, et al. A strategy for annotating the human milk glycome. J Agric Food Chem, 2006, 54(20): 7471-7480
[18]Oriol R, Mollicone R, Cailleau A, et al. Divergent evolution of fucosyltransferase genes from vertebrates,invertebrates, and bacteria. Glycobiology, 1999, 9(4): 323-334
[19]Sumiyoshi W, Urashima T, Nakamura T, et al.Determination of each neutral oligosaccharide in the milk of Japanese women during the course of lactation.Br J Nutr,2003,89(1):61-69
[20]Chaturvedi P, Warren CD, Altaye M, Morrow AL, Ruiz-Palacios G, Pickering LK, Newburg DS. Fucosylated human milk oligosaccharides vary between individuals and over the course of lactation. Glycobiology, 2001, 11(5): 365-372
[21]Yao W(姚文), Zhang ZJ, Zhou TT, et al. Variations of neutral oligosaecharides concentration in Chinese maternal breast milk. Chinese Journal of Child Health Care(中国儿童保健杂志), 2009, 17(3):251-253
[22]Erney RM, Malone WT, Skelding MB, et al. Variability of human milk neutral oligosaccharides in a diverse population. J Pediatr Gastroenterol Nutr, 2000, 30(2): 181-192
[23]Xu XG(许先国), Zhu FM, Hong XZ, et al. FUT3 gene polymorphism associated with Lewis blood group in Chinese Zhejiang population. Journal of Experimental Hematology(中国实验血液学杂志), 2006, 14(3): 601-604
[24]Morrow AL, Ruiz-Palacios GM, Xi Jiang, et al. Human-Milk Glycans That Inhibit Pathogen Binding Protect Breast-feeding Infants against Infectious Diarrhea. J Nutr, 2005, 135(5): 1304-1307
[25]Newburg DS, Ruiz-Palacios GM, Altaye M, et al. Innate protection conferred by fucosylated oligosaccharides of human milk against diarrhea in breastfed infants. Glycobiology, 2004, 14(3): 253-263
