准平衡理论在CH4+CO2水合物法分离中的应用
2011-01-22唐建峰曾大龙王传磊
唐建峰,曾大龙,王传磊
(中国石油大学储运与建筑工程学院,山东青岛 266555)
准平衡理论在CH4+CO2水合物法分离中的应用
唐建峰,曾大龙,王传磊
(中国石油大学储运与建筑工程学院,山东青岛 266555)
采用全新的准平衡过程理论,对定容二元混合气体的水合物生成过程进行模拟,并将模拟的平衡终态与CSMGem软件预测值进行对比。结果表明:该模型可以精确预测最终平衡状态,所得平衡压力与CSMGem预测的相对误差不超过3%;准平衡理论与反应驱动力关联建立的模型可以反映出水合物生成过程中各参数的变化趋势;在定容体系中,可以通过水合物法进行CH4+CO2混合气的分离,CH4在气相得到提浓,CO2在水合物相中富集,并且随着反应的进行,系统压力的降低幅度减小,最终达到平衡状态,且高压低温条件对CO2气相的提浓起促进作用。
水合物;气体分离;准平衡过程;相平衡;模型预测
当混合气体生成水合物时,气体组分在水合物相和气相的组成有所不同,利用水合物对于不同气体分子的选择包络特性,可以对气体混合物进行分离。马昌峰等[1]首次提出水合物法分离含氢气体,并建立了一套水合物分离装置;许维秀等[2]综述了水合物法气体分离的技术进展,指出了水合物法分离技术在天然气工业上的应用;Sebastien等[3]采用气量仪分别测量了CO2、CH4在液相与水合物相中的摩尔分数的变化,得到了CO2、CH4的生成动力学数据。此外,通过添加特定的水合物促进剂,可以提高分离效果,樊栓狮等[6]提出了以四丁基溴化铵(TBAB)为促进剂来分离CO2+N2混合气体,研究了进气压力、气液体积比对水合物形成过程压降的影响。综述水合物法气体分离方面的文献可知,大多数研究主要针对最终平衡状态时的分离效率以及促进剂对分离效果的提高,并未关注水合物生成过程中的各气体组成变化。研究整个水合物生成过程中组分的变化情况,将对水合物法分离技术的工业应用起到促进作用,对水合物分离器的设计和操作均有一定的指导意义。Kobayashi等[5]指出可以将水合物形成过程视为由一系列准平衡过程构成,通过准平衡过程的累加,系统最终达到平衡状态。笔者试图利用准平衡过程理论,模拟定容体系CH4+CO2的水合物生成过程,得到最终平衡状态气相组成以及水合物形成历程中各参数的变化情况,并与试验结果对比,评估该模型的预测效果。
1 理论模型
1.1 模型原理
在定容体系中,水合物的成核和生长需要很长的诱导期[6],从水合物颗粒形成到聚集的整个过程中,气体分子从气相不断进入富水相中,并与水分子络合形成笼状的水合物颗粒。通常反应装置的控制温度具有一定的滞后效应,因此局部区域的水合物形成温度往往比系统控制温度高。定容系统起初具有一定的过压度,通过一系列不可逆的水合物生成过程的累积,系统最终过压度为0,不再具有生成水合物的驱动力。所以,可以将水合物的形成过程视为由一系列的准平衡过程构成,准平衡过程贯穿于整个水合物生成过程,直到系统最终达到平衡状态。笔者通过此基本理论,并结合精确的相平衡模型,预测定容二元体系的水合物系统各相组成。模型具体原理见图1。

图1 准平衡过程模型原理图Fig.1 Diagram of quasi-equilibrium process model
如图1,在定容体系中,气相有二元组分CH4和CO2,初始压力为 p0,CH4的初始组成为 yme,CO2的初始组成为ycd,当反应开始后,气相空间的一定量分子Ngas,hyd进入富水相,与水结合生成水合物,忽略溶解度的影响,水合物相中 CH4含量为 xme,1,CO2含量为xcd,1,由于进入水合物相中的 CH4、CO2量不同,所以气相的二元组成也会发生变化,变为yme,1,ycd,1,此时系统达到第1步准平衡。直到第i步准平衡反应后,气相仍有一定量分子Ngas,hyd进入水合物相,此时气相和水合物相的组成发生改变,变为第i+1步平衡。在水合物生成过程中,气相空间的分子数逐渐减少,压力逐渐降低,当气相空间的组成和压力所决定的水合物生成温度低于系统控制温度Texp时,水合物生成历程结束,系统过压度为0,达到平衡状态,此时气相的 CH4组成为 yme,eq,CO2组成为ycd,eq,相应的水合物相中 CH4的组成为 xme,eq,CO2的组成为xcd,eq。模型通过改变气相进入水合物相的分子数Ngas,hyd,可以调整达到最终平衡的总步数。
1.2 模型的假设条件
(1)认为定容系统中水合物的生成是由一系列的准平衡过程组成。原因在于水合物的成核和生长需要很长时间,每一步准平衡过程生成的水合物量很小并且系统的控制温度具有一定的滞后效应,所以此假设对于模拟定容系统二元组分水合物的生成是可行的。
(2)忽略富水相中气体的溶解度。原因在于富水相中溶解的气量与水合物相中的气量相比很小,但这并不意味着富水相中的气体溶解度对水合物生成没有影响,在水合物动力学研究范畴,溶解度对于水合物的成核有着及其重要的作用[7]。因为本模型主要探讨气体混合物利用水合物法分离的可行性与优化条件的选择,所以对水合物成核动力学不作详细分析,但当需要考虑生成水合物的成核时,必须分析水合物的动力学特性。
(3)采用Chen-Guo模型进行相平衡的计算,同样可以采用其他的相平衡模型,如van der Waals-Platteeuw模型[12]。一些商业的水合物软件也可以被嵌套在本模型中。
1.3 模型的算法
对于定容系统二元气体混合物的模拟,系统初始压力p0和控制温度Texp已知,需要预测各气体组分在不同相的组成,并进而分析水合物法气体分离的可行性以及最优温压条件。基于前述的模型原理,可编制程序求取系统最终平衡压力,以及各气体组分在气相和水合物相中的分率。算法实现时,水合物生成的平衡温度Ti采用Chen-Guo模型[13]计算,状态方程选用P-R方程,在Chen-Guo模型中,采用Newton-Raphson进行平衡温度的迭代求取。通过累加每一步准平衡过程中水合物相各气体分子数,最终得到水合物相中各气体的分率。对不同p0和Texp进行模拟,得出水合物法气体分离的规律。对于CH4+CO2二元体系,具体的计算步骤如下:
(1)输入基础数据,包括定容体系初始压力p0、体系控制温度Texp、反应釜气相空间体积V、气体组成yme、ycd和每一步准平衡过程气相进入水合物相的分子数 Ngas,hyd。
(2)计算yme,ycd和p0下体系的水合物生成温度T1。
(3)判断水合物生成温度 T1,若 T1<Texp,则系统无水合物生成,若T1>Texp,则进行步骤(4)。
(4)减少气相空间分子数Ngas,hyd,并利用相平衡模型计算Ngas,hyd中的甲烷和二氧化碳分子数,最后求出下一步平衡的新气相组成 yme,i、ycd,i。
2 模型的验证
为了计算各个系统压力下的平衡温度Ti,必须选择适当的相平衡模型,本理论选择Chen-Guo相平衡模型求算平衡温度Ti,状态方程选用P-R方程,为使算法收敛,采用Newton-Raphson迭代。为了验证Chen-Guo模型的准确性,对比了Chen-Guo相平衡模型和文献数据[10],见图2(图中浓度指摩尔浓度)。
从图2看出,Chen-Guo模型对二元组分的相平衡计算有很高的精度,对纯组分以及混合组分水合物生成温度预测值的相对误差不超过0.21%。相平衡模型的准确性对本理论的准确性有极大的影响。Chen-Guo模型中可调参数较少,编程容易且算法易于收敛,故采用Chen-Guo模型进行相平衡计算。

图2 Chen-Guo/CSMGem模型预测值与文献值对比Fig.2 Comparison between Chen-Guo/CSMGem model predicted and literatures
2.1 平衡状态时各参数的预测
将定容系统二元水合物生成过程视为由一系列准平衡过程构成,这一系列过程最终稳定在某一特定状态下,也就是说进料在平衡压力peq和系统温度Texp下进行了重新的相分配,故可以利用CSMGem闪蒸模块在进料和平衡气相分率一定的情况下对peq进行预测,从而可以考核本文理论的准确性。
利用本文模型模拟定容体系二元组分的水合物法分离,选取不同的温度、压力条件,以及不同的原料气组成,结果见表1。

表1 不同工况的模型预测值Table 1 Model prediction under different conditions
从表1可以得出,在定容二元体系中,CH4和CO2在一定的初始压力下,生成水合物并达到平衡后,系统的气相组成发生了改变。从模拟数据看出:当系统的控制温度和初始进料组成一定,平衡压力随初始压力的增大而增大;随着初始压力的增大,CH4在气相富集,CO2在水合物相富集,说明采用水合物法对混合气进行分离是可行的;CO2比CH4更容易生成水合物。同样,在初始压力和进料组成一定的情况下,系统平衡压力随初始温度的降低而降低,而且随着温度的降低,CH4在气相富集,CO2在水合物相富集,所以低温和高压对CH4+CO2混合气的分离有促进作用。
对不同初始CO2浓度的混合气进行模拟,结果显示,在很大的CO2浓度范围内,水合物法气体分离均有一定的效果。
上述的定容过程中,系统最终达到平衡状态,CSMGem可以在平衡气相组成以及体系温度已知的条件下预测平衡压力值,通过以上数据的对比得知,准平衡理论与CSMGem对平衡压力的预测误差不超过3%。从CSMGem计算结果也可以得出,气体在富水相中的溶解度很小,故本理论模型忽略溶解度是可行的。
2.2 水合物生成历程中各参数的模拟
因为模型假设水合物生成过程是由一系列的准平衡过程构成,因此模型不仅可以对定容体系平衡状态时的各相组成进行预测,也可以反映水合物生成过程中各参数的变化情况。针对CH4+CO2混合气进行以下模型预测以及试验研究:初始气源摩尔组成为22%CH4+78%CO2,初始压力为5.0 MPa,系统控制温度为4.67℃,水过量;试验装置和试验步骤与文献[11]类似;试验采用自行设计的装置,主要由供气系统、配液系统、注液系统、可变体积反应釜、温度控制系统、压力控制系统、温度和压力测量采集系统等部分组成,气相组成通过Varian气相色谱器测量。
运用准平衡理论,假定每步准平衡过程由气相进入水合物相的气体分子数为初始气相总分子数的1/10000,经程序运算,达到最终平衡共迭代4 199步,也就是把整个水合物的生成过程看作是由4199步准平衡过程构成。其中每一步准平衡过程中从气相进入液相的分子数 Ngas,hyd为 8.4711×10-5mol。系统最终平衡压力为2.454 MPa。但是,考虑到水合物形成的初始阶段,反应釜内的推动力较大[12],所以在初始阶段,进入液相的分子数Ngas,hyd比随后阶段的分子数要多,所以有必要将Ngas,hyd和系统压力进行关联,得到新的Ngas,hyd*,即
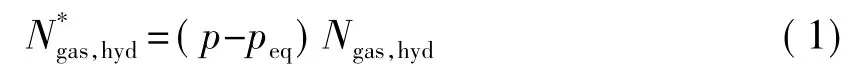
系统压力的对比见图3,气相CH4和CO2组成的变化见图4。

图3 水合物生成过程中压力变化曲线Fig.3 Pressure change curve during hydrate formation process
从图3、4可以看出:准平衡理论可以反映出CH4+CO2二元混合气体水合物生成过程中的参数变化趋势,随着水合物的生成,气相压力的降低幅度减小,最终达到平衡状态,而且随着反应的进行,CO2在水合物相得到富集,CH4在气相得到富集;在不添加任何促进剂的情况下,达到最终平衡状态至少需要9 h,运用改进后的准平衡理论,算法需要迭代约12000步。需要注意的是,不能将准平衡步数同反应时间简单等同,因为本理论没有深入到水合物生成动力学范畴。从图3和图4中还可以看出,试验与模拟结果相比,仍有一定的偏差,尤其压力变化呈现阶梯状,原因在于本试验采用间歇性搅拌,导致反应釜在搅拌之后,气液界面接触面积增大,水合物生成量骤然增加,导致压力阶梯状下降。试验没有采用连续性搅拌的原因在于搅拌产生的热不能及时被反应釜外的制冷循环带出,会阻碍水合物的生成速率。所以整体而言,准平衡理论对体系压力、气相组分变化有一定精度的预测。

图4 水合物生成过程中气相CH4、CO2组成变化曲线Fig.4 Gas phase composition curves of methane and carbon dioxide during hydrate formation process
运用准平衡理论得到系统的温度变化曲线见图5。从图中可以看出,随着反应的进行,准平衡温度逐渐降低,最终趋近于系统的控制温度,从而说明随着反应的进行,系统的驱动力逐渐降低。

图5 水合物生成过程中温度变化曲线Fig.5 Temperature Change curve during hydrate formation process
从以上的模型预测与试验图表可以看出,运用准平衡理论模拟定容体系水合物生成过程是可行的,通过将每一步准平衡的气体消耗量同反应的驱动力关联后,改进的模型对水合物生成过程中的压力和气相组分都有很好的近似。
3 结论
(1)在定容体系中,运用该理论预测的平衡压力与水合物软件CSMGem的预测值相对误差不超过3%,高压低温对分离起促进作用,该理论忽略富水相中气体溶解度是可行的。
(2)针对气源22%CH4+78%CO2和初始压力5.0 MPa进行试验,试验气相压力和组分变化与该理论预测结果的对比证实该理论可以反映水合物生成历程中的参数变化趋势。
(3)可以通过水合物法进行气体分离,针对CH4+CO2混合气,CO2在水合物相得到富集,CH4在气相得到提浓,同时在无添加剂的情况下反应需要较长的时间。
[1]马昌峰,王峰,孙长宇,等.水合物氢气分离技术及相关动力学研究[J].石油大学学报:自然科学版,2002,26(2):76-78.
MA Chang-feng,WANG Feng,SUN Chang-yu,et al.separation technique of hydrogen and relevant kinetic research[J].Journal of the University of Petroleum,China(Edition of Natural Science),2002,26(2):76-78.
[2]许维秀,李其京,陈光进.水合物法分离炼厂气的技术进展[J].河南化工,2006,23:14-16.
XIU Wei-xiu,LI Qi-jing,CHEN Guang-jin.The technical development of refinery gas separation based on hydrate technique[J]. Henan ChemicalEngineering,2006,23:14-16.
[3]SEBASTIEN BERGERON,PHILLIP SERVIO.CO2and CH4mole fraction measurements during hydrate growth in a semi-batch stirred tank reactor and its significance to kinetic modeling[J].Fluid Phase Equilibria,2009,276:150-155.
[4]樊栓狮,李士风,王金渠,等.以TBAB为促进剂水合物法分离混合气中CO2[C]//第十届中国科协年会.CO2减排和绿色化利用与发展研讨会论文集,郑州,2008:166-170.
[5] TSUJI H,KOBAYASHI T,OKANO Y,et al.Thermodynamic simulations of isobaric hydrate-forming operations:formulation of computational scheme and its application to hydrate formation from methane+ethane+propane mixture[J].Energy Fuels,2005,19(4):1587-1597.
[6] SKOVBORG P,NG H J,RASMUSSEN P,et al.Measurement of induction times for the formation of methane and ethane gas hydrates[J].Chem Eng Sci,1993,48(3):445-453.
[7]GRAYDON K ANDERSON.Solubility of Carbon Dioxide in Water under Incipient Clathrate Formation Conditions[J].J Chem Eng Date,2002,47:219-222.
[8] VAN DER WAALS J A,PLATTEEUW J C.Clathrate Solutions[J].Adv Chem Phys,1959,2:2-57.
[9]陈光进,孙长宇,马庆兰.气体水合物科学与技术[M].北京:化学工业出版社,2007:9-10.
[10]SLOAN ED.Clathrate hydrate of natural gases[M].3rd ed.New York:CRC Press,2007:411;409;365.
[11]陈玉亮,李玉星,唐建峰,等.水合物分离CO2+N2混合气实验与模拟计算[J].化工进展,2010,29:66-73.
CHEN Yu-liang,LI Yu-xing,TANG Jian-feng,et al.The experiment and prediction of carbon dioxide and methane hydrate separation[J].Chemical Industry and Engineering Progress,2010,29:66-73.
[12]KASHCHIEV D,FIROOZABADI A.Driving forces for crystallization of gas hydrates[J].Journal of Crystal Growth,2002,241:220-230.
Application of quasi-equilibrium theory in CH4+CO2separation model based on hydrate formation
TANG Jian-feng,ZENG Da-long,WANG Chuan-lei
(College of Pipeline and Civil Engineering in China University of Petroleum,Qingdao 266555,China)
Based on the quasi-equilibrium process theory,the hydrate formation process of binary gases was simulated.The equilibrium final state was compared with the predictive value of software CSMGem.The results show that new model can accurately predict the final equilibrium state.The relative error of the equilibrium pressure and the prediction from CSMGem is less than 3%.In addition,the new model can also reflect the change of relevant parameters in the process of hydrate formation through combining with the driving force factor of process.In the constant volume system,CH4will be concentrated in gas phase while CO2in hydrate phase through hydrate separation method.The reduced magnitude of system pressure decreased in the process of hydrate formation.High pressure and low temperature conditions play a positive role on the separation effect.
hydrate;gas separation;quasi-equilibrium process;phase equilibrium;model prediction
TE 122.1
A
10.3969/j.issn.1673-5005.2011.05.020
1673-5005(2011)05-0109-05
2011-07-13
山东省自然科学基金项目(Z20937b2804027);中央高校基金科研业务费专项资金资助项目(10CX04012A)
唐建峰(1973-),男(汉族),山东邹平人,副教授,博士研究生,主要从事天然气水合物、天然气输配及集输系统优化等研究。
(编辑 韩国良)
