常见多汁类水果、蔬菜的总抗氧化活性的研究
2011-01-19董静洲孙紫薇
芦 双,董静洲,孙紫薇
(1.湖北民族学院 生物科学与技术学院,湖北 恩施 445000; 2.华南师范大学 生命科学学院,广东 广州 510631)
大量研究证明,果蔬复合汁饮料集中了水果和蔬菜的精华,使营养与保健合为一体.蔬菜中膳食纤维与饱和脂肪酸相互作用,阻止胆固醇的形成,与胆酸结合后排出体外,从而使引起动脉粥样硬化的血浆胆固醇相对减少,达到防病治病的目的[1].水果中含有丰富的各种天然抗氧化物质如(类)胡萝卜素、SOD、维生素 C、维生素 E、多酚类物质和活性多糖等,能够有效的清除体内多余的自由基,从而中断脂质氧化链式反应,起到保护细胞和组织的作用,这样就避免了人体正常功能遭到自由基的破坏,也就发挥了保健作用[2-9].
我们知道,水果蔬菜的疗疾、治病、保健的功效大都或多或少的与果蔬的抗氧化活性有着千丝万缕的联系.然而,在水果蔬菜总抗氧化活性的评价方面,国内外学者的研究较少,鲜有报道.此前,陈守江等[10]有过一些涉入,但主要是针对少数几种商品果蔬汁饮料和新鲜果蔬展开的,局限性较大.本研究则广泛采集了市场上常见的、廉价的近40种水果蔬菜进行了比较系统的研究,对于指导人们健康生活饮食具有切实意义,同时丰富了果蔬饮料研究的理论基础.
1 实验材料、试剂与仪器
1.1 实验材料
实验材料主要购自于湖北省恩施州恩施市三孔桥好又多购物广场和武商量贩(湖北恩施博文店),部分蔬菜水果来源于集市零购.
1.2 实验仪器
HANGPING1004型电子天平(上海天平仪器厂);HH-4型恒温水浴锅(江苏全坛新一佳仪器厂);XMT-152A数显温控(浙江宁波自动化仪表研究所); 800型离心沉淀器(上海手术器械厂);WFJ7200型可见分光光度计(尤尼柯上海仪器有限公司).
1.3 实验试剂
芦丁(中国药品与生物制品检定所)、DPPH(1,1-diphenyl-2-picrylhydrazy,美国Sigma公司)和维生素C(天津石英钟厂霸州市化工分厂),其它为化学分析纯.
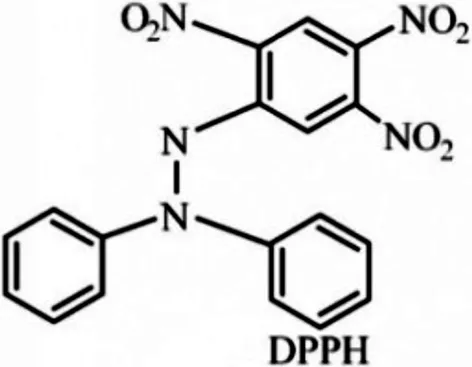
图1 DPPH化学结构示意图Fig.1 Chemical structure of DPPH
2 实验方法
2.1 果蔬鲜汁和芦丁、DPPH溶液以及维生素C的制备
2.1.1 果蔬鲜汁的制备[11-12]将市售水果蔬菜洗净晾干,小刀切碎后用纱布取汁,离心后4℃冰箱密封避光保存,备用.
2.1.2 芦丁标准品的制备 精确称取于105℃干燥至恒重的芦丁对照品50 mg,95%乙醇溶解,摇匀,定容至50 mL,得浓度为1 mg/mL的芦丁标准品储备液,4℃冰箱密封保存,备用.
2.1.3 DPPH标准品的制备 精确称取DPPH标准品30 mg,70%乙醇溶解,摇匀,定容至250 mL,得浓度为0.3 mmol/L的DPPH标准品储备液,4℃冰箱密封保存,备用.
2.1.4 维生素C标准品的制备 精确称取于105℃干燥至恒重的Vit C标准品50 mg,70%乙醇溶解,摇匀,定容至50 mL,得浓度为1 mg/mL的Vit C标准品储备液,4℃冰箱密封保存,备用.
2.2 果蔬总抗氧化活性的测定
2.2.1 DPPH测定法[2-3]DPPH是一种很稳定的以N为中心的自由基(见图1),若受试物能将其清除,则提示受试物有降低羟自由基、烷自由基或过氧自由基等自由基和打断脂质过氧化链反应的作用.DPPH实际上是以DPPH·的形式存在的,故有单个电子,在517 nm波长处有强吸收,其乙醇水溶液呈很深的蓝紫色,在加入受试物后,在517 nm波长处可以动态监测DPPH被清除的效果,这种效果通常用对DPPH的抑制率来表示.显然,抑制率越大,DPPH自由基清除越彻底,受试物的抗氧化性也就越强.分别准确量取将一定浓度的待测样品0.1 mL加入5 mL的比色管中,各加入浓度为0.6 mmol/L的DPPH溶液3.5 mL,用蒸馏水定容至5 mL,室温下静止反应30 min后,在517 nm出测定吸光度,因体系内DPPH自由基的浓度与其吸光度成正比,所以可以直接以下式来计算对DPPH的清除率[13]:DPPH·自由基的清除率=[Ao-(Ai-Aj)]/Ao,式中:Ao为未加入待测样品时的DPPH吸光度,Ai为加入待测样品后DPPH的吸光度,Aj为DPPH与待测样品反应的吸光度.
2.2.2 各类水果总抗氧化活性的测定 取22只带塞的小型试管,编号1~22,各加入上述2.1.3中的DPPH稀释成的0.1 mmol/L的工作液3.5 mL,然后用移液枪分别精密吸取2.1.1中的新鲜果汁待测样品100 μL依次加入2~22号试管中,1号试管加入100 μL 70%乙醇,密封静置避光反应30 min后在517 nm波长处测定吸光度.重复三次,取平均值.
2.2.3 各类蔬菜总抗氧化活性的测定 取16只带塞的小型试管,编号1~16,各加入上述2.1.3中的DPPH稀释成的0.1 mmol/L的工作液3.5 mL, 然后用移液枪分别精密吸取2.1.1中的新鲜蔬菜汁待测样品100 μL依次加入2~16号试管中,1号试管加入100 μL 70%乙醇,密封静置避光反应30 min后在517 nm波长处测定吸光度.重复三次,取平均值.
2.3 芦丁和维生素C清除DPPH标准曲线的绘制
2.3.1 芦丁清除DPPH标准曲线的绘制 精密吸取芦丁储备液1.0、2.0、4.0、5.0、6.0、8.0、10.0 mL于10 mL容量瓶中,用70%乙醇定容至10 mL,混匀.取七只带塞的小型试管,编号1~7,各加入上述2.1.2中的DPPH稀释成的0.1 mmol/L的工作液3.5 mL, 然后用移液枪分别吸取七种不同浓度的芦丁待测样品100 μL于七只试管中,静置避光反应30 min后在517 nm波长处测定吸光度.重复三次,取平均值.
2.3.2 维生素C清除DPPH标准曲线的绘制 精密吸取维生素C储备液1.0、2.0、4.0、5.0、6.0、8.0、10 mL于10 mL容量瓶中,用70%乙醇定容至10 mL,混匀.取七只带塞的小型试管,编号1~7,各加1入上述2.1.3中的DPPH稀释成的0.1 mmol/L的工作液3.5 mL, 然后用移液枪分别吸取七种不同浓度的维生素C待测样品100 μL于七只试管中,静置避光反应30 min后在517 nm波长处测定吸光度.重复三次,取平均值.
3 结果与分析
3.1 芦丁的抗氧化活性作用
根据2.3.1芦丁与DPPH反应后的吸光度的实验结果,作出了芦丁清除DPPH自由基的能力随芦丁浓度变化的曲线图,如图2.
3.2 维生素C的抗氧化活性作用
根据2.3.2维生素C与DPPH反应后的吸光度的实验结果,作出了维生素C清除DPPH自由基的能力随维生素C浓度变化的曲线图,如图3.

图2 芦丁清除DPPH自由基曲线图 图3 维生素C清除DPPH自由基曲线图
3.3 水果的总抗氧化活性作用
利用DPPH法测定常见的21种多汁类水果鲜汁的总抗氧化活性,统计结果见表1.
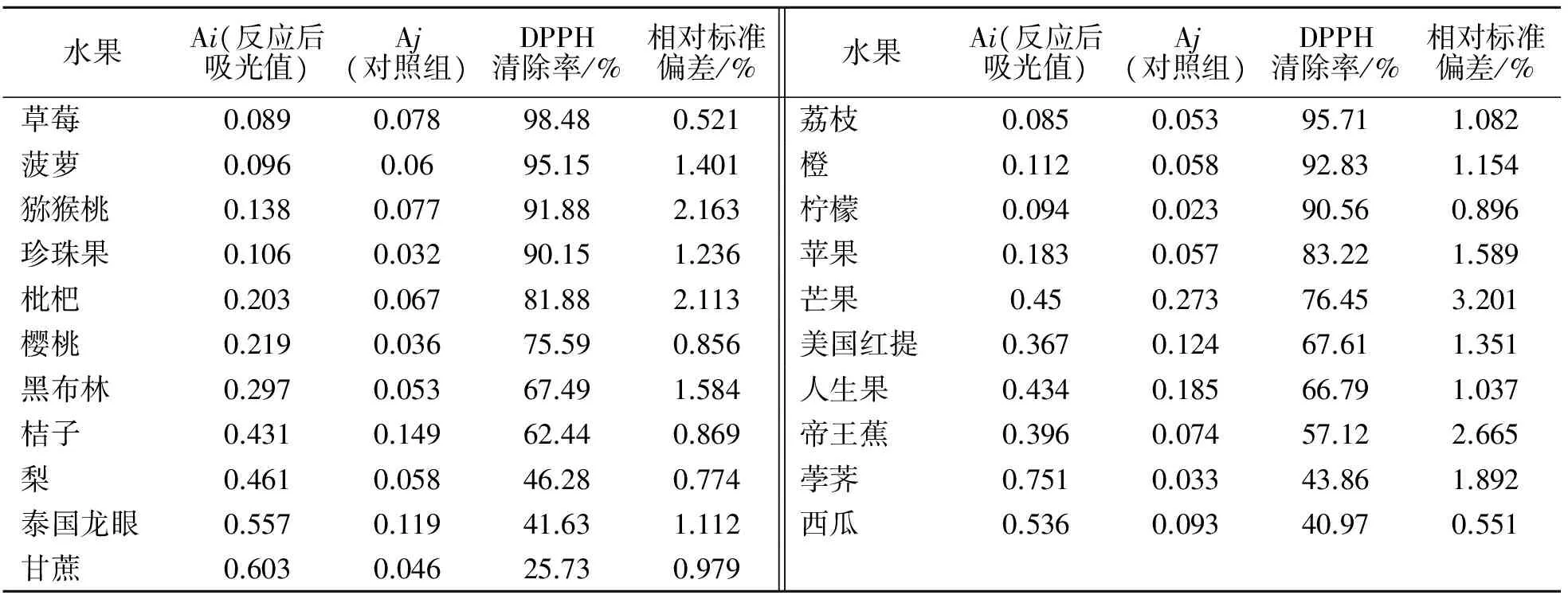
表1 21种水果的总抗氧化活性效果
由表1可知,21种常见多汁类水果中,草莓、荔枝、菠萝、橙、猕猴桃和柠檬等的总抗氧化活性较强.其中,桔子的测量值较小,可能是它们的抗氧化性物质在提取和实验过程中极易受到空气中的氧气所氧化.但是,这并不影响本结果,因为此项研究是尽最大的可能模拟家庭榨汁工艺而设计的,旨在揭示实际生活中哪些果蔬对人体的健康最有裨益.当然,日常生活中应该尽量的减少果蔬汁暴露在空气中的时间,以达到最佳的食用效果.另外,通过与芦丁和维生素C清除DPPH自由基的比较可以发现,很多水果的抗氧化活性都比较显著,这也充分说明了这些水果的抗氧化作用与保健功能显著,其中1.0 mg/mL的芦丁的DPPH清除率为57.87%,1.0 mg/mL的维生素C为88.27%.
3.4 蔬菜的总抗氧化活性作用
利用DPPH法测定常见的15种多汁类蔬菜鲜汁的总抗氧化活性,统计结果见表2.
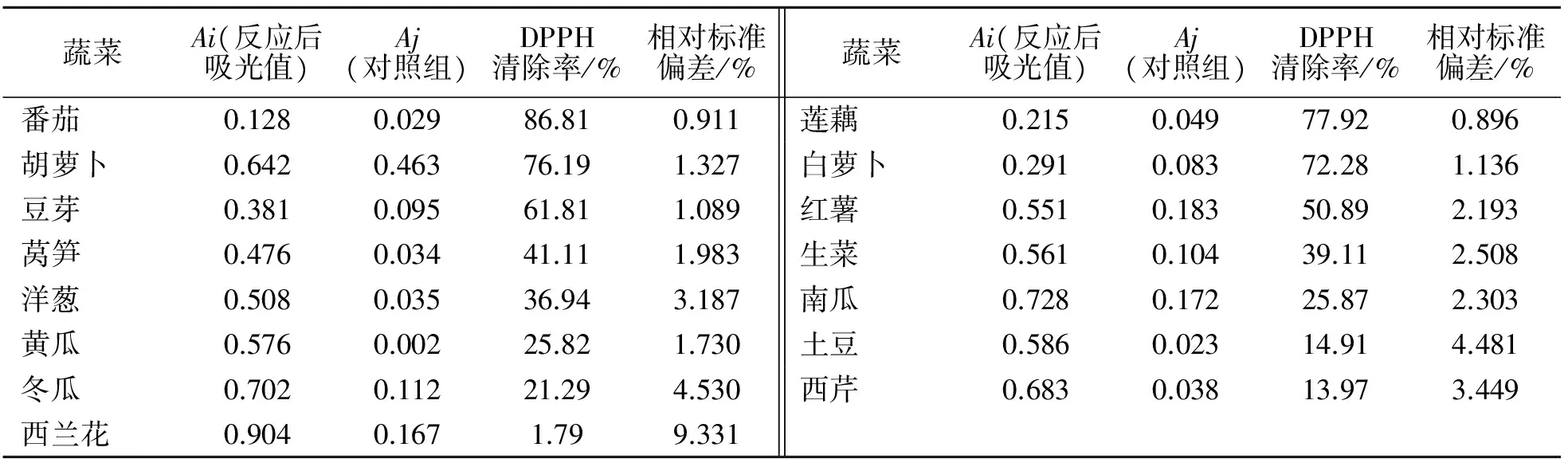
表2 15种蔬菜的总抗氧化活性效果
由表2可知, 15种常见多汁类蔬菜中,番茄、莲藕、胡萝卜和白萝卜的总抗氧化活性较强,其中有5种蔬菜的DPPH清除率高于1.0 mg/mL的芦丁(57.87%),而番茄则接近1.0 mg/mL的维生素C(88.27%).
4 结论与讨论
1)21种水果的总抗氧化活性按照从高到低的顺序,依次为草莓、荔枝、菠萝、橙、猕猴桃、柠檬、珍珠果、苹果、枇杷、芒果、樱桃、美国红提、黑布林、人生果、桔子、帝王蕉、梨、荸荠、泰国龙眼、西瓜、甘蔗.
2)15种蔬菜的总抗氧化活性按照从高到低的顺序,依次为番茄、莲藕、胡萝卜和白萝卜、豆芽、红薯、莴笋、生菜、洋葱、南瓜、黄瓜、土豆、冬瓜、西芹、西兰花.
3)比较本实验中的21种水果与15种蔬菜,可以发现:水果的总抗氧化活性明显强于蔬菜.水果中的草莓(98.48%)、荔枝(95.71%)、菠萝(95.15%)、橙(92.83%)、猕猴桃(91.88%)、柠檬(90.56%)、珍珠果(90.15%)总抗氧化活性依次减弱,但仍然高于蔬菜中总抗氧化活性最强的番茄(86.81%).
4)36种水果和蔬菜中,一共有20种果蔬的总抗氧化活性优于1.0 mg/mL的芦丁(57.87%),另有7种果蔬的总抗氧化活性优于1.0 mg/mL的维生素C(88.27%).这些对于指导人们日常生活健康饮食以及人体保健功能的维护,具有非常重要的现实意义.
[1] Gutteridge J M.Free radicals in disease processes:a compilation of cause and consequence[J].Free Radical Research Communications,1993,19(3):141-158.
[2] 魏朝良,于德红,安利佳.黄酮类化合物及清除自由基机制的探讨[J].中成药,2005,27(2):239-241.
[3] 黄佩丽.β-胡萝卜素[J].大学化学,2001,16(4):24-26.
[4] 刘家永,吴鸣健,沈国鹏.天然胡萝卜素研究[J].郑州工业大学学报,1999,20(4):59-61.
[5] 赵文思.类胡萝卜素清除活性氧自由基的机理[J].化学通报,1999(4):25-26.
[6] 沈国鹏,徐贵敏,刘芳.脂溶性类胡萝卜素的提取及其稳定性研究[J].湖南农业科学,2003(8):30-32.
〗[7] Blomhoff J R.Vitamin A in Health and Disease[M].New York:Marcel Dekker,1994:239-255.
[8] Sommer A.Vitamin A deficiency and its Consequences:A fiel guide to detection and control[M].Geneva:World Health Organization,1995:14-20.
[9] Canfield L M,Krinsky N I,Olson J A.Carotenoids in human health[M].Annals of the New York.Academy of Sciences(USA)、New York,N.Y.(USA),New York Academy of Sciences,1993:691.
[10] 陈守江.果蔬汁品质的总抗氧化活性评价[J].Science and Technology of Food Industry,2003,25:62-63.
[12] 朱伟,阮新民. 1,1-二苯基-2-2苦基肼基游离基法测定调脾护心方及其不同组分清除自由基的能力[J].时珍国医国药,2009,20(4):796-798.
[13] 康文艺.两种药用植物抗艾滋病病毒与抗氧化活性成分研究[D].北京:北京大学博士后研究工作报告,2005:14.
