亚低温对缺氧缺血新生大鼠海马星形胶质细胞增殖和凋亡的影响
2011-01-19明美秀马思敏程国强
明美秀 马思敏 程国强
新生儿窒息所致的缺氧缺血性脑损伤(HIBD)是新生儿死亡和远期神经功能损伤的重要原因之一[1]。动物[2]和大规模临床多中心研究均表明亚低温对HIBD有显著的保护作用,但亚低温保护作用的机制目前尚不明确。
星形胶质细胞不仅为神经元提供营养和结构上的支持,还参与调节神经突起活性[3]。缺氧缺血过程中星形胶质细胞的损伤对神经元的存活具有重要影响,缺血梗死灶处胶质瘢痕的形成能在较长时间内影响神经突起的生长,阻碍神经元的修复[4]。既往动物实验表明适度亚低温能保护神经元,减少星形胶质细胞的增殖。提示,星形胶质细胞可能在亚低温对HIBD的保护作用中发挥重要作用。但亚低温对缺氧缺血后星形胶质细胞活化和增殖的影响尚不清楚。本实验通过新生大鼠体外和体内实验,观察亚低温对海马区星形胶质细胞活化、增殖及凋亡的影响,探讨亚低温对新生大鼠HIBD的保护作用机制。
1 方法
1.1 海马脑片氧糖剥夺标本制备 3日龄新生SD大鼠30只(购于上海中国生命科学院动物部),体重(9.0±0.5)g,雌雄不限。参考Garnier等[5]的方法制备脑片培养模型。3日龄新生大鼠断头取脑,振动切片机上制备脑片,每张脑片厚300 μm,取海马区脑片置于Transwell 6孔板37℃培养,4 d后更换为无糖Earle's溶液并置于缺氧箱内,通入95%N2+5%O2(氧糖剥夺),置37℃培养箱内40 min后取出培养板,分别放入33℃(亚低温组)和37℃(常温组)培养箱中培养。亚低温组脑片于33℃培养24 h后取出,置于37℃培养箱继续培养48 h;常温组脑片于37℃培养箱培养72 h。两组脑片同时取出,4%多聚甲醛固定,用于进行免疫荧光染色。对照组脑片不进行氧糖剥夺处理,37℃培养7 d后取出,4%多聚甲醛固定,用于免疫染色。
1.2 在体动物模型制备及取材 取7日龄新生SD大鼠48只,体重(13±0.7)g,雌雄不限,平均分为手术组和假手术组。手术组经乙醚麻醉,颈部正中切口,分离左侧颈总动脉,永久性结扎,置于8%O2+92%N2中缺氧2 h;假手术组仅分离左侧颈总动脉,不结扎,不予缺氧处理。手术组和假手术组分别采用常温(肛温维持在36~37℃)和亚低温处理(鼠肛温维持在32~33℃,24 h后恢复常温),分为手术常温亚组、手术亚低温亚组、假手术常温亚组和假手术亚低温亚组,每亚组各12只大鼠。4亚组大鼠分别于术后第3和7天以水合氯醛麻醉,先后用生理盐水、4%多聚甲醛灌注,断头取脑,置于4%多聚甲醛中固定6 h,梯度蔗糖溶液中脱水,OCT包埋,冰冻切片机切片,片厚30 μm,进行免疫荧光染色。
1.3 免疫组织化学染色 采用免疫荧光双标记方法,小鼠抗大鼠胶质纤维酸性蛋白(GFAP)(Chemicon, USA)标记星形胶质细胞,兔抗caspase-3标记凋亡细胞。二抗分别为FITC结合的兔抗小鼠IgM和TRITC结合的山羊抗兔 IgG 。
步骤如下:① 0.01 mol·L-1PBS漂洗5 min×3;②1%H2O2室温孵育1 h阻断内源性过氧化物酶;③0.01 mol·L-1PBS漂洗5 min×3;④封闭:10%羊血清37℃ 孵育1 h;⑤滴加一抗 (1∶100) 50 μL,4℃ 48 h ; ⑥0.01 mol·L-1PBS漂洗5 min×3;⑦滴加二抗(1∶200) 50 μL,37℃ 1 h; ⑧0.01 mol·L-1PBS漂洗5 min×3,风干,荧光封片剂封片,荧光显微镜观察。其中步骤⑦和⑧均避光操作。
在相同的曝光时间和放大倍数(×400)下统计阳性细胞数,每只鼠6张切片,每张切片取4个视野,算出每个视野的均数进行比较。
2 结果
2.1 亚低温对海马脑片缺氧缺糖后星形胶质细胞活化增殖的影响 氧糖剥夺后3 d常温组较对照组GFAP阳性细胞数量明显增多,细胞在形态上表现为胞体肿胀、突起变短,提示星形胶质细胞活化;亚低温组与常温组相比,GFAP阳性细胞数量明显减少,胞体肿胀减轻,形态与对照组相似(图 1)。氧糖剥夺后常温组脑片培养第3天GFAP阳性细胞数量为每高倍视野(46.0±5.4)个,显著高于对照组[(20.3±2.9)个]和亚低温组[(22.8±4.9)个]。
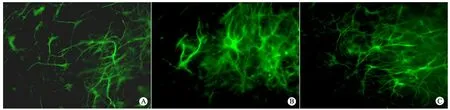
图1 海马脑片氧糖剥夺后培养第3天海马区GFAP阳性细胞表达(×40)
Fig 1 Expression of GFAP positive cells in cultured hippocampus slices 3 days after oxygen and glucose deprivation(×40)
Notes A: control; B: hypothermia group; C: normothermia group.Compared with the normothermia group, the astrocytes significantly decreased in hypothermia group
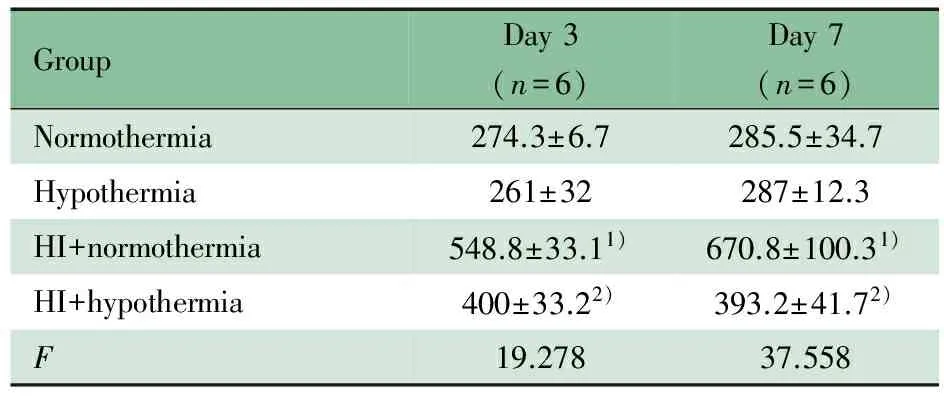
2.2 亚低温对缺氧缺血大鼠海马星形胶质细胞活化、增殖和凋亡的影响 免疫荧光结果显示,手术亚低温亚组GFAP阳性细胞数量较手术常温亚组显著降低,显著高于假手术常温亚组和假手术亚低温亚组;手术常温亚组术后第7天GFAP阳性细胞数量较第3天明显增加(图2,表1)。GFAP和caspase-3免疫荧光双标记结果显示,缺氧缺血后第3天,手术常温亚组海马区84.5%GFAP阳性细胞表达caspase-3,而手术亚低温亚组仅32.3%GFAP阳性细胞表达caspase-3(图3),差异有统计学意义(P<0.05)。。
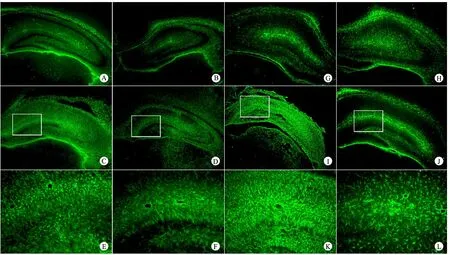
图2 各亚组术后第3和7天海马区GFAP阳性细胞表达
Fig 2 Expression of GFAP positive cells in hippocampus 3 and 7 days after hypoxic-ischemic brain injury in different subgroups
Notes Compared with the normothermia group at day 3 and 7 after hypoxic-ischemic brain injury, the astrocytes significantly decreased in hypothermia group.A: sham+normothermia group(day 3,×5); B: sham + hypothermia group(day 3,×5); C: HI + normothermia group(day 3,×5); D: HI + hypothermia group(day 3,×5).E and F showed 4 times zoom image as shown in C and D, respectively.G: sham+normothermia group(day 7,×5); H: sham + hypothermia group(day 7,×5); I: HI + normothermia group(day 7,×5); J: HI + hypothermia group(day 7,×5).K and L showed 4 times zoom image as shown in H and I, respectively
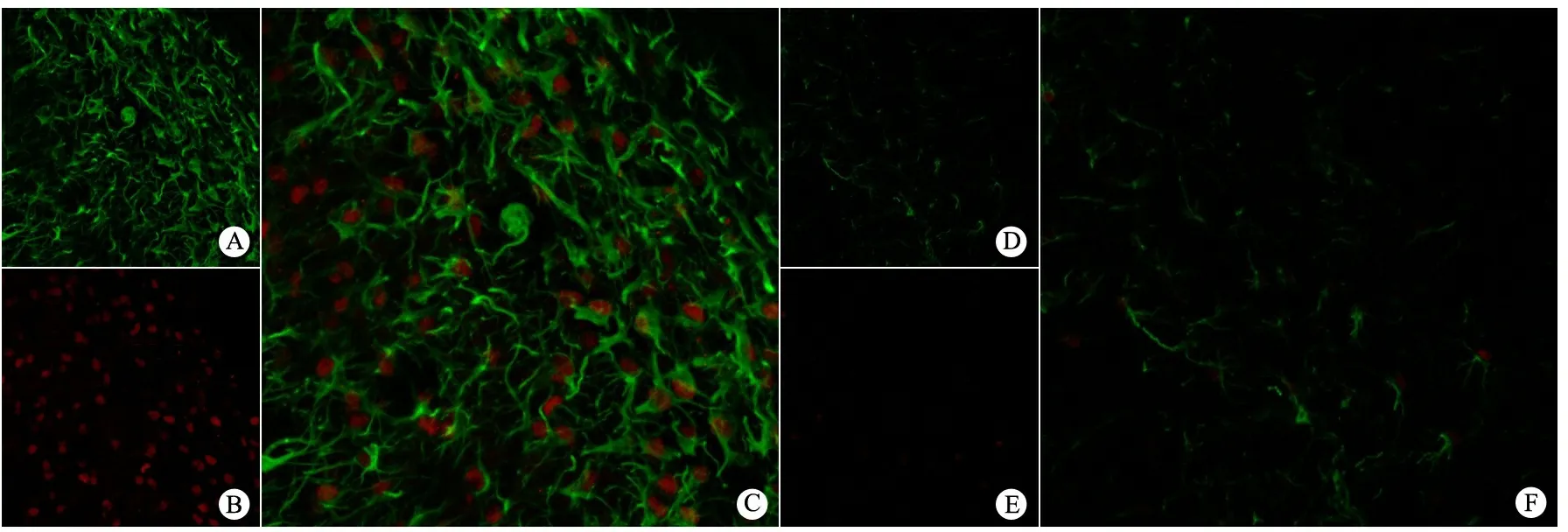
图3 手术组缺氧缺血后第3天海马区GFAP/caspase-3双阳性细胞表达(×40)
Fig 3 Expression of GFAP/Caspase 3 double positive cells in hippocampus 3 days after hypoxic-ischemic brain injury in different subgroups(×40)
Notes Compared with the normothermia group, the GFAP+/caspase 3+ cells significantly decreased in hypothermia group.GFAP: green; Caspase 3: red.C-E: HI + normothermia group; F-H: HI + hypothermia group
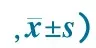

GroupDay3(n=6)Day7(n=6)Normothermia274.3±6.7285.5±34.7Hypothermia261±32287±12.3HI+normothermia548.8±33.11)670.8±100.31)HI+hypothermia400±33.22)393.2±41.72)F19.27837.558
Notes:HI:hypoxic-ischemia; 1)HI+normothermiavsnormothermia,P<0.001;2)HI+hypothermiavsnormothermia,P<0.001
3 讨论
星形胶质细胞在中枢神经系统具有重要的作用。GFAP仅存在于星形胶质细胞中。GFAP缺乏的成熟大鼠对缺血高度敏感,表明星形胶质细胞在缺血性损伤所致的神经细胞凋亡中扮演了重要角色[6]。有研究认为,脑损伤后星形胶质细胞的功能状态对神经元的存活和功能起决定性的作用[7]。星形胶质细胞适度的活化、增殖可限制炎症反应,减轻氧化损伤[8],但星形胶质细胞的过度活化可引发炎性介质、细胞因子和谷氨酸等兴奋毒性神经递质过量释放,主导缺氧缺血瀑布级联反应及胶质瘢痕的过度产生,影响神经的再生与修复,使神经元轴突退变,最终导致神经元的死亡[9]。由此可见,活化的星形胶质细胞数量及其状态对缺血后脑损伤的修复具有不同的作用。既往研究认为,亚低温对HIBD具有保护作用。 但星形胶质细胞在亚低温脑保护作用中扮演什么角色,亚低温是否可影响缺血后星形胶质细胞的活化和增殖,目前尚不清楚。
本研究发现,无论是体内还是体外实验,大鼠缺氧缺血后海马区星形胶质细胞均发生活化增殖,而亚低温可减轻其活化和增殖程度。提示,亚低温能在一定程度上通过抑制星形胶质细胞的活化和增殖,从而对海马神经细胞的存活起促进作用。既往研究显示,中枢神经系统损伤后早期活化的星形胶质细胞通过参与调解细胞外离子水平,神经递质及营养供应,对神经元具有保护作用[21]。而损伤后期随着胶质细胞的进一步活化、增殖释放出大量的毒性介质,引起损伤后期大量神经元继发性死亡,从而表现为对神经系统的损伤[10]。亚低温是否可通过减轻星形胶质细胞的活化、增殖,从而减少毒性介质的释放,起到脑保护作用尚有待于进一步研究。
成年大鼠局灶缺血研究结果显示,凋亡标记蛋白caspase-3表达的上调仅出现在神经元,在星形胶质细胞中无变化[11],故认为缺血后星形胶质细胞无凋亡。与成年大鼠实验研究结果不同,Acarin等[12]研究表明,新生大鼠HIBD后4 h,活化的星形胶质细胞即有caspase-3的表达,且可持续至损伤后7~14 d。本实验结果显示新生大鼠缺氧缺血后海马部位大量GFAP阳性的星形胶质细胞表达caspase-3,进一步证实HIBD后存在星形胶质细胞的凋亡。另外,本研究还发现HIBD后第3天,手术亚低温亚组海马区星形胶质细胞凋亡率显著低于常温组,表明亚低温可抑制星形胶质细胞的凋亡。因此,通过减少星形胶质细胞的凋亡可能是亚低温对HIBD具有神经元保护作用的机制之一。
[1]Ferriero DM.Neonatal brain injury.N Engl J Med,2004,351(19):1985-1995
[2]Mishima K, Ikeda T, Yoshikawa T, et al.Effects of hypothermia and hyperthermia on attentional and spatial learning deficits following neonatal hypoxia-ischemic insult in rats.Behav Brain Res, 2004, 151(1-2): 209-217
[3]Takuma K, Baba A,Matsuda T.Astrocyte apoptosis: implications for neuroprotection.Prog Neurobiol, 2004, 72(2): 111-127
[4]McGraw J, Hiebert GW,Steeves JD.Modulating astrogliosis after neurotrauma.J Neurosci Res, 2001, 63(2): 109-115
[5]Garnier Y, Pfeiffer D, Jensen A, et al.Effects of mild hypothermia on metabolic disturbances in fetal hippocampal slices after oxygen/glucose deprivation depend on depth and time delay of cooling.J Soc Gynecol Investig, 2001, 8(4): 198-205
[6]Nawashiro H, Brenner M, Fukui S,et al.High susceptibility to cerebral ischemia in GFAP-null mice.J Cereb Blood Flow Metab, 2000, 20(7):1040-1044
[7]Panickar KS, Norenberg MD.Astrocytes in cerebral ischemic injury: morphological and general considerations.Glia,2005,50(4):287-298
[8]Xie M, Wang W, Kimelberg HK, et al.Oxygen and glucose deprivation-induced changes in astrocyte membrane potential and their underlying mechanisms in acute rat hippocampal slices.J Cereb Blood Flow Metab, 2008,28(3):456-467
[9]Sofroniew MV.Reactive astrocytes in neural repair and protection.Neuroscientist, 2005, 11(5): 400-407
[10]Song H, Stevens CF,Gage FH.Astroglia induce neurogenesis from adult neural stem cells.Nature, 2002, 417(6884): 39-44
[11]Lukaszevicz AC, Sampaio N, Guegan C,et al.High sensitivity of protoplasmic cortical astroglia to focal ischemia.J Cereb Blood Flow Metab,2002,22(3):289-298
[12]Acarin L, Villapol S, Faiz M, et al.Caspase-3 activation in astrocytes fllowing postnatal excitotoxic damage correlates with cytoskeletal remodeling but not with cell death or proliferation.Glia,2007, 55(9):954-65
