糖皮质激素治疗胎粪吸入综合征疗效和安全性的Meta分析
2011-01-19杨迪元沈莉荣于爱真华子瑜
杨迪元 沈莉荣 于爱真,2 华子瑜
胎粪吸入综合征(MAS)是一种以胎粪吸入引起的呼吸窘迫为主要表现,伴胸部X线片特征性改变,而不能用其他原因解释的新生儿疾病。13%的新生儿出生时有羊水粪染,在欧洲MAS的发病率为0.2‰~1‰[1];澳大利亚和新西兰MAS病死率达3%~12%[2];在中国,MAS占住院新生儿呼吸系统疾病的3.6%[3],占新生儿呼吸衰竭病因的9.5%[4],是导致新生儿呼吸衰竭及死亡的主要疾病之一。
胎粪可诱发强烈的化学性肺部炎症[5]。肺部的炎症反应主要发生在胎粪吸入后的12~48 h[6],晚近的研究提示胎粪介导的炎症反应还可累及全身,在MAS的发病中起重要作用[7,8]。
糖皮质激素具有很强的抗炎作用,可减少MAS炎症相关细胞因子、促炎症反应血小板活化因子、环氧合酶和一氧化氮合酶的表达[9,10]。糖皮质激素还可减轻肺部炎症,改善肺水肿和氧合[11,12],减少持续性肺动脉高压的发生。自1975年起,多项动物实验报道糖皮质激素治疗MAS能减轻肺部损伤和改善氧合[13~16],但目前相关临床研究结果不一[17~20],因此糖皮质激素治疗MAS的时机、疗程、药物的选择、疗效观察指标等尚无统一指南,新生儿期使用糖皮质激素会引起近期及远期不良反应[21~23],糖皮质激素治疗MAS的临床应用尚未有统一意见。有学者认为,重症MAS新生儿中,在广泛肺组织发生炎症反应前早期使用糖皮质激素可能会改善呼吸状况,同时也建议进一步研究明确使用时机[24]。但也有学者[22]认为,新生儿期使用糖皮质激素可引起中枢神经系统的不良反应,应严格控制新生儿期糖皮质激素的使用。美国和加拿大儿科学会、欧洲围产医学联合会制定了相应的指南[25,26],鼓励开展更多研究以评估糖皮质激素对中枢神经系统的远期不良反应,在获得临床研究证实前不推荐多种给药途径。因此,本文检索相关RCT文献进行Meta分析,评价糖皮质激素治疗MAS的疗效和安全性,以期为临床实践提供依据。
1 方法
1.1 文献纳入和排除标准 同时满足以下条件的文献被纳入:①RCT研究,发表语种不限。②纳入对象均符合MAS诊断标准[27]。③MAS的严重程度不限。④羊水粪染程度、窒息程度、出生方式、胎龄和出生体重均不限。⑤干预措施:干预组出生后48 h内予糖皮质激素治疗,糖皮质激素的种类和用药途径不限,疗程≥2 d;对照组予空白对照或安慰剂对照;同时存在其他治疗方案时,能单独提取糖皮质激素治疗数据的文献亦纳入。⑥重复收录的文献,仅保留发表年份早、样本量大和信息全面的一篇。⑦排除合并败血症和先天性缺陷者。⑧排除研究结果未包含以下1.2项结局指标的文献。
1.2 结局指标 近期结局指标:①住院期间病死率;②住院时间;③呼吸窘迫持续时间:采用临床RDS评分法[28],从入院至评分为0的时间;④胸部X线片恢复正常的时间;⑤氧疗时间;⑥MAS急性并发症的发生率:包括持续性肺动脉高压、呼吸衰竭、气漏;⑦糖皮质激素近期不良反应发生率:包括感染(败血症、鹅口疮、其他浅表部位真菌感染及脑膜炎)、高血压、高血糖和消化道出血。远期结局指标:①慢性肺疾病发生率;②神经系统后遗症的发生率:包括脑瘫、神经感应性耳聋和生长发育延迟。
1.3 文献检索
1.3.1 数据库 PubMed、MEDLINE、EMBASE、EBSCOhost、Cochrane图书馆(2010年第1期)、Cochrane临床对照试验库(CENTRAL)、Ovid、中国生物医学文献数据库、万方数据库和维普中文科技期刊数据库。检索时间均从建库至2010年12月。此外还手工检索儿科学术会议论文汇编及学位论文(来源于重庆医科大学图书馆馆藏资料)。
1.3.2 检索策略 中文检索词:糖皮质激素、皮质类固醇激素、胎粪吸入综合征、胎粪吸入性肺炎;英文检索词:glucocorticoids,corticosteroids,steroids,meconium aspiration syndrome。
1.3.3 全文获取途径 ①检索电子期刊全文数据库、馆藏期刊和馆际互借方式获取;②直接与作者联系索取。
1.4 纳入和排除文献方法 参照Cochrane协作网系统评价员手册5.0.2版[29]提供的方法纳入文献:①医学文献王3.0导入文献;②阅读文题和摘要,剔除重复发表及明显不相关的文献;③合并来源于同一研究的文献;④阅读全文,确定是否符合纳入标准;⑤联系作者,确认文献信息。由杨迪元和沈莉荣独立进行,然后交叉核对,意见不一致时,由于爱真进行评价,仍有争议时由研究组讨论决定。
1.5 资料提取 参考Cochrane协作网推荐的方法编制资料提取表,由2名研究者独立提取资料,交叉核对,意见有分歧时讨论解决。提取的资料包括:①文献的基本特征,包括文题、年份、出处、研究者姓名和联系方式等;②纳入文献研究对象的基本特征、干预措施和结局指标。
1.6 文献偏倚评价 采用 Cochrane评价手册5.0.2推荐的质量评价标准评价纳入文献的偏倚,包括6项:①随机分配方法;②分配方案隐藏;③ 对研究对象、治疗方案实施者、研究结果测量者采用盲法;④结果数据的完整性; ⑤选择性报告研究结果;⑥其他偏倚来源。针对每篇纳入文献,对上述6项作出“是”(低度偏倚)、“否”(高度偏倚)和“不清楚”(缺乏相关信息或偏倚情况不确定)的判断。杨迪元和沈莉荣有分歧时,由于爱真协助解决,仍有争议时由研究组讨论决定。
1.7 统计学方法 采用Revman 5.0.23软件进行Meta分析。对纳入的文献进行临床异质性和方法学异质性分析,依据临床异质性(给药途径不同)进行亚组分析。采用χ2检验进行统计学异质性分析,P≤ 0.1时,研究间存在显著异质性;采用I2对异质性进行定量分析,I2≤25%时,研究结果间存在低度异质性,I2~ 50%时,存在中度异质性;I2﹥50%时,存在高度异质性。研究间存在高度异质性时,根据使用的糖皮质激素种类和剂量进行异质性分析,从临床上可以合并时采用随机效应模型分析。当研究间无显著统计学异质性(P﹥0.1)时,采用固定效应模型分析。计数资料以OR及其95%CI表示,计量资料以均数差(MD)或标准化均数差(SMD)及其95%CI表示。数据缺失或失访时,采用治疗意向性分析,即失访者以最差结局计算,P﹤0.05为差异有统计学意义。
2 结果
2.1 一般情况 共检索出1 012篇相关文献,初筛获得6篇RCT文献[17,19,20,30~32](2篇[19,32]来源于同一研究,且其中1篇[32]无可用数据),1篇Cochrane系统评价文献[33],最终纳入5篇RCT文献[17,19,20,30,31](图1)。
5篇RCT文献共纳入295例患儿,其临床表现及胸部X线片特征性改变均符合MAS诊断标准。受试对象来自美国芝加哥[17]、印度新德里[19]和瓦拉纳西[20]、中国广东[31]及中国台湾[30]。糖皮质激素组予氢化可的松或地塞米松或甲泼尼龙静脉滴注,或布地奈德混悬液雾化吸入,5篇文献均采用安慰剂对照。糖皮质激素组和对照组均接受对症、支持治疗和护理(表1)。

图1 文献筛选流程图
Fig 1 Flow chart of article screening and selection process
2.2 文献偏倚评价 5篇文献均使用了正确的随机化方法,其中3篇文献[17,20,31]使用随机数字法,文献[19]使用抽签法,文献[30]使用随机序列法。文献[17,20]使用按序列编号的密封不透光的信封实施分配隐藏。5篇文献均对受试者实施盲法。文献[20]报道了病例失访情况,提示该研究存在高度的失访偏倚风险,其他研究未报道失访情况,无法判定。仅1篇文献[17]报道了使用氢化可的松治疗无效的结论,故其选择性报告结果的可能性较小;其他研究未提供相关信息,故无法判断。Tripathi等[19]的研究在进行胸部X线片肺部病变消除时间的评估时,由放射科医生盲评,其主观测量偏倚风险较小。所有研究均未提供足够的信息以判断其他偏倚风险来源(图2)。
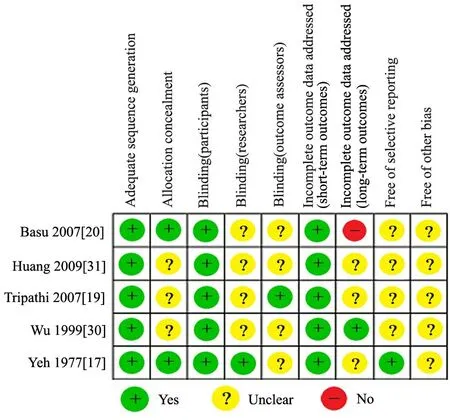
图2 纳入5篇文献偏倚的评价结果
表1 纳入5篇RCT文献的一般情况
Notes NA: not available; T:treatment group; C:control group;GA: gestational age; MD: mode of delivery; NVD: normal vaginal delivery; CS: cesarean section; BW: birth weight; RDS: respiratory distress syndrome
2.3 Meta分析结果
2.3.1 住院期间病死率 5篇文献[17,19,20,30,31]均报道了糖皮质激素组与对照组的病死率,研究间无显著异质性,采用固定效应模型合并分析。Meta分析结果显示,OR=0.61(95%CI: 0.26~1.44),两组病死率差异无统计学意义(P=0.26)。进一步分为静脉用药及雾化吸入治疗亚组,各亚组文献间具同质性,均采用固定效应模型分析。亚组分析结果显示,糖皮质激素静脉滴注及雾化吸入亚组住院期间病死率与对照组差异均无统计学意义(OR分别为0.81和0.40,95%CI分别为0.27~2.43和0.10~1.64,P分别为0.70和0.20)(图3)。
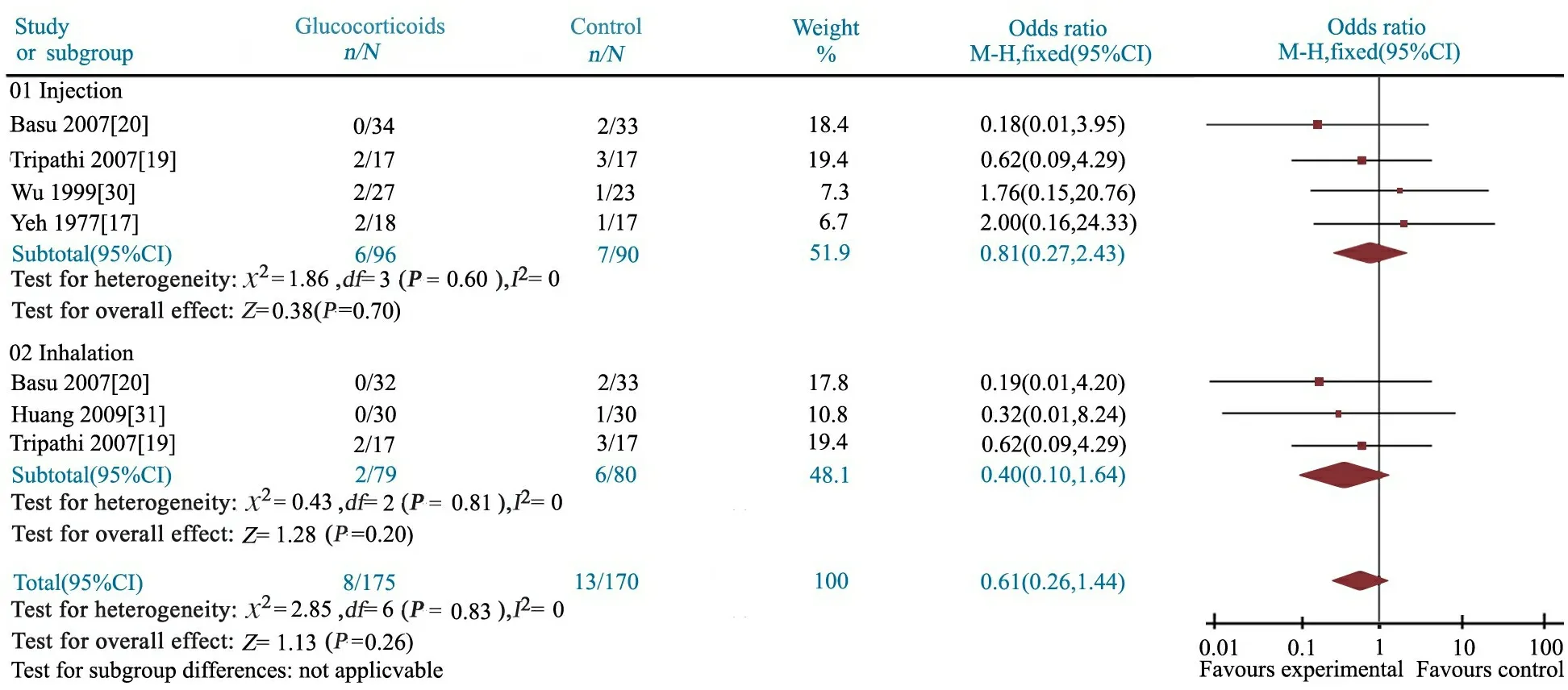
图3 糖皮质激素组与对照组住院期间病死率的Meta分析
Fig 3 Meta-analysis of mortality during hospitalization in treatment and control groups
2.3.2 住院时间 4篇文献[19,20,30,31]报道了糖皮质激素组与对照组的住院天数,研究间具有高度的异质性,采用随机效应模型合并分析。Meta分析结果显示,MD=-5.42(95%CI: -7.38~ -3.45),两组差异有统计学意义(P<0.000 1)。进一步分为静脉滴注及雾化吸入治疗亚组,研究间均有显著的异质性,均采用随机效应模型分析。亚组分析结果显示,糖皮质激素静脉滴注亚组住院时间与对照组差异无统计学意义(MD=-4.42,95%CI: -9.94~ 1.11,P=0.12),布地奈德混悬液雾化吸入亚组可显著缩短MAS患儿住院时间(MD=-6.11,95%CI: -8.88~ -3.34,P<0.000 1)(图4)。
由于文献间存在高度异质性,进一步行异质性原因分析。剔除质量较差的文献[31],异质性检验P=0.000 4,提示文献间仍存在高度异质性。按照使用糖皮质激素的种类和剂量进行亚组分析。2篇文献[19,20]报道了相同剂量甲泼尼龙或布地奈德治疗组与对照组的住院时间,异质性检验P分别为0.80和1.00,提示文献间无显著统计学异质性。Meta分析结果显示,甲泼尼龙或布地奈德治疗组住院时间与对照组差异均有统计学意义,OR分别为-7.22(95%CI:-8.18~-6.26)和-7.43(95%CI:-8.38~-6.48)。
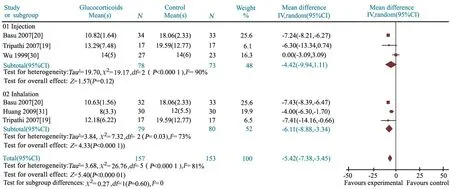
图4 糖皮质激素组和对照组住院时间的Meta分析
Fig 4 Meta-analysis of hospital stays in treatment and control groups
2.3.3 呼吸窘迫持续时间 文献[17,20]报道了呼吸窘迫持续时间,测量单位不一。文献[17]和[20]分别以小时和天为单位,采用SMD为效应指标。异质性检验P<0.000 1,研究间具有高度异质性,采用随机效应模型分析。Meta分析结果显示,SMD=-0.13(95%CI: -2.58~2.32),两组差异无统计学意义(P=0.92)。进一步分为静脉滴注及雾化吸入治疗亚组,研究间具高度异质性,均采用随机效应模型分析。亚组分析结果显示,糖皮质激素静脉滴注亚组呼吸窘迫持续时间与对照组差异无统计学意义(SMD = 0.64,95%CI: -4.40~5.68,P=0.80),布地奈德混悬液雾化吸入亚组可显著缩短MAS患儿呼吸窘迫持续时间(SMD = -1.56,95%CI: -2.12~ -1.00,P<0.000 01)(图5)。
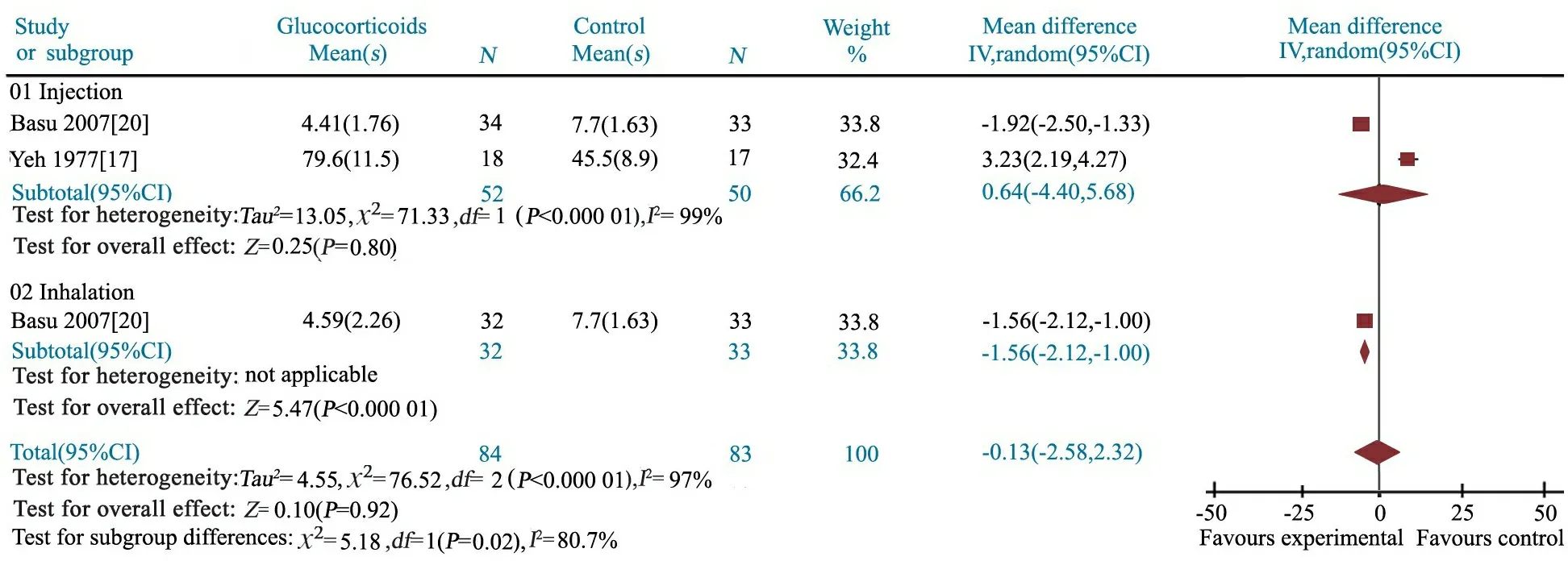
图5 糖皮质激素组和对照组呼吸窘迫持续时间的Meta分析
Fig 5 Meta-analysis of duration of respiratory distress in treatment and control groups
2.3.4 胸部X线片恢复正常时间 文献[17,19,20]报道了相关结果。异质性检验P<0.000 1,研究间具高度异质性,采用随机效应模型分析。Meta分析结果显示, MD=-4.63(95%CI: -9.78~0.52),两组差异无统计学意义。分为静脉滴注及雾化吸入治疗亚组,文献间均具高度异质性,采用随机效应模型分析。结果显示,糖皮质激素静脉滴注及雾化吸入亚组胸部X线片恢复正常时间与对照组均无显著差异,MD分别为-3.75(95%CI:-10.98~3.48)和-5.98(95%CI:-12.52~0.57)(图6)。
按照糖皮质激素种类和剂量行异质性原因分析。2篇文献[19,20]报道了相同剂量甲泼尼龙或布地奈德治疗组与对照组的胸部X线片恢复正常时间,异质性检验P均<0.000 01,I2均为98%,研究间仍具高度异质性。结果显示,甲泼尼龙和布地奈德亚组与对照组胸部X线片恢复正常时间差异均无统计学意义;MD分别为-5.82(95%CI:-12.50~0.87)和-5.98(95%CI:-12.52~0.57)。
2.3.5 氧疗时间 4篇文献[17,19,20,31]报道了氧疗时间,文献[17]以小时为单位,余3篇文献以天为单位,采用SMD为效应指标。研究间具有高度异质性,采用随机效应模型分析。Meta分析结果显示,SMD=-0.30(95%CI: -1.46~0.86),两组差异无统计学意义(P=0.61)。进一步分为静脉滴注及雾化吸入治疗亚组,研究间具高度异质性,均采用随机效应模型进行亚组分析,结果显示,糖皮质激素静脉滴注亚组氧疗时间与对照组差异无统计学意义(SMD=0.19,95%CI: -1.62~2.00,P=0.84),布地奈德混悬液雾化吸入可显著缩短MAS患儿吸氧时间(SMD= -1.22,95%CI:-1.96~ -0.48,P=0.001)(图7)。
按照糖皮质激素种类和剂量行异质性原因分析。2篇文献[19,20]报道了相同剂量甲泼尼龙或布地奈德治疗组与对照组的氧疗时间,异质性检验P分别为0.04和0.10,I2分别为77%和63%,提示文献间仍具高度异质性。Meta分析结果显示,甲泼尼龙和布地奈德亚组与对照组氧疗时间差异均有统计学意义,SMD分别为-1.45(95%CI:-2.41~-0.49)和-1.22(95%CI:-1.96~-0.48)。
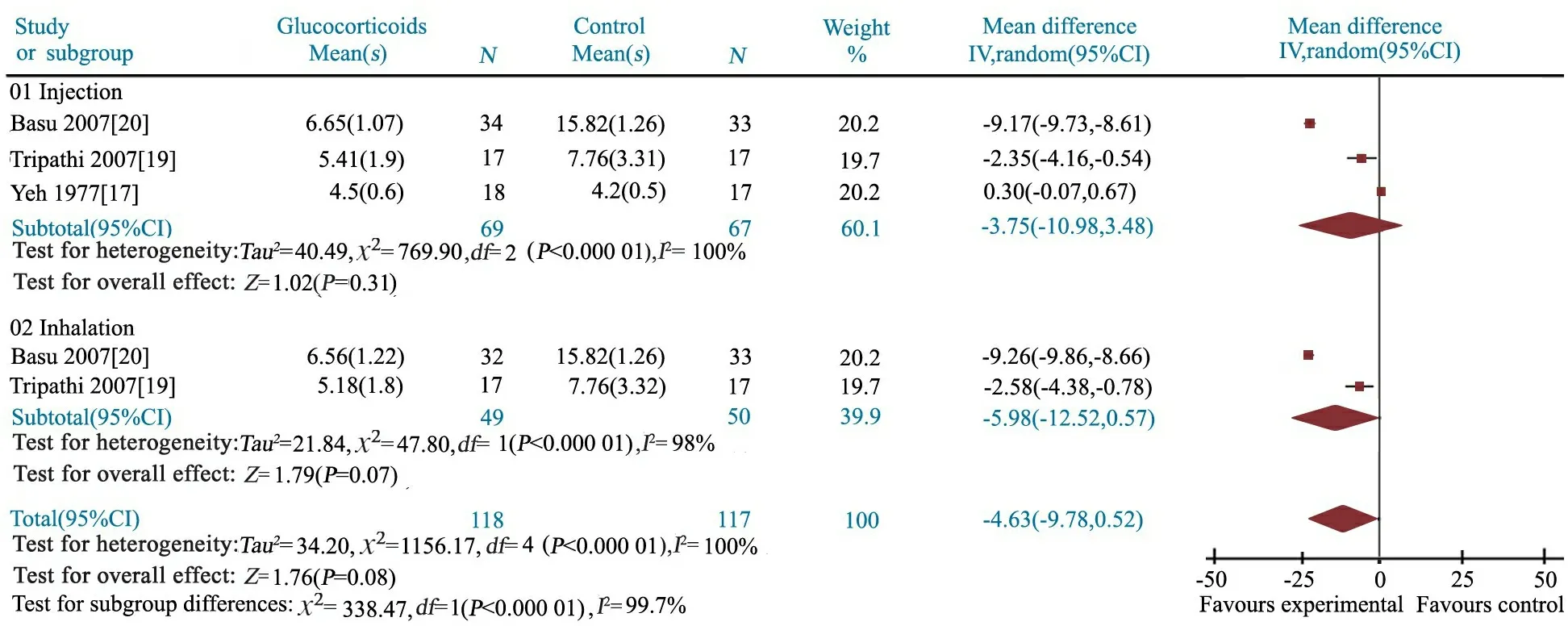
图6 糖皮质激素组和对照组胸部X线片恢复正常时间的Meta分析
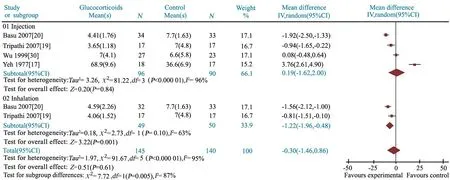
图7 糖皮质激素组和对照组氧疗时间的Meta分析
Fig 7 Meta-analysis of duration of oxygen therapy in treatment and control groups
2.3.6 MAS急性并发症发生率 文献[30]使用彩色多普勒超声检测肺动脉压,结果显示糖皮质激素组持续性肺动脉高压的发生率与对照组差异无统计学意义。纳入的5篇文献均无呼吸衰竭和气漏的报道。
2.3.7 糖皮质激素近期不良反应的发生率 3篇文献[17,19,20]报道了住院期间败血症的发生率,研究间具同质性。Meta分析结果显示,两组差异有统计学意义。进一步分为静脉用药及雾化吸入治疗亚组,各亚组研究间无异质性,Meta分析结果显示,静脉滴注糖皮质激素亚组败血症发生率与对照组差异无统计学意义,布地奈德混悬液雾化亚组败血症发生率显著低于对照组(表2)。
文献[19,20]报道了鹅口疮、其他浅表真菌感染和脑膜炎发生率,研究间均具同质性,均采用固定效应模型分析。Meta分析结果显示,糖皮质激素组和对照组上述不良反应发生率差异均无统计学意义。进一步分为静脉滴注及雾化吸入治疗亚组,Meta分析结果显示,两亚组与对照组差异均无统计学意义(表2)。
文献[19]报道高血压、高血糖的发生率在糖皮质激素组与对照组差异无统计学意义。文献[20]报道两组治疗期间均无高血糖和高血压发生。
2.3.8 糖皮质激素远期不良反应发生率 文献[30]报道糖皮质激素组与对照组均未见慢性肺疾病的发生。文献[20]对研究对象进行随访(对照组23例随访3.4个月,甲泼尼龙组28例随访3.7个月,布地奈德组25例随访3.5个月),未见神经精神发育迟滞、生长发育延迟的发生。所有纳入文献均无脑瘫和感应神经性耳聋的报道。

表2 糖皮质激素组与对照组近期不良反应发生率的Meta分析
Notes 1) total events/patients of treatment group; 2)total events/patients of control group
3 讨论
3.1 证据强度 本Meta分析纳入的5篇RCT文献均使用了正确的随机化方法,2篇文献实施分配隐藏,存在选择偏倚的可能性不大;5篇文献均对研究对象实施了盲法,但仅1篇文献分别对研究者和结局测量者实施盲法,提示存在一定的测量偏倚。文献[20]报道了病例失访情况。文献[17]报道了氢化可的松治疗无效的结论,故该研究的发表偏倚风险较小。文献[19]由放射科医生盲评判断胸部X线片恢复正常时间,主观测量偏倚风险较小。纳入文献均未提供足够信息判断其他偏倚来源。本研究纳入文献的总体质量和证据强度不高。
3.2 纳入研究的异质性 本Meta分析显示,糖皮质激素治疗MAS能缩短住院时间,但纳入的研究间存在高度异质性,本研究从糖皮质激素的给药途径进行亚组分析,不能完全消除异质性;从糖皮激素的种类及剂量行亚组分析,并剔除了质量较差的文献,结果显示研究间具有同质性。而使用相同的方案对胸部X线片恢复正常时间、氧疗时间所纳入的研究进行异质性分析时,不能完全消除异质性,提示异质性可能与其他因素有关。
3.3 临床疗效 本Meta分析结果显示,糖皮质激素治疗MAS能缩短住院时间,按照使用糖皮质激素的种类、剂量以及给药途径进行亚组分析,结果显示,布地奈德混悬液雾化吸入可显著缩短呼吸窘迫持续时间和氧疗时间。但本研究纳入的研究总体质量不高,样本量较少,研究间异质性大,结论应谨慎看待。
1项系统评价[21]认为,生后7 d内使用糖皮质激素可引起高血糖、高血压和消化道出血等近期不良反应和神经系统后遗症等远期不良反应,故临床上新生儿期使用糖皮质激素应慎重。在新生儿期,糖皮质激素主要用于治疗全身炎症反应综合征、缺氧缺血性脑病、休克、重症感染、顽固性低血糖症、慢性肺疾病及先天性肾上腺皮质增生症等,美国和加拿大儿科学会、欧洲围产医学联合会在指南[24,25]中也指出,在获得临床研究证实前不推荐多种给药途径。本研究显示,糖皮质激素治疗MAS不会显著增加败血症、脑膜炎、鹅口疮和其他浅表真菌感染的发生率,考虑到纳入的文献数量较少且样本量有限,尚需进一步评估;对于远期不良反应,本研究中虽有随访超过3个月的RCT报告,但失访病例较多,失访偏倚可能性大,故缺乏有关远期不良反应的可靠证据。
3.4 本研究的不足之处和局限性 ①本Meta分析纳入的2篇文献[30,31]未提供研究对象的基本特征,无法评价研究对象的基线水平是否存在显著性差异。②研究跨越的时间较长(1977至2009年),使用的糖皮质激素种类、剂量及用药途径差异较大,疗程不一。③纳入的RCT文献总体质量较低,且样本量较小(n=295),可能降低了检验效能。④纳入文献均未对研究对象的胎龄、出生体重、疾病严重程度进行限定,存在一定的临床异质性。
4 结论
生后48 h内使用布地奈德混悬液雾化吸入可显著缩短MAS患儿住院时间、呼吸窘迫持续时间及氧疗时间,但不能改善MAS的最终结局,亦不会增加糖皮质激素相关感染的发生。鉴于此次纳入的RCT研究对象较少,研究间异质性较大,故结论应谨慎对待,明确结论仍需要大样本、多中心的RCT进一步论证。
[1]Lim JY, Arulkumaran S.Meconium aspiration syndrome.Obstetrics, Gynaecology & Reproductive Medicine, 2008, 18(4):106-109
[2]Dargaville PA, Copnell B, Australian and New Zealand Neonata Net work.The epidemiology of meconium aspiration syndrome:incidence, risk factors, therapies, and outcome.Pediatrics, 2006, 117 (5): 1712-1721
[3]The Subspecialty Group of Neonatology,Pediatric Society,Chinese Medical Association(中华医学会儿科学分会新生儿学组).Epidemiologic survey for hospitalized neonates in China.Chin J Contemp Pediatr(中国当代儿科杂志),2009,11(1): 15-20
[4]Qian LL, Liu CQ, Zhuang WZ, et al.Neonatal respiratory failure: a 12 month clinical epidemiologic study from 2004 to 2005 in China.Pediatrics, 2008, 121 (5):1115-1124
[5]Wiswell TE, Bent RC.Meconium staining and the meconium aspiration syndrome.Unresolved issues.Pediatr Clin North Am, 1993, 40(5): 955-981
[6]Korhonen K, Soukka H, Halkola L, et al.Meconium induce only local inflammatory lung injury in piglet.Pediatr Res, 2003, 54(2): 192-197
[7]Salvesen B, Nilsen EW, Harboe M, et al.Mechanisms of complement activation and effects of C1-inhibitor on the meconium-induced inflammatory reaction in human cord blood.Mol Immunol, 2009, 46 (4): 688-694
[8]Okazaki K, Kondo M, Kato M, et al.Serum cytokine and chemokine profiles in neonates with meconium aspiration syndrome.Pediatrics, 2008, 121 (4): 748-753
[9]Fernandes AB, Zin WA, Rocco PR.Corticosteroids in acute respiratory distress syndrome.Braz J Med Biol Res, 2005, 38 (2): 147-159
[10]Vidyasagar D, Lukkarinen H, Kaapa P, et al.Inflammatory response and apoptosis in new born lungs after meconium aspiration.Biotechnol Prog, 2005, 21 (1): 192-197
[11]Hanna S, Lauri H, Heikki A, et al.Methylprednisolone attenuates the pulmonary hypertensive response in porcine meconium aspiration.Pediatr Res, 1997, 42(2): 145-150
[12]Brozmanova M, Calkovsky V, Plevkova J, et al.Effects of inhaled corticosteroids on cough in awake guinea pigs with experimental allergic rhinitis-the first experience.J Physiol Pharmacol, 2004, 55(S3): 23-30
[13]Frantz ID, Wang NS, Thach BT.Experimental meconium aspiration: effect of glucocorticoid treatment.J Pediatrics, 1975, 86 (3): 438-441
[14]Holopainen R, Laine J, Halkola L, et al.Dexamethasone treatment attenuates pulmonary injury in piglet meconium aspiration.Pediatr Res, 2001, 49 (2): 162-168
[15]Mokry J, Mokra D, Antosova M, et al.Dexamethasone alleviates meconium-induced airway hyperresponsiveness and lung inflammation in rabbits.Pediatr Pulmonol, 2006, 41 (1):55-60
[16]Mokra D, Calkovska A, Tonhajzerova I, et al.Dexamethasone treatment improved lung function in meconium-instilled rabbits, but influenced cardiovascular variables.Bratisl Lek Listy, 2008, 109(3): 95-101
[17]Yeh TF, Srinivasan G, Harris V, et al.Hydrocortsone therapy in meconium aspiration syndrome.J Pediatr ,1977, 90(1):140-143
[18]Barr P.The use of dexamethasone in full-term infants with severe respiratory failure and pulmonary barotraumas.J Paediatr Child Health, 1991, 27 (6): 366-369
[19]Tripathi S, Saili A.The effect of steroids on the clinical course and outcome of neonates with meconium aspiration syndrome.J Trop Pediatr, 2007, 53(1):8-12
[20]Basu S, Kumar A, Bhatia BD, et al.Role of steroids on the clinical course and outcome of meconium aspiration syndrome.J Trop Pediatr, 2007, 53(5):331-337
[21]Halliday HL, Ehrenkranz RA, Doyle LW.Early (<8days) postnatal corticosteroids for preventing chronic lung disease in preterm infants.Cochrane Database Syst Rev, 2009, (1): CD001146
[22]Yuan L(袁琳),Chen C.Adverse effect on nervous system of postnatal corticosteroid treatment.International Journal of Pediatrics(国际儿科学杂志), 2006, 33(4): 222-224
[23]Halliday HL.Use of steroids in the perinatal period.Paediatr Respir Rev,2004, 5(S): 321-327
[24]Kaapa P.Corticosteroid treatment in meconium aspiration syndrome: a solution for better outcome? Acta Pediatr,2004, 93(1): 5-7
[25]Committee on Fetus and Newborn.Postnatal corticosteroids to treat or prevent chronic lung disease in preterm infants.Pediatrics, 2002, 109(2): 330-338
[26]Halliday HL.Guidelines on neonatal steroids.Prenat Neonatal Med, 2001,6: 371-373
[27]金汉珍, 黄德眠, 官希吉,主编.实用新生儿学.第三版.北京: 人民出版社, 2002.429-433
[28]Singh M.Care of the newborn.6th edn.New Delhi: Sagar Publications, 2004: 196-218
[29]Higgins JPT, Green S.Cochrane Handbook for Systematic Reviews of Interventions Version 5.0.2 .Available from www.cochrane-handbook.org
[30]Wu JM, Yeh TF, Wang JY, et al.The role of pulmonary inflammation in the development of pulmonary hypertension in newborn with meconium aspiration syndrome.Pediatr Pulmonol, 1999, 18 (S): 205-208
[31]Huang BX(黄璧璇), Zhang SL, Feng SM.Budesonide suspension associated with ambroxol hydrochloride spray inhalation driven by oxygen to treat meconium aspiration syndrome of newborn.Mordern Hospital(现代医院), 2009, 9(8): 54-55
[32]Tripathi S, Saili A, Dutta R.Inflammatory markers in meconium induced lung injury in neonates and effect of steroids on their levels:a randomized controlled trial.Indian J Med Microbiol, 2007, 25(2): 103-107
[33]Ward MC, Sinn JKH.Steroid therapy for meconium aspiration syndrome in newborn infants.Cochrane Database Syst Rev, 2003, (4): CD003485
