普通烟草种质资源的SSR标记与指纹图谱分析
2011-01-17刘艳华牟建民张兴伟陈雅琼王志德
徐 军,刘艳华,任 民,牟建民,张兴伟,陈雅琼,王志德*
(1.农业部烟草类作物质量控制重点开放实验室,中国农业科学院烟草研究所,青岛 266101;2.中国农业科学院研究生院,北京 100081)
烟草在我国国民经济中占有重要地位,烟草种质真实性和纯度直接影响产品的质量,因此,种质鉴定是烟草生产和研究工作中的重要一环。传统的鉴定方法主要有形态鉴定、蛋白及同工酶鉴定[1],但这些方法易受实验材料所处发育时期、取样部位和环境等多种因素的影响,准确率不高,且实验过程复杂,操作程序繁琐,难以大规模推广应用。近年来发展的分子标记技术克服了传统方法的缺点,被越来越多地应用到种质鉴定工作中,分子标记技术种类较多,常用的有RFLP、RAPD、AFLP、SSR等,其中SSR标记具有结果可靠,重复性好,多态性丰富,操作简单,呈共显性遗传等特点[2-3],已被应用于水稻[4]、玉米[5]、樱桃[6]等多种作物的种质鉴定中。
本研究利用SSR标记技术,从分子水平上鉴别区分了80份普通烟草种质,并构建了它们的SSR指纹图谱,验证了用SSR标记鉴别烟草种质的可行性。
1 材料与方法
1.1 实验材料
本研究选取烟草核心种质中的 80份普通烟草种质为材料,包括14份白肋烟,9份香料烟,6份雪茄烟,26份烤烟,25份晒烟。材料均由国家烟草种质库提供。
1.2 DNA提取
供试材料温室育苗,长成幼苗后用CTAB法提取基因组总DNA,用琼脂糖凝胶电泳检测含量后保存于-20 ℃冰箱待用。
1.3 SSR检测
实验所用286对SSR引物序列为Bindler等[7]人公布,下载自http://solgenomics.net。PCR扩增总体 15 µL,其中包括 1×PCR 缓冲液,MgCl21 mmol/L,dNTPs各1.2 mmol/ L , Taq酶1 U,引物0.4 µmol/L ,基因组 DNA 20 ng ,PCR反应程序为:94 ℃预变性 5 min 后,94 ℃ 变性 45 s ,58 ℃ 退火 45 s ,72 ℃ 延伸45 s ,35个循环后,72 ℃再次延伸10 min,最后4 ℃保存。其中退火温度要根据引物的不同而调整。
1.4 电泳及染色
PCR产物用 8%非变性聚丙烯酰胺凝胶,以1×TBE作缓冲液,180 V恒压进行电泳。电泳后,银染,拍照。银染方法如下:
卸板后漂洗;然后在染色液(1 L水中溶解2 g硝酸银,5 mL冰乙酸,100 mL无水乙醇)中染色10 min;再次漂洗后放入显色液(1 L水中溶解15 g氢氧化钠,3 mL 37 %甲醛)中显色。
2 结 果
2.1 SSR多态性分析
通过对286对SSR特异性引物进行筛选,从中选出8对反应稳定,扩增条带清晰,多态性强的引物,对这80份材料DNA进行扩增(图1),共得到85个等位位点,其中引物 PT20189、PT20287、PT30380、PT30403的等位位点数最少,为9个;引物 PT20372、PT20213的等位位点最多,为 14个,平均为10.6个(图2)。通过POPGENE软件分析可知8个引物等位位点多态性信息含量 ( P I C)变幅为0.63~0.88,平均为0.81(表1)。
2.2 SSR指纹图谱构建
以“1”和“0”分别表示扩增产物的“有”和“无”,将 8对SSR引物产生的 85 个多态位点依次排序,形成一个 SSR数据矩阵(表2),建立品种计算机化的 DNA 指纹,以区分供试的每个品种。对SSR数据矩阵聚类分析,发现这8对引物可完全将这80份烟草种质区分开来(图3),每一份种质都有自己独特的指纹图谱(图4)。
图1 引物PT30380对部分材料扩增结果Fig.1 The amplified result of part of materials by primer PT30380

图2 引物PT20202扩增的多态性条带Fig.2 The polymorphic bands amplified by primer PT20202
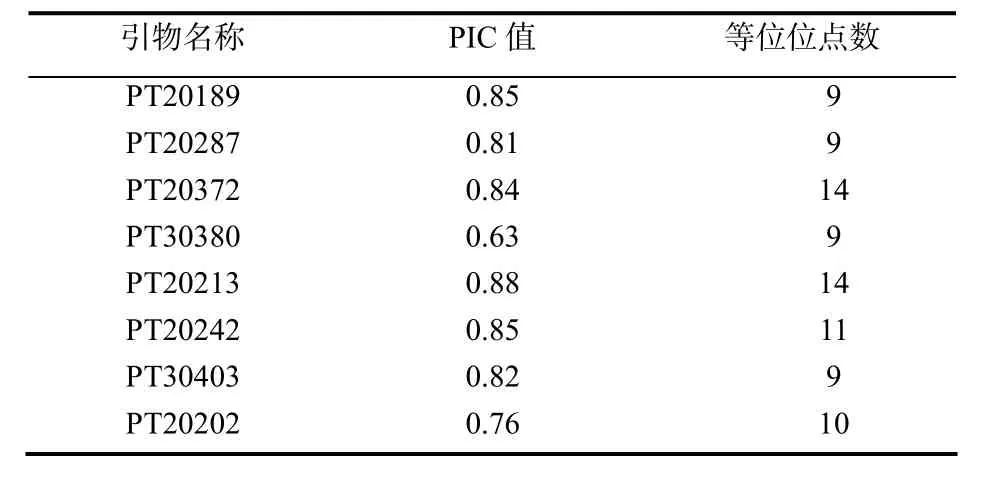
表1 8对SSR引物名称, PIC值, 检测到的等位位点数目Table 1 The name of 8 pairs of SSR primer, PIC of primers and the number of the variance allele
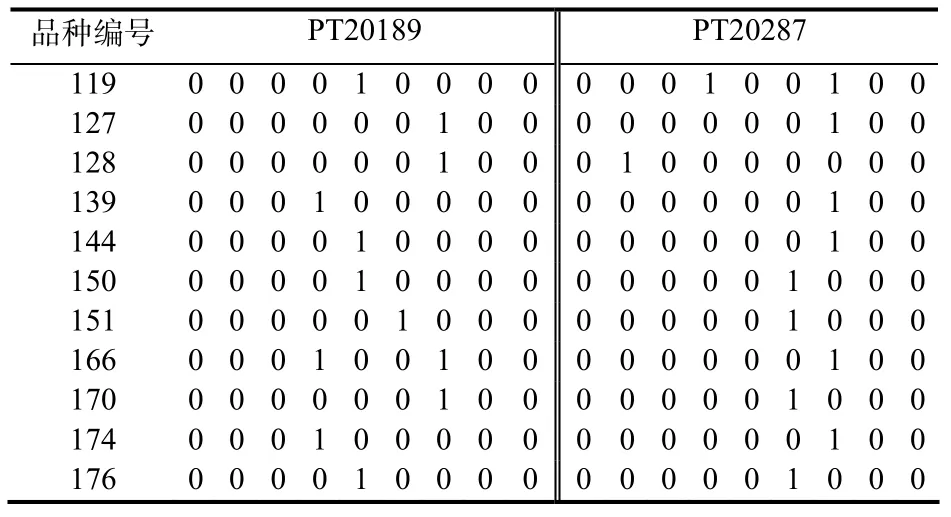
表2 部分材料对引物PT20189和PT20287的扩增结果Table 2 The PCR results of some materials by primer PT20189 and PT20287

图3 80份烟草种质基于SSR分析的UPGMA聚类图Fig.3 Dendrogram derived from UPGMA cluster analysis based on SSR analysis method among 80 tobacco germplasms

图4 485号材料对8对引物扩增的指纹图谱Fig.4 The DNA fingerprint of material NO.485 amplified by 8 primers
3 讨 论
目前用分子标记鉴定烟草种质的研究还较少,RAPD技术有过报道[8-10],但RAPD标记的重复性和稳定性一直存在争议,需要严格控制反应条件才能得到理想结果[9],且扩增位点多态性不如SSR 标记丰富。如Coussirat J C[11]用160 对引物对32份烟草种质进行了RAPD分析,其中9对引物扩增出了29个多态性位点,平均每对引物3.2个。许明辉等[9]利用235对引物对23份烟草种质进行RAPD分析,其中16对引物扩增出46个多态性位点,平均每个引物2.9个。SSR引物在烟草上的发展和其他作物相比较晚,直到 2007年,Bindler等[7]首次报道了烟草的微卫星标记遗传图谱,因此,SSR在烟草研究上应用还不广泛。本实验中,从286对SSR引物中筛选的8对引物共扩增出85个多态性位点,平均每对引物10.6个,多态性明显优于RAPD引物,这与刘冠明等[12]的研究结果一致。这几对引物的重复性验证结果也表明 SSR标记的重复性和稳定性很好。此外,实验中还发现SSR标记对反应条件要求不严格,如反应对DNA模板质量要求不高,略微改变反应体系不会对 PCR反应结果造成明显影响,与朱英等[13]的报道也相符合。因此,与RAPD标记相比,SSR标记更适合于普通烟草种质鉴定和指纹图谱构建工作,SSR标记将会在烟草种质鉴定工作中发挥更加重要的作用。
[1]梁明山,刘煜,周翔.蛋白质电泳指纹图谱对烟草品种鉴定的研究[J].西南农业学报,2000,13(2):83-88.
[2]陈学伟,李仕贵,马玉清,等.水稻抗稻瘟病基因的聚合及分子标记选择[J].生物工程学报,2004,20(5):708-714.
[3]WUY, HUANGY.An SSR genetic map of Moench and its comparison to a published genetic map[J].Genome,2007, 50: 84-89.
[4]张彦,郭士伟,何冰,等.利用 SSR 标记建立杂交水稻分子指纹图谱数据库[J].江苏农业学报,2006,22(2):181-183.
[5]王凤格,赵久然,郭景伦,等.中国玉米新品种 DNA 指纹库建立系列研究玉米品种纯度及真伪鉴定中 SSR技术标准实验体系的建立[J].玉米科学,2003(1):3-6.
[6]艾呈祥,张力思,魏海蓉,等.甜樱桃品种 SSR指纹图谱数据库的建立[J].中国农学通报,2007,23(5):55-58.
[7]Bindler G, vander Hoeven R, Gunduz I, et al .A microsatellite marker based linkage map of tobacco[J].Theo Appl Genet., 2007, 114: 341-349.
[8]梁明山,刘煜,侯留记,等.烟草品种的DNA指纹图谱和品种鉴定[J].烟草科技,2001(1):34-37.
[9]许明辉,郑民惫,刘彦中,等.烟草品种 RAPD 分子标记多态性与品种鉴定[J].种子,1998(5):23-25.
[10]何川生,张汉尧,卢江平,等.RAPD技术在烤烟品种资源鉴定及纯度分析中的应用[J].河南农业大学学报,2000,34(3):240-243.
[11]COSSIRAT J C.Genetic diversity and varietal indentification in the species Nicotiana tabacum by RAPD markers[J].Annaesddll Tabac,1994, 26: 1-7
[12]刘冠明,郑奕雄,黎国良,等.20个花生品种的 SSR标记指纹图谱构建[J].农业生物技术科学,2006,22(6):49-51.
[13]朱英,陶刚,刘作易,等.SSR分子标记的发展及其在动植物遗传育种中的应用[J].贵州农业科学,2006,34(增):93-95.
