小鼠骨髓干细胞移植对生殖细胞生成的影响△
2011-01-15陕西省人民医院泌尿外科西安710068程永毅徐永刚
陕西省人民医院泌尿外科(西安 710068) 程永毅 孙 羿 徐永刚 时 亮
小鼠骨髓干细胞移植对生殖细胞生成的影响△
陕西省人民医院泌尿外科(西安 710068) 程永毅 孙 羿 徐永刚 时 亮
目的:探讨绿色荧光蛋白转基因小鼠骨髓干细胞移植对不育模型小鼠生殖细胞的影响。方法:用白消安造小鼠无精子症模型,将绿色荧光转基因小鼠骨髓细胞处理后移植到无精子症模型小鼠睾丸网内,在小鼠分组干预后用Western-Blot方法检测各组小鼠睾丸VASA基因表达水平。结果:模型鼠睾丸病理切片显示睾丸曲细精管内生殖细胞显著减少(P<0.05),Western-Blot结果显示 VASA基因蛋白水平较正常鼠显著降低(P<0.05)移植成功组小鼠VASA基因蛋白表达水平较模型对照组高(P<0.05),但仍低于正常鼠水平。结论:①含骨髓干细胞的骨髓混合细胞移植到无精子症模型小鼠睾丸网内,可明显促进生殖细胞生成。②VASA基因表达水平可作为睾丸性不育动物模型评价指标。
干细胞是一类具有自我更新、高度增殖和多向分化潜能的细胞,具有无限分裂能力。骨髓含有造血干细胞,间充质干细胞,内皮干细胞,多能成人祖细胞,而骨髓移植技术早已成为临床上非常成熟的治疗技术[1]。已经有研究证实,骨髓中的间充质干细胞可分化成骨、软骨、脂肪、肌肉、肌腱组织、肝脏、心肌、肾脏、神经细胞[2,3],生殖细胞[4~6],间质细胞[5,6],而且还可以分化成支持细胞[6]。本研究旨在通过将含有干细胞的骨髓混合细胞移植入无精子症模型鼠的睾丸内,检测生殖细胞标志物V ASA基因蛋白的表达水平,观察骨髓干细胞移植对模型鼠睾丸生殖细胞的影响。
材料与方法
1 动物与试剂
1.1 动物与分组 4周龄雄性ICR小鼠200只,购于西安交通大学医学院动物中心。随机选取30只作为空白对照组,不参与造模与移植,正常条件饲养 14周后检测标本;剩余 170只小鼠用白消安造模,饲养 4周后存活小鼠中随机选取 30只作为模型评价组,评价模型效果;剩余存活造模鼠中随机选取 30只小鼠作为模型恢复组,不参与移植正常饲养,再饲养 10周后存活小鼠检测标本。最后剩余小鼠全部参与移植,移植后10周存活小鼠分批处死,存活小鼠取睾丸检测标本,判定移植成功的睾丸为移植成功组,移植成功组小鼠非移植侧睾丸为移植阴性对照组。
1.2 实验试剂 白消安购于西格玛奥德里奇公司,纯度为99.99%。DM SO购于西格玛奥德里奇公司。
2 模型制备 将白消安配成2%DMSO水溶液,37℃水浴箱内水浴,防止药物沉淀,将小鼠称重,按50mg/kg剂量腹腔单次注射白消安溶液,正常饲养 4周后用于移植。造模4周后随机抽取 30只模型鼠,一侧睾丸常规 HE切片,另一侧睾丸用W estern-Blot方法检测睾丸细胞VASA基因表达水平。
3 供体细胞制备
3.1 供体小鼠 GFP转基因雄性小鼠,购于第四医大学神经科学研究所。
3.2 细胞制备 无精子症模型造好后,处死GFP转基因小鼠,在无菌台上解剖开股骨和胫骨,用磷酸盐缓冲盐水(PBS)(p H 7.4)冲洗,冲洗液在 600 r/min离心分离 5min后细胞沉淀,然后在 34°C去镁去钙的Hanks平衡盐溶液中缓慢消化,形成含有0.05μg/m l胶原蛋白酶;0.05 mg/m l DNA酶和 0.025%胰蛋白酶的单细胞悬液。之后加入胰蛋白酶抑制剂,离心,用达尔伯克改良伊格尔培养基(Du lbecco’smodified eagle medium)洗涤,细胞计数,600 r/min离心 5min后细胞沉淀,用 0.04%台盼蓝染色剂(Trypan blue stain)混悬。细胞计数浓度为 (5~ 15)× 104/m l。
4 移 植
4.1 移植器械 20-μl玻璃微量吸管,带一个移液管吸头。每个移液管口都用微型砂轮磨成斜面尖端,形成微注射器。
4.2 移植步骤 移植方法参照文献[6,9]略作修改。用无菌的30号计量注射针在与睾丸连接的传入束上刺一小口23mm,微移液管尖端插入传入束,轻轻向前推向睾丸网,当尖端进入网状区,恒压下推入 10μl细胞悬液。
5 移植成功的判定标准 移植后10~ 12周分批处死小鼠,右侧睾丸(非移植侧)沿长轴纵行剖开,一半立即检测 VASA基因表达水平,剩余标本用 4%多聚甲醛固定做 HE染色病理切片;左侧(移植侧)睾丸沿长轴纵行剖开成两半,其中一半迅速制成细胞悬液,在倒置荧光显微镜下观察,以找到显示绿色荧光的完整细胞作为移植成功的判定依据,有完整的荧光细胞表明移植成功(见图 1~2),剩余半部分睾丸再沿长轴剖成各四分之一大小,其中一部分制病理切片,其余部分用 W estern-Blot法检测VASA基因表达水平,否则判定移植不成功,舍弃该标本。

图 1 普通光镜下组织悬液,含有较小组织碎片
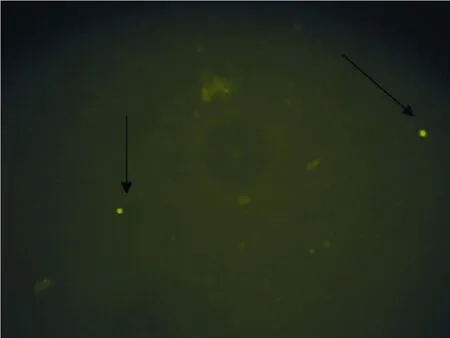
图2 荧光镜下可见明显的GFP阳性细胞及较小组织碎片
6 统计学处理 将各组小鼠睾丸 Western-Blot检测结果用 Bandscan软件分析后形成数据,采用SPSS13.0统计软件进行统计分析,以P<0.05为有显著性差异,以P<0.01为有极显著性差异。
结 果
1 病理检测 见图3~ 6。空白对照组曲细精管显示正常形态,各级细胞排列有序;模型评价组曲细精管细胞层次显著变少,失去正常生精上皮结构,精母细胞和精细胞消失,与空白对照组差异明显;模型恢复组曲细精管生精上皮有所恢复,但仍未及正常水平,多数标本显示生精细胞层次紊乱;移植成功组曲细精管生精上皮结构均有不同程度恢复但仍未达到正常水平。

图 3 空白对照组小鼠曲细精管,可见生殖细胞层次有序
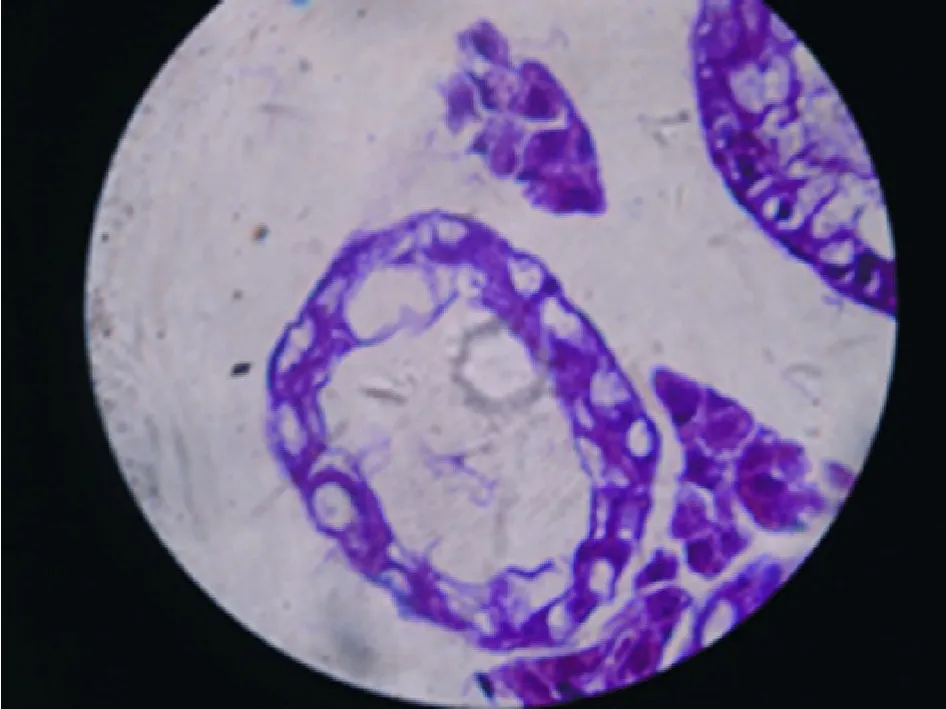
图 4 模型评价组曲细精管,各级生殖细胞消失,支持细胞空泡样变性
2 VASA基因表达 见图 7。各组小鼠睾丸VASA基因蛋白 W estern-Blot条带,以空白对照组VASA基因表达数据均值为基准,设为 1,空白对照组(30只 )为 1.000± 0.009,模型评价组 (30只 )为 0.082± 0.031,模型恢复组 (28只 )为 0.313± 0.037,移植成功组(17个睾丸)为 0.795±0.233,移植阴性对照组(17个睾丸)为 0.326±0.035。空白对照组VASA基因表达水平最高,显示了正常小鼠睾丸VASA基因的表达水平。模型评价组VASA基因表达水平最低,模型恢复组较模型评价组高,提示了模型自然恢复的效果,移植成功组数据较模型恢复组明显高(P<0.01),提示了移植成功组的效果,但仍较空白对照组低。移植阴性对照组和模型恢复组数据非常接近。
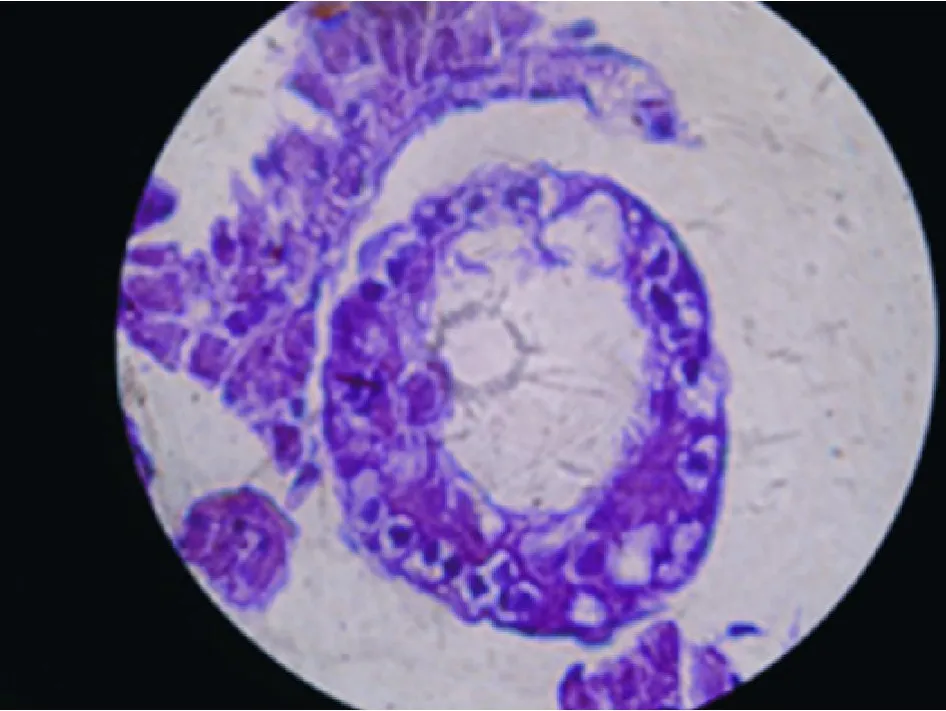
图 5 模型恢复组曲细精管,生殖细胞有所恢复
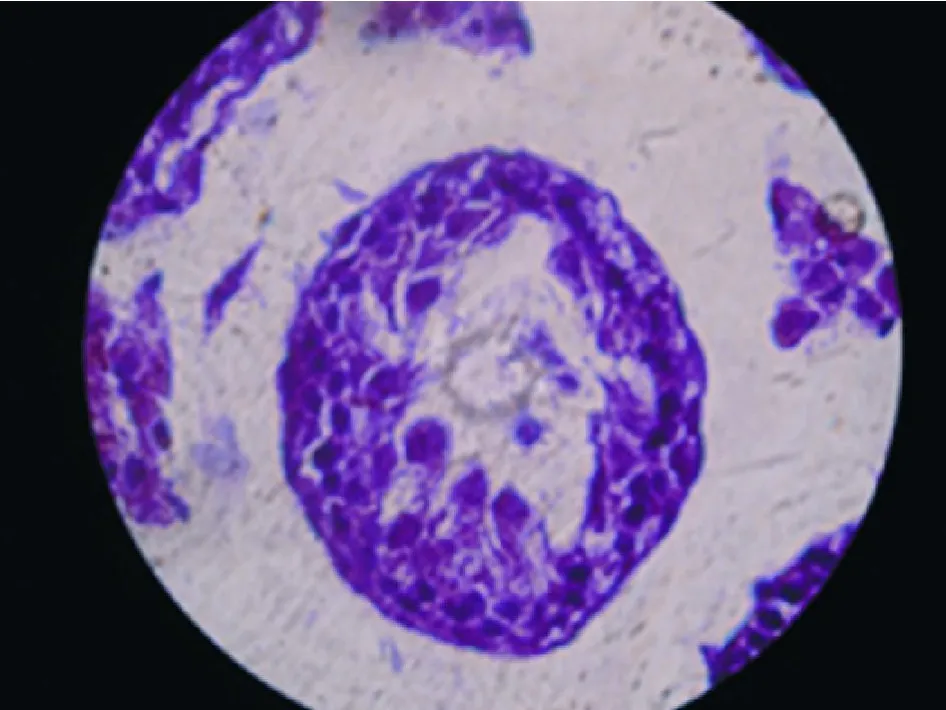
图 6 移植成功组曲细精管,可见生殖细胞明显恢复
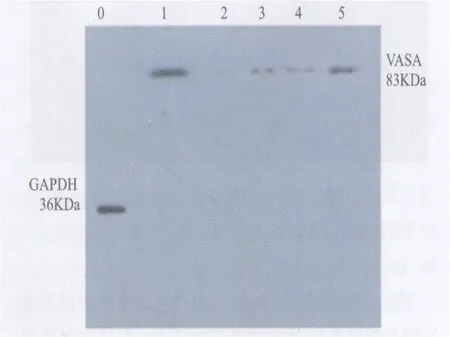
图 7 各组小鼠睾丸V ASA基因表达条带示例 0为内参GAPDH,1为空白对照组,2为模型评价组,3为模型恢复组,4为移植阴性对照组,5为移植成功组
讨 论
骨髓干细胞有多样分化潜能,目前的研究均发现不同的外环境可决定干细胞的分化方向,但骨髓干细胞的分化机制及调控机制尚无公认的突破性研究。干细胞移植本身改变了干细胞的外环境,即对干细胞分化产生调控。而干细胞移植在多种动物模型中均产生了不同程度的修复作用[2],具体机制目前尚不清楚。本组将GFP转基因小鼠的骨髓细胞移植到模型鼠睾丸,10~12周后在荧光显微镜下睾丸细胞悬液中成功发现17例标本内含有GFP阳性的细胞,可证实供体骨髓细胞在受体内存活。这与国内文献报道[6]相一致。本组实验证实含干细胞的骨髓混合细胞移植,可明显促进模型鼠生殖细胞生成。我们在研究中通过小鼠移植成功侧睾丸,未移植侧睾丸及模型对照组小鼠睾丸的对照,明确证实移植成功的睾丸内 VASA蛋白表达水平较未移植侧及模型对照组明显高。同时未移植侧睾丸与模型对照组小鼠睾丸的VASA表达水平无显著性差异。
关于本研究的分组,我们特别将移植鼠的左侧睾丸移植,右侧睾丸不移植,作为对照组。理论上,移植侧的细胞无法经过血液循环到达非移植侧,但是移植这个干预措施是否会通过受体鼠自身的免疫反应或某些细胞因子而对非移植侧睾丸的精子发生产生影响?本组实验没有发现移植操作对非移植侧睾丸产生明确影响,证实移植成功后睾丸内发生的变化是由移植的供体细胞产生的。
用V ASA蛋白表达水平可作为评价白消安无精子症模型成功的指标。无论用何种药物及方法制造无精子症模型,最终目标都是清除内源性的精子发生。而精原细胞、各级精母细胞以及精子等是人类及模型动物睾丸内惟一表达VASA蛋白的生殖细胞[7~8]。因此,可用V ASA蛋白表达水平衡量无精子症动物模型体内生殖细胞的相对数量。而白消安可明显损伤生殖细胞,造成曲细精管生精细胞结构及层次的破坏,明显减少生殖细胞的数量,因此,可用 VASA蛋白表达水平可作为评价白消安无精子症模型成功与否的指标。
[1] Srour EF,Jetmore A,W olber FM,etal.Homing,cell cycle kinetics and fateo f transplanted hematopoietic stem cells[J].Leukemia,2001,15(8):1681-1684.
[2] Grove JE,Bruscia E,Krause DS,et al.Plasticity of bonemarrow-derived stem cells[J].Stem Cells,2004,22(5):487-500.
[3] Jiang Y, Jahagirdar BN,Reinhard t RL,et al.Pluripotency of mesenchyma l stem cells derived from adultmarrow[J].Nature,2002,418:41-49.
[4] Nayernia K,Lee JH,Drusenheimer N,et al.Derivation o f male germ cells from bone marrow stem cells[J].Lab Invest,2006,86(11):654-663.
[5] Yazaw a T, M izutani T, Yamada K,et al.Differentiation of adult stem cells derived from bone marrow stroma into Leydig or ad renocortical cells[J].Endocrino logy,2006,147(10):4104-4111.
[6] Yanhe L,K rista E,Peter Y,et al.Fate of bone marrow stem cells transplanted into the testis potential implication for men with testicular failure[J].American Journal o f Pathology,2007,170:899-908.
[7] Erez R.The function and regu lation of vasa-likegenes in germ-cell development[J].Genome Biology,2000,1(3):10171-10176.
[8] Nico la R,Brian C.Dazl binds in vivo to specific transcripts and can regulate the pre-meiotic translation of M vh in germ cells[J].Human Mo lecu lar Genetics,2005,14,(24):3899-3909.
[9] Brinster RL, Zimmermann JW. Spermatogenesis following male germ-cell transp lantation[J]. Proc Natl Acad Sci USA,1994,91:11298-11302.
骨髓祖代细胞 /移植 生殖细胞 /病理生理学 基因 /代谢 模型,动物 小鼠
R734.2
A
1000-7377(2011)01-0026-04
△陕西省科技厅 2006K15-G4
(收稿:2010-09-30)
