酶法合成右旋糖酐及过程调控研究进展*
2011-01-12邹青松浦媛媛王晓王清李素霞陈山
邹青松,浦媛媛,王晓,王清,李素霞,陈山
(广西大学糖业工程技术研究中心,广西南宁,530004)
右旋糖酐(dextran,dex)是一种主链含α-(1,6)糖苷键大于50%的带支链的葡聚糖,根据生产菌株的不同,支链可为 α-(1,2)、α-(1,3) 或 α-(1,4)糖苷键链,且支链所占的比例也大不相同。低分子量右旋糖酐具有良好的药用价值,《中国药典(2010版)》收录的12种与右旋糖酐相关的药物,主要用于扩增血容量、抗凝血、降低血液粘度和抗贫血等。右旋糖酐结构疏松柔软,具有较好的水溶性及持水性,也被当作保湿剂、增稠剂等应用于食品工业和其它化工行业[1-2]。
右旋糖酐主要是以蔗糖为底物,由肠膜明串珠菌(Leuconostoc mesenteroides,L.M.)和链球菌属(Streptococcus species)等细菌分泌右旋糖酐蔗糖酶(dextransucrase,DSase,EC 2.4.1.5)催化合成。DSase 把蔗糖水解成葡萄糖基和果糖后又把葡萄糖基聚合成右旋糖酐,然而由于酶法合成右旋糖酐的区域均一性以及区域选择性等机理尚不明确[3-4],合成产物的分子量分布和均一性难以控制,导致后续分离成本较高。采用酸水解和乙醇分级沉淀的传统方法所获得的右旋糖酐产品存在分子量分布范围宽、酶蛋白残留和氯元素过多等风险,限制了右旋糖酐的临床应用。近年来,膜工艺、基因克隆技术以及固定化技术得到了较大的发展,这些新技术为右旋糖酐的生产提供了新的理论和技术支持。
1 酶法合成右旋糖酐的机理研究现状
右旋糖酐蔗糖酶(DSase,EC 2.4.1.5)属于糖酐水解酶70家族(Family 70),是一种催化合成右旋糖酐的胞外酶。DSase在60多年前已被鉴定,其作用机理也有相关研究,目前日本学者利用单分子力谱法从分子力水平上阐述了右旋糖酐链伸长的过程[5],但DSase三维结构不清晰,其区域均一性和区域选择性机理还不明确,这成为该酶工业化生产高品质右旋糖酐的一个亟待解决的理论难点[3-4]。
右旋糖酐的酶法合成至少存在2种互有争议的机理模型。其一认为DSase的C端对右旋糖酐的链增长起决定性作用,蔗糖和由蔗糖水解得到的葡萄糖是整个反应的引发剂,并且右旋糖酐链增长是基于一单活性位点,并从合成产物非还原端开始的半连续增长模式[6-7];另有学者认为,蔗糖和葡萄糖不是引发剂,而右旋糖酐的增长是基于一单活性位点的从合成产物还原端开始的高度持续增长模式[8]。右旋糖酐酶法合成的机理以及模型建立还有待更深一步的研究。
2 右旋糖酐蔗糖酶纯化分析及来源优化
关于DSase酶的研究在早期主要集中于原始酶的特性及其纯化技术。随着研究的进一步深入,生产菌的诱变、培养基定向优化以及酶的基因改造成为提高DSase酶活力和酶产量的主要技术手段。
Robyt等[9]以L.M.NRRL B-512FMC-16 为生产菌,以发酵罐为反应场所,在最适条件下可得到酶活达20~25 IU/mL的DSase,经孔径为0.1μm或切割分子量(MWCO)为100 ku的中空纤维膜浓缩后,得到10g级或更大规模的比酶活力达183 IU/g的DSase,且所得的酶在SDS-PAGE分析中为单蛋白质条带。Purama等[10]利用聚乙二醇(PEG)纯化 L.M.NRRL B-640 DSase,发现PEG-1500酶分子片断纯度提高40倍,酶活力达23 IU/mL。膜分离获得定向酶分子片断以及新分离纯化材料的应用将是纯化DSase的一个新方向。
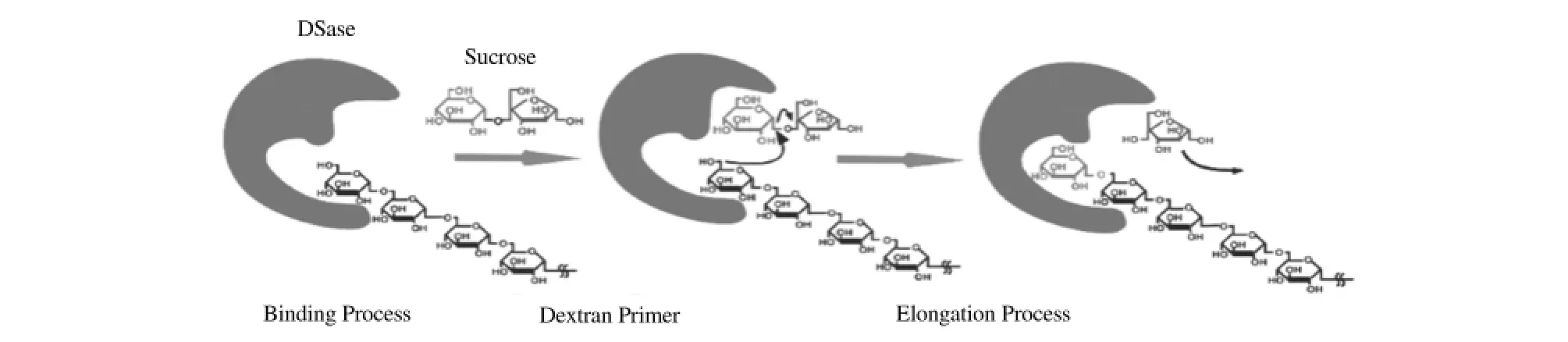
图1 右旋糖酐链增长示意图[5]
国内外对DSase的生产菌株的基因改造已有较多的研究报道(见表1)。研究者主要围绕获得更高酶活力和更高生产能力的工程菌以生产含较多α-(1,6)糖苷键的右旋糖酐,因为α-(1,6)糖苷键含量越高,右旋糖酐水溶性越好,更适于应用到医药和食品等行业。表1数据表明,已有研究所得结果还不甚理想,DSase基因工程研究还有待更新突破。目前,国外已有Pharmacia等企业能生产出高品质的右旋糖酐,国内虽有企业进行右旋糖酐生产,但质量和国外产品还有较大差距。
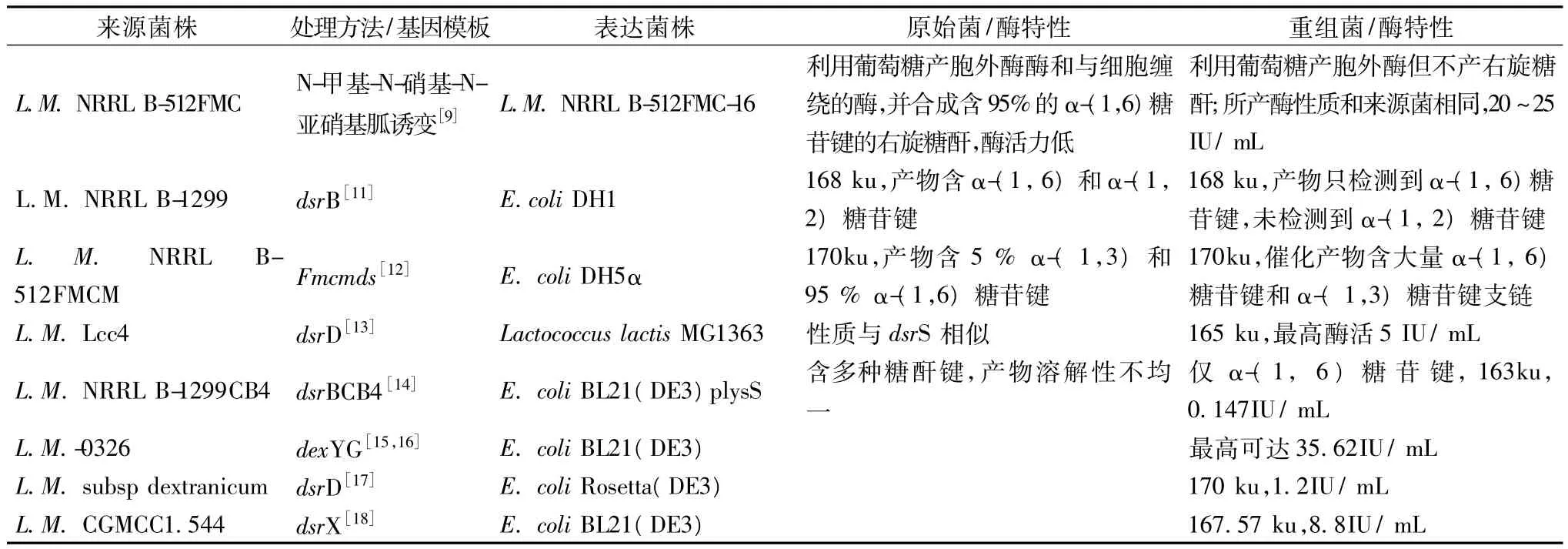
表1 右旋糖酐酶法合成菌或酶的优化
3 右旋糖酐酶法合成的调控
右旋糖酐的分子质量对其性质的影响很大,一般药用右旋糖酐的分子质量为20、40、70 ku,因而除产量外,分子量大小和分子量分布的均一性也是右旋糖酐生产的重要目标。另外,药用右旋糖酐其分子链中的α-(1,6)糖苷键一般不低于95%,右旋糖酐的支链分布也影响其在食品行业的应用,分子结构的控制也是右旋糖酐生产的一个主要技术指标。
3.1 不同底物对右旋糖酐酶法合成的影响
蔗糖不是DSase能催化的唯一底物,反应底物不同,DSase合成的产物也不同。Kubik等[19]联合使用DSase和右旋糖酐蔗糖酶(Dextranase,Dase),通过控制二者比例可获得右旋糖酐或低聚糖等不同产物,当DSase:Dase为100∶1时,产物主要为药用右旋糖酐,当二者比例为1∶8时,得到低聚异麦芽糖混合物。当蔗糖为单一底物时,DSase只合成右旋糖酐;若蔗糖和甲基-D-葡萄糖酐以1∶4的比例作为底物时,L.M.B-512F仅生产高出空白4%的右旋糖酐[20]。相似的,Kitaoka等[21]研究发现以下3种情况右旋糖酐的产量会降低:(1)反应体系中同时存在较高浓度的蔗糖和麦芽糖;(2)蔗糖消耗完后,体系中仍有高浓度的DSase;(3)存在麦芽糖等受体和以右旋糖酐为底物的受体反应。
3.2 反应条件对右旋糖酐酶法合成的影响
右旋糖酐酶法合成的调控主要是以底物浓度、酶量、反应温度和 pH等为调控参数。Santos等[22]以1.5 dm3的发酵罐为反应容器探索出L.M.B-512F发酵生产右旋糖酐的最适条件为温度35℃、pH5.5、初始蔗糖浓度20 g/L,在此条件下酶量可达40 g/L、酶活力为4.17 IU/mL,右旋糖酐产量为8.17 g/L,当蔗糖浓度超过40 g/L时产物和菌难以分离。Kim等[23]研究发现,在一定范围内随着蔗糖摩尔浓度增加,L.M.B-512 FMCM DSase生物合成的大分子右旋糖酐(>106u)逐渐减少,而小分子(<105u)逐渐增加;温度对分子质量大于106u的右旋糖酐的分子量影响极为有限,但可以影响支链的生成率;pH值在4.5~6.0内不产生显著影响(见表2)。Falconer等[24]对这一问题作进一步的研究,揭示了在一定条件下右旋糖酐分子量大小与体系中的酶含量成反相关关系,而蔗糖浓度和发酵温度则与之成正相关的规律。

表2 不同条件下合成的右旋糖酐在不同分子量区间分布的百分数[23]
3.3 固定化技术对右旋糖酐酶法合成的调控
原始菌固定于海藻酸钙小球时会带入附着于菌的右旋糖酐,导致反应过程中固定化小球的溶胀变形甚至破裂[20],这一问题是固定化技术生产右旋糖酐的一个突出问题,可通过在固定化过程中添加Dase予以解决。海藻酸盐是固定化技术中应用最多的固定化材料,但Eupergit C、Eupergit C 250 L、羟基磷灰石以及丙烯酰胺等已被作为新型固定化材料应用于右旋糖酐生物合成的研究中。Eupergit C和Eupergit C 250L的固定化效果优于海藻酸钠,在pH 5.4时Eupergit C 250L组的酶比活性达710IU/g,2天后仍保持固定化初始时期酶活力的40%[25]。羟基磷灰石较前两者更优,其同时固定化DSase和Dase可使酶表现出高比活性和高分散性的特点[26]。而在15%的丙烯酰胺和0.4%的双丙烯酰胺交联剂固定L.M.KIBGE HA1实验中,发现90%的游离菌可被固定,生产时间长达480 h,远高于游离菌的144 h,且产物分子量远小于游离菌发酵产物[27]。
国内对固定化生产右旋糖酐的研究主要来自合肥工业大学。姚日生等[28]在DSase固定化生产右旋糖酐过程中加入Dase以控制产物分子量大小,在最初的2 h可使右旋糖酐的重均相对分子质量从8.52×105u降至2.00×105u,但在后续反应时间里,分子量的下降趋于平缓。张洪斌等[29]改进了固定化材料配方,以4%海藻酸钠和1%琼脂按1∶1(V/V)混合作为载体制备的DSase固定化微球,该固定化酶表现出持续性的高酶活力,在第6批次时转化率仍可维持在40%左右,并探索得到的固定化操作的最适条件为40℃,pH 5.4。其他研究机构也有固定化生产右旋糖酐的报道,蓝平等[30]发现活性炭固定L.M.20074的效果较好,在适当条件下可以得到产率为81.6%、相对分子质量大于40万的右旋糖酐。
4 总结与展望
右旋糖酐的生产菌株来源广泛,生产原料廉价易得,其在医药、食品和化妆品等领域具有广泛的应用价值,市场前景可观。目前,右旋糖酐酶法合成机理尚不明朗,生产技术有待改进。基因技术的发展使得右旋糖酐蔗糖酶的来源更加多样化,其催化产物的品质也趋于可控。在国际蔗糖价格不断攀升的情况下,寻求诸如葡萄糖等价格更低的底物用于右旋糖酐的生物合成是未来的研究方向。以基因改造为基础,利用葡萄糖生产DSase和右旋糖酐的技术在15年前已有报道[31-33],但和以蔗糖为底物的产物相比较,以葡萄糖为底物生产的右旋糖酐对右旋糖酐内切酶并不敏感,说明这一类型的右旋糖酐的性质与原来已被推广使用的右旋糖酐有一定的差异,因而开发能有效利用葡萄糖作为底物发酵右旋糖酐的新菌株成为亟待突破的技术点。
目前,大多数固定化材料都是海藻酸盐,也有固定化效果更优的材料如Eupergit C 250L、丙烯酰胺等,但是丙烯酰胺等是有毒化学材料,这大大降低了它的实际应用价值。因此,安全、稳定、高效的固定化材料的开发也是右旋糖酐生产的技术发展方向之一。
[1] Vuyst L De,Vaningelgem F.Developing new polysaccharides[M].Cambridge:Woodhead Publishing Ltd,2003:275-320.
[2] Welman Alan D,Maddox Ian S.Exopolysaccharides from lactic acid bacteria:perspectives and challenges[J].Trends in Biotechnology,2003,21(6):269-274.
[3] Monchois Vincent,Willemot René-Marc,Monsan Pierre.Glucansucrases:mechanism of action and structure-function relationships[J].FEMS Microbiology Reviews,1999,23(2):131-151.
[4] van Hijum S A,Kralj S,Ozimek L K,et al.Structurefunction relationships of glucansucrase and fructansucrase enzymes from lactic acid bacteria[J].Microbiology and Molecular Biology Reviews:MMBR,2006,70(1):157-176.
[5] Mori Toshiaki,Asakura Megumi,Okahata Yoshio.Single-Molecule Force Spectroscopy for Studying Kinetics of Enzymatic Dextran Elongations[J].Journal of the American Chemical Society,2011,133(15):5 701-5 703.
[6] Moulis C,Joucla G,Harrison D,et al.Understanding the Polymerization Mechanism of Glycoside-Hydrolase Family 70 Glucansucrases[J].Journal of Biological Chemistry,2006,281(42):31 254-31 267.
[7] Suwannarangsee Surisa,Moulis Claire,Potocki-Veronese Gabrielleet al.Search for a dextransucrase minimal motif involved in dextran binding[J].FEBS Letters,2007,581(24):4 675-4 680.
[8] Robyt John F,Yoon Seung-Heon,Mukerjea Rupendra.Dextransucrase and the mechanism for dextran biosynthesis[J].Carbohydrate Research,2008,343(18):3 039 -3 048.
[9] Kitaoka Motomitsu,Robyt John F.Large-scale preparation of highly purified dextransucrase from a high-producing constitutive mutant ofLeuconostoc mesenteroidesB-512FMC[J].Enzyme and Microbial Technology,1998,23(6):386-391.
[10] Purama Ravi Kiran,Goyal Arun.Identification,effective purification and functional characterization of dextransucrase fromLeuconostoc mesenteroidesNRRL B -640[J].Bioresource Technology,2008,99(9):3 635-3 642.
[11] Monchois Vincent,Remaud-Simeon Magali,Monsan Pierreet al.Cloning and sequencing of a gene coding for an extracellular dextransucrase(DSRB)fromLeuconostocmesenteroidesNRRL B-1299 synthesizing only a [alpha](1 - 6)glucan[J].Fems Microbiology Letters,1998,159(2):307-315.
[12] Ryu H J,Kim D,Kim D W,et al.Cloning of a dextransucrase gene(fmcmds)from a constitutive dextransucrase hyper-producingLeuconostoc mesenteroidesB-512FMCM developed using VUV[J].Biotechnology letters,2000,22(5):421-425.
[13] Neubauer H,Bauche A,Mollet B.Molecular characterization and expression analysis of the dextransucrase DsrD ofLeuconostoc mesenteroidesLcc4 in homologous and heterologousLactococcus lactiscultures[J].Microbiology,2003,149(4):973.
[14] Kang Hee Kyoung,Kim Young-Min,Kim Doman.Functional,Genetic, and Bioinformatic Characterization of Dextransucrase[J].Journal of Microbiology and Biotechnology,2008,18(6):1 050-1 058.
[15] 张洪斌,王雅洁,胡雪芹,等.一种表达右旋糖酐蔗糖酶基因工程菌及其构建方法和用途[P].中国,101363009A[P].2009-02-19.
[16] 张洪斌,朱春宝,胡又佳,等.右旋糖酐蔗糖酶工程菌株的构建及其培养条件的研究[J].微生物学报,2008,48(4):492-497.
[17] 农万廷,韦宇拓,黄日波,等.肠膜明串珠菌葡聚糖蔗糖酶基因的克隆与表达[J].工业微生物,2007,37(3):29-32.
[18] Yang Yalin,Luo Jin,Wang Jianhua,et al.Expression and characterization of dextransucrase genedsrX fromLeuconostoc mesenteroidesinEscherichia coli[J].Journal of Biotechnology,2008,133(4):505-512.
[19] Kubik Celina,Sikora Barbara,Bielecki Stanislaw.Immobilization of dextransucrase and its use with soluble dextranase for glucooligosaccharides synthesis[J].Enzyme and Microbial Technology,2004,34(6):555-560.
[20] de Segura Arantza Gómez,Alcalde Miguel,et al.López-Cortés Nieveset al.Modulating the Synthesis of Dextran with the Acceptor Reaction Using Native and Encapsulated Dextransucrases[J].Biotechnol,2004,42(4):337-342.
[21] Kitaoka Motomitsu,Robyt John F.Mechanism of the action ofLeuconostoc mesenteroidesB-512FMC dextransucrase:kinetics of the transfer of-glucose to maltose and the effects of enzyme and substrate concentrations[J].Carbohydrate Research,1999,320(3-4):183-191.
[22] Santos Mariana,Teixeira José,Rodrigues Alírio.Production of dextransucrase,dextran and fructose from sucrose usingLeuconostoc mesenteroidesNRRL B512(f)[J].Bio-chemical Engineering Journal,2000,4(3):177 -188.
[23] Kim Doman,Robyt John F,Lee So-Young,et al.Dextran molecular size and degree of branching as a function of sucrose concentration,pH,and temperature of reaction ofLeuconostocmesenteroidesB-512FMCM dextransucrase[J].Carbohydrate Research,2003,338(11):1 183-1 189.
[24] Falconer Daniel J,Mukerjea Rupendra,Robyt John F.Biosynthesis of dextrans with different molecular weights by selecting the concentration ofLeuconostoc mesenteroidesB-512FMC dextransucrase,the sucrose concentration,and the temperature[J].Carbohydrate Research,2011,346(2):280-284.
[25] de Segura Aránzazu Gómez,Alcalde Miguel,Yates Malcolm,et al.Immobilization of dextransucrase fromLeuconostocmesenteroidesNRRL B-512F on Eupergit C Supports[J].Biotechnology Progress,2004,20(5):1 414-1 420.
[26] Erhardt Frank Alwin,Jördening Hans-Joachim.Immobilization of dextranase fromChaetomium erraticum[J].Journal of Biotechnology,2007,131(4):440-447.
[27] Qader Shah Ali Ul,Aman Afsheen,Azhar Abid.Continuous production of dextran from immobilized cells ofLeu-conostoc mesenteroidesKIBGE HA1 using acrylamide as a support[J].Indian Journal of Microbiology,2011,51(3):279-282.
[28] 姚日生,董明辉,朱慧霞.酶法合成右旋糖酐相对分子质量的控制[J].精细化工,2007,24(10):964-967.
[29] 张洪斌,伊晓楠,吴定涛,等.海藻酸钠-琼脂混合固定化重组右旋糖酐蔗糖酶的研究[J].食品科学,2010,31(5):225-228.
[30] 蓝平,蓝丽红,董智芳,等.合成右旋糖酐菌体固定化研究[J].化学世界,2009(11):669-671.
[31] Kim Doman,Robyt John F.Properties ofLeuconostoc mesenteroidesB-512FMC constitutive dextransucrase[J].Enzyme and Microbial Technology,1994,16(12):1010-1015.
[32] Kim Doman,Robyt John F.Production and selection of mutants ofLeuconostoc mesenteroidesconstitutive for glucansucrases[J]. Enzyme and Microbial Technology,1994,16(8):659-664.
[33] Kim Doman,Robyt John F.Production,selection,and characteristics of mutants ofLeuconostoc mesenteroidesB-742 constitutive for dextransucrases[J].Enzyme and Microbial Technology,1995,17(8):689-695.
