西尼罗病毒NS1蛋白的原核表达及其免疫原性研究
2011-01-12王彦芳杨鹏飞张丽萍平芮巾刑福彬咸庆杰胡孔新
王彦芳 杨鹏飞 张丽萍 平芮巾 刑福彬 咸庆杰 胡孔新
(1.德州市中心血站 山东德州 253000;2.中国检验检疫科学研究院)
1 前言
西尼罗病毒 (West Nile Virus,WNV)属黄病毒科 (Flaviviridae)、黄病毒属 (Flavivirus),日本脑炎病毒血清型。该病毒是一种虫媒病毒,主要以尖音库蚊[1]传播为主,以鸟类为主要宿主,可引起人畜共患的自然疫源性疾病。西尼罗病表现为发热、头痛等流感样症状,也可表现为中枢神经系统感染症状,严重者可死亡,病死率为 5-14%[2-5]。WNV为单股正链 RNA病毒[6],基因组全长 10962bp[7],基因组 5′端为结构基因,约占基因组全长 1/4,其余为非结构蛋白基因。病毒基因组 RNA可以直接作为 mRNA,翻译 3种结构蛋白和 7种非结构蛋白,其排列顺序为C-pr M-E-NS1-NS2A-NS2B-NS3-NS4A-NS4B-NS5。其中的 NS1蛋白是一种非结构分泌型糖蛋白,在黄病毒蛋白中高度保守[8],它已经被证明是黄病毒感染动物体内的一种可以产生保护性抗体的有效免疫原[9-12],可诱导产生高滴度抗体,无论在疫苗研制还是诊断试剂的开发上均具有重要的意义[13,14]。本研究用原核表达系统表达出西尼罗病毒 WNV FJ151394.1株的 NS1蛋白,并对其免疫原性进行了初步研究。
2 材料与方法
2.1 材料
2.1.1 试验样品
原核表达载体 pET30a、宿主菌 DH5α、BL21(DE3)由中国检验检疫科学研究院卫生检疫研究所保存。
2.1.2 主要试剂
His-tag Monoclonal Antibody为美国 Novagen公司产品;HRP标记的山羊抗小鼠 IgG系中杉金桥公司产品;HRP标记的羊抗兔 IgG是美国 Sigma公司产品。
2.2 试验方法
2.2.1 重组质粒的构建
从 Genbank中检索获得WNV FJ151394.1株的NS1蛋白基因序列,于其 5’引入 agatctgatg,3’引入caccatcatcatcatcattaataggaattc,送至擎科公司合成。合成的基因全序列经限制性内切酶 BglⅡ和 BamHⅠ酶切后与 pET30a连接,得到重组质粒 pET30a-WNV-NS1。
2.2.2 质粒转化和诱导表达
2.2.2.1 质粒转化
重组质粒转入大肠杆菌 DH5α,小量制备质粒后进行测序鉴定(测序工作由华大基因公司完成),将鉴定结果与WNV FJ151394.1株的 NS1蛋白基因序列进行比对,未发现突变。将鉴定正确的质粒转化入 BL21(DE3)菌株,于 -80℃保存菌种。
2.2.2.2 诱导表达
将含重组质粒的工程菌挑单菌落,接种于含卡那霉素 30μg/mL的 LB培养基,37℃摇床过夜培养。取上述培养液按 1:50比例接种新鲜的 LB培养液,37℃培养 2h,测 OD600为 0.579,再加入 IPTG至终浓度为 1mM开始诱导 ,37℃培养 3h、4h、5h、6h,分别收获菌液。
2.2.3 蛋白表达鉴定
不同诱导时间的 pET30a-WNV-NS1质粒菌液及诱导 6h后含有 pET30a空质粒菌液各取 1mL,12000rpm 4℃离心 10min。于离心收集的菌体中加入 20μL去离子水,重悬沉淀,加入 20μL 2×SDS加样缓冲液裂解后进行 SDS-PAGE和Western-Blot分析,Western-Blot一抗使用 1:250稀释的 Histag Monoclonal Antibody,二抗使用 1:500稀释的HRP标记的山羊抗小鼠 IgG,使用 DAB避光显色。
2.2.4 表达产物的纯化
根据小量诱导条件,诱导 1L菌液。8000rpm离心 20min,收获菌体,超声裂解,离心后用 8mol/L尿素溶解沉淀,溶解上清过 HisTrapT MHP亲和层析柱,采用不同浓度咪唑洗脱,收集有洗脱峰的洗脱液。将洗脱液进行脱盐处理后,过 HiTrapT MDEAE FF弱阴离子交换柱,采用不同盐离子浓度洗脱,收集有洗脱峰的洗脱液。洗脱液进一步在含尿素为 4 M、3 M、2 M、1 M、0.5M的透析缓冲液中透析复性,最后透析在 PBS中。
2.2.5 重组蛋白多克隆抗体的制备
多抗制备工作由京天成生物技术 (北京)有限公司完成。
2.2.6 EL ISA检测纯化后蛋白抗原性
以重组 WNV NS1蛋白包被 96孔板,1μg/孔,一抗为经 PBS系列稀释的兔免疫血清,以 HRP酶标的羊抗兔 IgG为二抗,测 A450值。结果判定方法:被检血清 OD值与同板阴性对照 OD值之比 >2,且被检血清 OD值大于 0.2者,判为阳性[15,16]。
2.2.7 重组抗原检测阳性血清
以重组WNV NS1蛋白包被 96孔板,100ng/孔,以 1:10稀释的免疫兔血清做阳性对照,检测 FOCUS公司WNV IgG EL ISA试剂盒的阴性血清和阳性血清。
3 结果
3.1 WNV NS1蛋白的原核诱导表达及条件优化
将鉴定好的重组 pET30a-WNV-NS1质粒转化入 BL21菌 ,经 IPTG诱导 3h、4h、5h、6h后 ,分别收获菌液,裂解后进行 SDS-PAGE分析,NS1蛋白预期分子量为 45KD,分析结果表明 3h、4h、5h、6h均有目的蛋白表达,且在诱导 5h表达量最大,诱导时间 6h与诱导时间 5h相比,未有明显变化,见图 1。因此,将 5h定为最佳诱导时间。

图 1 WNV NS1蛋白在大肠杆菌的表达
3.2 表达的鉴定:Western-blot检测WNV NS1
经诱导表达的蛋白经Western-blot分析发现,有一条带可与 His-tag Monoclonal Antibody反应,形成明显的反应条带,而 pET30a菌对照则无明显特异带出现,见图 2。因为在载体构建时,在目的基因末端加入了 His标签,使得诱导表达的蛋白中应该含有 His标签,而在Western-blot过程中,一抗使用的是 His-tagMonoclonalAntibody,这种抗体可以与带有 His标签的蛋白反应。因此,可以认为,与His-tagMonoclonalAntibody反应,产生的明显条带应该就是目的蛋白WNV NS1的条带。

图 2 表达的 WNV NS1蛋白的 Western-blot分析
3.3 原核表达的WNV NS1蛋白的纯化
将大量诱导表达的 pET30a-WNV-NS1工程菌,经包涵体洗脱后,以 His-Binding层析纯化后继以脱盐实验和阴离子交换层析 (WNV NS1蛋白等电点约为 8.9),结果见图 3。
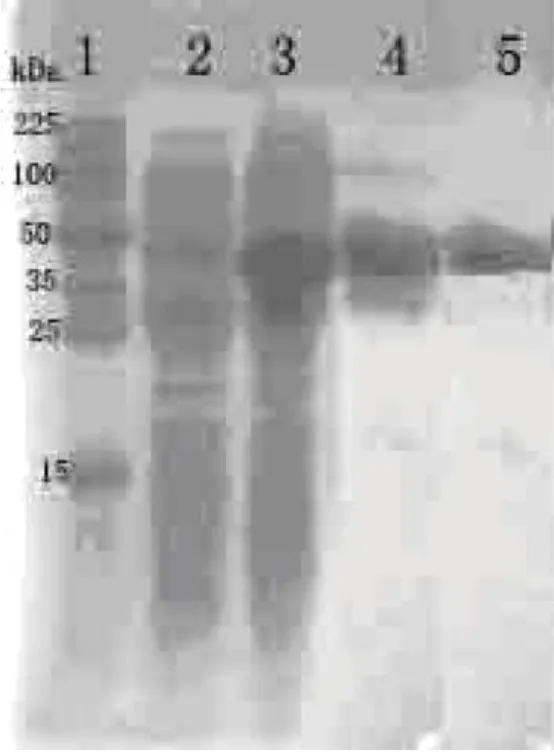
图 3 蛋白纯化结果
3.4 重组蛋白免疫血清的鉴定
包被 WNV NS1重组抗原,1μg/孔,一抗使用不同稀释度的免疫血清,二抗使用 HRP标记的羊抗兔IgG,经 T MB显色 20min后,用 2M H2SO4终止染色,在波长为 450nm下测量各孔 OD值。
根据判定标准,标本 (S)和阴性对照 (N)的值之比,即 S/N>2时判为阳性[15,16],在这种半定量测定中,将待测血清做一系列稀释后进行试验,呈阳性反应的最高稀释度即为滴度。本实验中每个稀释梯度的检测结果见表 1。从表 1中可以看出,将待测血清 1:50000稀释,在 450nm波长下测得的OD值为 0.440,阴性对照为 0.205,S/N>2,因此认为 1:50000稀释后的待测血清检测结果可以定为阳性,而将待测血清 1:100000稀释后,在 450nm波长下测得的OD值为 0.294,S/N<2,1:50000稀释后的待测血清检测结果可以定为阴性。综上,可以认为,免疫血清的效价为 1:50000。

表 1 检测免疫血清效价的 EL ISA结果
3.5 重组抗原检测阳性血清结果
以重组WNV NS1蛋白包被 96孔板,100ng/孔,检测 FOCUS公司WNV IgG EL ISA试剂盒的阴性血清和阳性血清。阴阳性血清均是 1:1000稀释,测得OD450吸光值分别为:阴性血清 0.39,阳性血清 0.834,P/N为 2.14,结果判为阳性,即以重组蛋白 WNV NS1做为抗原,将待测血清 1:1000稀释,可以检测出WNV感染的阳性血清。
4 讨论
正是因为黄病毒科 NS1蛋白可以刺激动物机体产生保护性抗体[9-12],所以近几年,国内外学者根据NS1蛋白的抗原性,建立了检测黄病毒感染的免疫学检测方法,如 Eiji Konishi等[17-18]学者于2002年和 2004年均以纯化的日本脑炎病毒 NS1蛋白为基础,分别建立了检测日本脑炎病毒感染的免疫染色法和间接 EL ISA法。基于此,笔者认为,同样属于黄病毒科的西尼罗病毒的 NS1蛋白也可以作为有效的抗原,用于对西尼罗病毒检测的诊断试剂的研究。
因为大肠杆菌表达系统的优点是成本较低,可以在短时间内产生大量蛋白,因此本实验采用大肠杆菌 pET表达系统。pET系统是在大肠杆菌中克隆和表达重组蛋白的最强大系统,pET载体中,目的基因受噬菌体 T7强转录和翻译信号控制,并受宿主细胞提供的 T7 RNA聚合酶诱导表达,得到充分诱导后可以高水平表达目的蛋白。但是即使在没有 IPTG等诱导剂存在的情况下,也会有 lacUV5启动子表达的 T7 RNA聚合酶,从而存在目的蛋白的本底表达。所以本实验在做蛋白电泳检测目的蛋白表达情况时使用的阴性对照是诱导后的 pET30a空质粒菌液,而没有使用加入 IPTG诱导前重组质粒菌液。
大肠杆菌表达系统也存在不易克服的缺点:如有些基因的持续表达可能会对宿主细胞产生毒害作用,在一定时间内,目的蛋白的产量与诱导时间成正相关,但较长的时间由于这种细胞毒作用,反而会使目的蛋白的产量下降。为使目的蛋白的产量达到最大,本实验在小量诱导表达时优化诱导时间,结果证明在 5h内,蛋白产量与诱导时间呈正比,第 5h与第 6h产量几乎无差别,故将 5h做为最佳诱导时间。
His标签是常用的纯化蛋白的融合标签,特别是那些以包涵体形式表达的蛋白,它可以将蛋白在完全变性的条件下溶解,继而进行亲和纯化。为了使获得的蛋白溶液纯度更高,本实验在亲和层析后进行了离子交换层析,获得了纯度相对较高的目的蛋白溶液。
本实验采用大肠杆菌原核表达系统对 WNV NS1蛋白进行表达,经 western blot检测证明获得了带有 His标签的WNV NS1蛋白,通过对表达产物进行亲和层析和阴离子交换层析获得了较纯的目的蛋白,用蛋白免疫的兔血清经间接 EL ISA检测证实了获得的 NS1蛋白具有免疫原性,可以用于 WNV感染血清的检测。
目前我国境内虽然尚未有西尼罗病毒感染病例的报道,但是随着候鸟的迁徙,国际交流的日益频繁,WNV的入境机会可能会大大增加,因此我们应该未雨绸缪,为WNV的传入与出现进行必要的技术储备,WNV NS1蛋白的成功表达为进一步研制诊断试剂以及深入研究 NS1蛋白的结构功能等奠定了基础。
[1] 魏荣,王志亮,李其平.在中国可以传播西尼罗河病毒的蚊虫种类[J].中国媒介生物学及控制杂志,2004,15(1):65-66.
[2] Tasi TF,Popovici F,CernescuC,et al.WestNile encephalitis in southeasten Romania[J].Lancet,1998,352:767-771.
[3] PlatonovA E,ShiPulin G A,Shipulina A Y,et al.Outbreak of westNile virus infection,Volgogradregion,Russia,1999[J].Emerg InfectDis,2001,7:128-132.
[4] Nash D,Mostashari F,Fine A,et al.The outbreak of West Nile virus infection in the New York city areas in 1999[J].N Engl J Med,2001,344:1807-1814.
[5] Chowers M Y,Lang R,Nassar F,et al.Clinical characteristics of the west Nile fever outbreak,Israel,2000[J].Emerg Infect Dis.2001,7:675-678.
[6] BrintonM A.The molecular biology of West Nile Virus:a new invader of the western hemisphere[J].Annu Rev Microbiol,2002,56:371-402.
[7] West Nile virus,complete genome.Available at http://www.ncbi.nlm.nih.gov/genomes/f ramik.cgi?db=genome&gi=10411.
[8] Shu P Y,Chen L K,Chang S F,et al.Dengue Virus Serotyping Based on Envelope and Membrane and Nonstructural Protein NS1 Serotype-Specific Capture I mmunoglobulin M Enzyme-Linked Immunosorbent Assays[J].Microbiol,2004,42:2489-2494.
[9] Schlesinger J J,Brandriss M W,Cropp C B,et al.Protection against yellow fever in monkeys by immunization with yellow fever virus nonstructural protein NS1[J].Virol,1985,50:1153-1155.
[10] Schlesinger J J,Brandriss M W,Walsh E E.Protection of mice against dengue 2 virus encephaliitis by immunization with the dengue 2 virus non-structural glycoprotein NS1[J].Gen Virol,1987,68:853-857.
[11] Gonld EA,A Buckley,A D T Barrett,et al.Neutralizing(54k)and nonneutralizing(54 and 48k)monoclonal antibodies against structural and nonstructural yellow fever virus protein sconfer immunity in mice[J].Gen Virol,1986,67:591-595.
[12] Schlesinger,J J M Foltzer,S Chapman.The Fc portion of antibody to yellow fever virus NS1 is a determinant of protection against YF encephalitis in mice[J].Virology,1993,192:132-141.
[13] SM Costa,M S Freire,A M B Alves.DNA vaccine against the non-structural 1 protein(NS1)of dengue 2 virus[J].Science-Direct,2006,Vaccine 24:4562-4564.
[14] MichaelM Lieberman,David E Clements,Steven Ogata,et al.Preparation and immunogenic properties of a recombinant West Nile subunit vaccine[J].Science Direct,2007,Vaccine 25:414-423.
[15] 徐春厚,孙力,于春生,等.用 PPA-EL ISA检测鸡痘病毒抗体的研究[J].中国畜禽传染病,1997,6:33-35.
[16] 王雪鹏,李建亮,常维山,等.用间接 EL ISA检测鸡痘病毒抗体的研究[J].中国兽医科技,2003,11:8-11.
[17] Konishi E,Suzuki T.Ratios of subclinical to clinical Japanese encephalitis(JE)virus infections in vaccinated populations:evaluation of an inactivated JE vaccine by comparing the ratios with those in unvaccinated populations[J].Vaccine,2002,21:98-107.
[18] Konishi E,Shoda M,Ajiro N,et al.Development and evaluation of an enzyme-liked immunosorbent assay for quantifying antibodies to Japanese encephalitis virus nonstructural 1 protein to detect subclinical infections in vaccinated horses[J].ClinMicrobial,2004,42:5087-5093.
