柱前衍生化RP-HPLC法检测聚明胶肽注射液中交联剂残留量
2011-01-12徐晓燕杭太俊张丝韵
徐晓燕, 杭太俊 , 张丝韵, 丁 莹
(中国药科大学药物分析学教研室,江苏南京 210009)
聚明胶肽注射液为健康牛骨或猪骨明胶水解制成的灭菌水溶液,制备过程中使用的交联剂是六亚甲基二异氰酸酯 (1,6-hexam ethylene diisocyanate,HD I),而残留交联剂遇水极易反应生成 1,6-己二胺和二氧化碳[1]。1,6-己二胺毒性较大,其经口给予大鼠的 LD50为 750m g·kg-1,经皮给予兔的LD50为1 110m g·kg-1,而其致人慢性中毒,主要损及血液、肺及肝肾[2]。因此,应严格控制聚明胶肽注射液中交联剂残留量,保证用药安全。
国内外文献中对 HD I的含量测定,主要是通过 HD I与衍生化试剂 1-(2-吡啶)哌嗪[1-(2-Pyridyl)p iperation,2PP]反应生成 HD I-2PP脲类化合物的方法进行[1,3]。鉴于聚明胶肽注射液生产过程中残留 HD I已水解为 1,6-己二胺,本文建立了测定聚明胶肽注射液中 1,6-己二胺含量的丹酰氯柱前衍生化 RP-HPLC法,用于控制注射液中交联剂残留量。
仪器与试药
Shim adzu LC-10AD vp高效液相色谱系统,RF-10AXL荧光检测器 (日本岛津公司);HS2000色谱工作站 (杭州英谱科技公司)。
聚明胶肽注射液 (批号:071101、071102、071103、070604、070605、070606)及聚明胶肽降解液,均由浙江康乐药业有限公司提供;HD I(纯度≥99%,Sigm a-A ldrich公司),1,6-己二胺 (含量 ≥99.0%,上海凌峰化学试剂有限公司),丹酰氯(含量≥99.0%,Sigm a-A ldrich公司);甲醇为色谱纯,实验用水为纯化水,其他试剂均为分析纯。
方法与结果
2.1 色谱条件
色谱柱:Phenom enex Luna C18(250 mm ×4.6mm,5m),流动相:甲醇-水-醋酸铵-醋酸(75∶25∶0.2∶0.2),检测器:荧光检测器 (激发波长: 340 nm,发射波长:515 nm),流速:1.0 m L·m in-1,柱温:30℃,进样量:20μL。
2.2 溶液的制备
1 ,6-己二胺储备液的制备:取 1,6-己二胺约25m g,精密称定,置 5mL量瓶中,用水溶解并稀释定容,摇匀,即得质量浓度为 5 g·L-1的 1,6-己二胺储备液,用于制备标准溶液。
供试品溶液的制备:精密量取聚明胶肽注射液或 1,6-己二胺标准溶液 0.1mL,加入碳酸氢钠缓冲溶液(1mo l·L-1,用氢氧化钠调 pH 9.8)0.1 m L和丹酰氯乙腈溶液(20m g·mL-1)0.4mL,混合均匀,于 60℃水浴中放置 15分钟,再在沸水浴中放置15分钟,加入 40μL冰醋酸,终止反应,加流动相稀释至1mL,即得。
2.3 系统适应性试验
分别取空白试剂 (水)、聚明胶肽注射液样品、聚明胶肽降解液 (未加交联剂)和聚明胶肽降解液+1,6-己二胺标准溶液,按“供试品溶液的制备”方法衍生化处理,进样,记录色谱图 (见图1)。由图1可见,双丹酰化 1,6-己二胺峰保留时间约为 17m in,制剂中其他成分无干扰,理论塔板数 (以 1,6-己二胺峰计算)不低于 3 000。
2.4 线性范围考察
精密量取 1,6-己二胺储备液若干份,用水稀释,制成质量浓度分别约为 0.05,0.10,0.20, 0.50,1.0,2.0,5.0,10.0 m g·L-1的系列标准溶液,再按“2.2”中“供试品溶液的制备”项下方法衍生化处理,进样,记录色谱图。以双丹酰化 1,6-己二胺峰面积(A)对质量浓度 (C,m g·L-1)进行权重(1/C2)线性回归,得回归方程:A=8.174×105C-1.144×104,r=0.998 8。结果表明,1,6-己二胺在0.054~10.8m g·L-1范围内的质量浓度与其双丹酰化衍生物峰面积的线性关系良好,检测限约为20μg·L-1(S/N=4)。
2.5 重复性试验
取同一批号的聚明胶肽注射液 (批号:070606) 6份,按“2.2”中“供试品溶液的制备”项下方法衍生化处理,进样,记录色谱图。结果,测得双丹酰化1,6-己二胺峰面积的RSD为 13.7%,满足微量杂质限度检查的精密度要求。
2.6 加样回收率试验
取同一批号的聚明胶肽注射液 (批号 070606) 0.1mL,共 6份,分别加入质量浓度为 2.16m g·L-1的1,6-己二胺标准液0.1mL,按“2.2”中“供试品溶液的制备”项下方法衍生化处理,进样,记录色谱图。结果,测得平均回收率为 96.79%,RSD为13.6%(n=6)。
2.7 样品测定
取各批号聚明胶肽注射液,按“2.2”中“供试品溶液的制备”项下方法衍生化处理,进样,记录色谱图。结果,测得各批号聚明胶肽注射液中 1,6-己二胺含量均小于 5m g·L-1(见表1)。
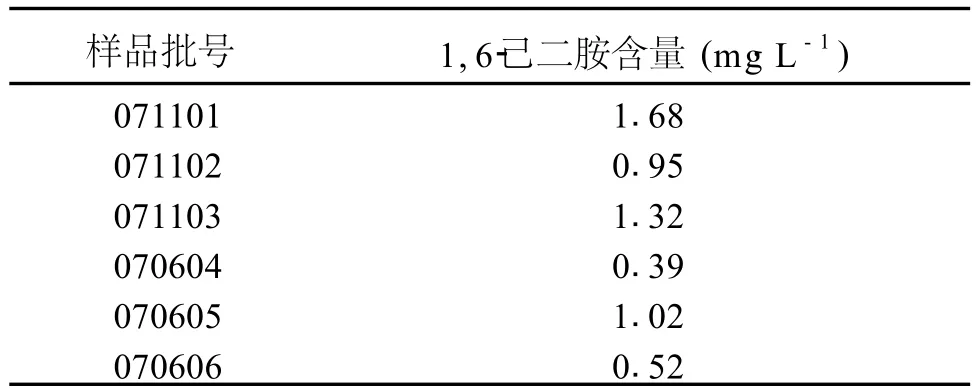
表1 样品测定结果Tab le 1 Determ ining resultof the samp les
讨论
3.1 交联剂水解产物及注射液中有关物质验证
分别取 HD I的水解溶液及注射液 20μL进行LC-ESI+-M S分析,结果,均得到质荷比(m/z)为 117的母离子以及 100与 55的碎片离子。表明,HD I水解产物为 1,6-己二胺,聚明胶肽注射液中含有关物质 1,6-己二胺,其裂解过程见图2。
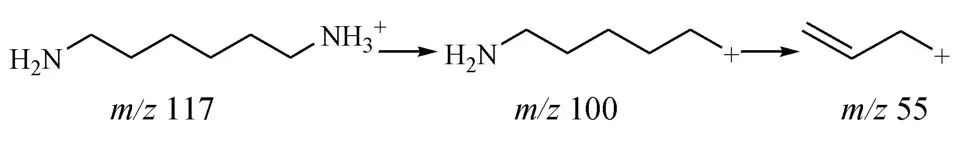
图2 1,6-己二胺的 ESI+-M S裂解过程Figure 2 Pyro lysisof 1,6-hexanediam ine by ESI+-M S
3.2 1,6-己二胺含量测定方法的选择
笔者曾尝试先采用三氯甲烷液液萃取、水蒸气蒸馏、固相萃取、甲醇沉淀等多种方法对聚明胶肽注射液中 1,6-己二胺进行预分离处理,再做衍生化处理,结果,色谱分析显示,基体干扰减少,但回收率较低。同时,根据 1,6-己二胺的理化性质,也尝试了多种分析方法,如LC-M S/M S、柱前衍生化RP-HPLC法等,结果发现,样品经甲醇沉淀后,再用 LC-M S/ M S分析,方法虽然专属性好、灵敏,但仪器要求较高,不宜用于常规测定;而丹酰氯是胺类化合物的常用衍生化试剂[4-5],用其对样品进行柱前衍生化 RPHPLC分析,则无须进行样品前处理,且灵敏度高,准确性好,专属性强,适用于聚明胶肽注射液中1,6-己二胺的含量测定。
根据多批号聚明胶肽注射液中 1,6-己二胺含量的测定结果,初步确定聚明胶肽注射液中残留1,6-己二胺的限量为 5.0μg·m L-1。聚明胶肽注射液组成复杂,且残留交联剂水解产物 1,6-己二胺的含量较少,为了准确而简便地对样品中己二胺残留量进行限度检查,并消除基体效应的影响,减小分析误差,可简化标准曲线法,而采用单点标准加入法检测[6]:精密量取聚明胶肽注射液 0.1 m L,加入5.0m g·L-1的 1,6-己二胺标准溶液 0.1 m L,摇匀,按“供试品溶液的制备”方法进行衍生化处理,进样,记录双丹酰化 1,6-己二胺峰面积 (a);另精密量取聚明胶肽注射液 0.1m L,加入水 0.1m L,摇匀,同法衍生化处理,进样,记录双丹酰化 1,6-己二胺峰面积(b)。若 b小于 (a-b),则表明聚明胶肽注射液中 1,6-己二胺的含量小于 5.0 m g·L-1,反之亦然。
3.3 衍生化反应时间的选择
取 2m g·L-1的 1,6-己二胺标准溶液若干份,按“供试品溶液的制备”方法处理,其中衍生化反应时间分别为 15~240m in,反应结束后进样,记录色谱图。结果发现,1,6-己二胺在 60℃水浴中反应 15分钟后,其衍生物响应值即达稳态。因此,确定衍生化反应时间为 15m in。
3.4 衍生化试剂用量的选择
取 2m g·L-1的 1,6-己二胺水溶液若干份,按“供试品溶液的制备”方法处理,其中衍生化试剂丹酰氯乙腈溶液加入量分别为 0.05~0.6mL,待反应完成后,进样,记录色谱图。结果发现,0.4m L衍生化试剂即可使本试验中浓度范围的 1,6-己二胺完全衍生化。故衍生化试剂加入量选择为 0.4mL。
[1] Salthammer T,W ismach C,M iertzsH.Absorp tion and fluorescence of 1-(2-pyridyl)-p iperazine and four diisocyanate derivatives in so lution[J].J Photochem Photobio l A Chem,1997,107(1/3):159-164.
[2] M aterial Safety Data Sheet,1,6-hexanediam ine M SDS: Section 11:Toxico logical Information[EB/OL].[2010-01-12].http://www.sciencelab.com/xM SDS-1_6_hexaned iam ine-9924250.
[3] 于亚云,袁园,张莉,等.柱前衍生化 RP-HPLC法测定六亚甲基二异氰酸酯 [J].药物分析杂志,2009,29 (7):1159-1162.
[4] M inocha R,Long S.Sim u ltaneous separation and quantitation of am ino acids and po lyam ines of forest tree tissues and cell culturesw ithin a single high-perform ance liquid chrom atography run using dansyl derivatization[J].J Chrom a togrA,2004,1035(1):63-73.
[5] Yam ada H,Yam ahara A,Yasuda S,et a l.Dansyl ch loride derivatization ofm ethamphetam ine:am ethod w ith advantages for screening and analysis ofm ethamphetam ine in urine[J].JAna l Toxico l,2002,26(1):17-22.
[6] Danzer K,Currie L.Guidelines for calibration in analytical chem istry[J].Pure Appl Chem,1998,70(4):993-1014.
