多糖及其衍生物在药物传递系统中的应用研究新进展
2011-01-12张文婕
张文婕, 范 颖
(1.中国药科大学新药研究中心,江苏南京210009;2.上海医药工业研究院上海呼吸系统药物工程技术研究中心,上海200437)
多糖是具有特定结构的一类天然生物材料,可作为药物载体或组织工程支架用于递送小分子化学药物、多肽或蛋白药物,提取和纯化方法的发展加速了其作为药物载体的应用。
根据临床要求不同,多糖可以胶束、微粒或凝胶的形式递送药物。多糖-药物缀合物已得到广泛应用,其胶束形式可提高载体靶向性及生物降解性。载药多糖凝胶可形成连续网状结构的高度水化材料,模拟天然组织的机械和化学特性,用于药物控释或软组织再生。
用于药物传递系统的多糖来源于非哺乳动物或哺乳动物。来源于非哺乳动物的多糖包括海藻酸盐(alginate)、几丁质(chitin)、葡聚糖(dextran)等,其提取和纯化方法相对简单,价格便宜,免疫原性低,在递送药物时可通过非共价交联方式(静电结合)或共价修饰方式与药物结合或连接不同的功能基团。来源于哺乳动物的多糖包括透明质酸(hyaluronan)、肝素(heparin)和硫酸软骨素(chondroitin sulfate)等,同样可通过共价或非共价方式与药物连接,虽然其分离提纯过程相对复杂,但由于可与体内多种蛋白特异性结合,其用作药物载体具独特优势。
1 海藻酸盐
海藻酸盐是从褐藻(如昆布)或土壤细菌(如褐色定氮菌)中提取的一种可生物降解的亲水性多糖,由β-D-甘露醛酸和α-L-古罗糖醛酸线性聚合而成。根据来源和加工过程的不同,可得到不同相对分子质量(104~106)的海藻酸盐。
海藻酸盐的一个重要特点就是可通过与二价阳离子(如钙离子、钡离子和锶离子等)连接使分子链中古罗糖醛酸间形成蛋壳结构,且根据阳离子浓度的不同,致分子链间形成瞬时或永久的结合。早在20世纪40年代,海藻酸钙微球就被用作药物传递载体,且研究表明:阳离子浓度及海藻酸钙相对分子质量、胶凝动力学等因素会影响微球的孔径、溶胀、稳定性及机械强度等性质。海藻酸盐微球制备简单,但存在机械稳定性差、突释现象等问题,为克服这些缺陷,研究者们通过将高分子修饰材料包覆于海藻酸盐微球外层而制备出包衣型微球,或使高分子材料与海藻酸盐相互渗透或交联形成聚合物网络而制备嵌入型凝胶(见表1)。
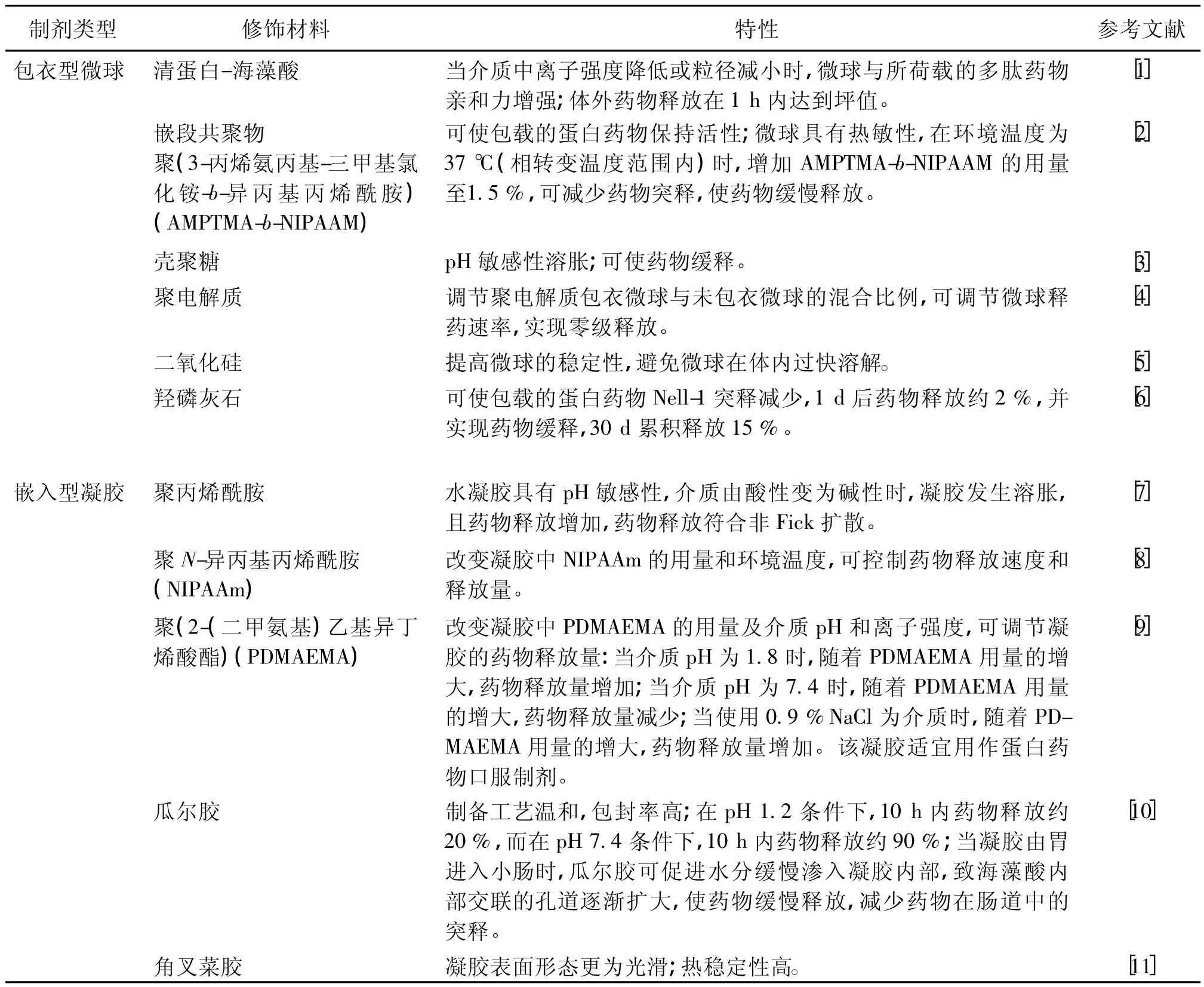
表1 用作药物载体的包衣型海藻酸盐微球和嵌入型海藻酸盐凝胶的特性Table1 Characteristics of coated alginatemicrosphere and interpenetrated alginate gel as drug carriers
海藻酸盐微球具有pH敏感性,在低pH条件下(如在胃中),可收缩形成不可溶性微球,阻滞药物释放;而在较高pH条件下(如在肠道中),则可转化为可溶性微球,药物可通过微球内部孔径为5~200 nm的微孔以及微球溶蚀作用而释放。因此,海藻酸盐微球尤为适宜用作蛋白药物的口服制剂,既可避免蛋白药物在胃中降解,又可保证药物在肠道中释放。但由于海藻酸盐在肠道中易溶解,导致其微球中药物突释,使蛋白药物失去保护而在蛋白水解酶作用下变性,故需改进海藻酸盐微球的理化性质,以实现对蛋白药物的缓释和控释。Yu等[12]使用海藻酸盐、壳聚糖和果胶制备复合微粒,其中壳聚糖在低pH条件下可溶,在高pH条件下不可溶,这正好与海藻酸盐的性质相反,从而使微粒中蛋白药物在pH为1.2和5.0时达到缓释,在pH为7.4和6.8时则迅速释放,同时果胶又可抵御蛋白酶和淀粉酶的作用,避免蛋白药物变性,因此,该复合微粒可实现口服蛋白药物的结肠靶向递送。
研究表明:带有电荷的高分子材料可粘附于黏膜,增加其电荷密度可提高其黏膜黏附性。而海藻酸盐是带有羧基的阴离子高分子,为良好的黏膜黏附剂,其黏附性优于聚苯乙烯、羧甲基纤维素、聚乳酸和壳聚糖等其他高分子材料(Ch'ng等,J Pharma Sci,1985年),且经修饰后可提高生物黏附性。Alsberg等[13]将黏附性配体精氨酸-甘氨酸-天冬氨酸(RGD)肽通过共价键与海藻酸凝胶连接,以增强后者对前成骨细胞MC3T3-E1的黏附作用,从而促进该细胞的增殖、分化,进而实现骨修复。结果表明:当每cm2凝胶表面含有配体量为1.5×10-15~15×10-15mol时,可明显提高凝胶对成骨细胞的黏附性。
2 几丁质
几丁质是来源于节肢动物和昆虫外壳的一种疏水性多糖,由β-N-乙酰-D-氨基葡萄糖线性聚合而成。几丁质的N-脱乙酰衍生物即壳聚糖,由N-乙酰-D-氨基葡萄糖和D-氨基葡萄糖共聚而成。几丁质不溶于水,但壳聚糖可在酸性条件下溶解,且具有可供化学修饰的活性基团。此外,壳聚糖可生物降解,生物相容性好,价格便宜,易获得,可进行结构修饰,故在药物传递系统中得到广泛应用(见表2)。

表2 几丁质衍生物载体类型Table2 Types of chitin derivative carriers
由于壳聚糖仅可溶于酸性溶液,故其应用受到限制。由此,研究者们对其进行结构改造,以期能提高其水溶性或使其载体具有温度敏感性、pH敏感性或离子敏感性等特性。例如,笔者所在课题组合成了两亲性N-烷基-N-三甲基壳聚糖[14]、两亲性N-辛基-O-磺酰基壳聚糖[15]、长循环聚乙二醇-N-辛基-O-磺酰基壳聚糖[16]、温度敏感型聚N-异丙基丙烯酰胺-壳聚糖[17]和pH敏感型N-辛基-N-(2-羧苯甲酰)-壳聚糖[18]等新型壳聚糖衍生物,拓展了壳聚糖在药物传递系统中的应用。此外,Kim等[19]以抗肿瘤活性物质鞣花酸为模型药物,将鞣花酸溶液与壳聚糖溶液于40℃混合2 h,调节混合溶液pH至 6.9~7.2,然后在4℃下与β-甘油磷酸酯溶液混合,并于37℃胶凝,此含药凝胶具有缓释作用,累积释药量与凝胶载药量呈正相关,且体外试验显示:荷载1%鞣花酸的凝胶可明显抑制人U87恶性胶质瘤和鼠C6神经胶质瘤生长。Ranjha等[20]通过自由基聚合反应使壳聚糖与丙烯酸交联形成干胶,该干胶在低pH介质中几乎不溶胀,而在高pH (pH为6.5或7.5)介质中可快速溶胀,且体外药物释放实验表明:随着介质pH的升高,干胶可不断摄取水分并溶胀,致使药物释放增加。
近年来,随着电纺技术(electrospinning)的发展,几丁质和壳聚糖纳米纤维被广泛应用于组织工程支架、药物传递系统、伤口敷料和传感器中[21]。电纺技术可通过对高压产生的带电高分子液滴进行干燥而获得从十几纳米到几微米不等的纳米纤维(见表3)。几丁质溶解性差,只可溶于特定的溶剂中,如N,N-二甲乙酰胺(DMAC)-LiCl、六氟丙酮、1,1,1,3,3,3-六氟-2-正丙醇(HFIP)和饱和钙溶液等,因此,在电纺前,可通过γ辐射解聚几丁质来增加其溶解性。壳聚糖在溶于酸性溶液时带有正电荷,此高分子电解质溶液不能经电纺稳定地形成纳米纤维,而研究发现,使用三氟乙酸或三氟乙酸/二氯甲烷,可提高壳聚糖电纺纤维的均一性。

表3 电纺几丁质和壳聚糖纳米纤维类型Table3 Types of electrospun nanofibers of chitin and chitosan
电纺纳米纤维具有表面积大、孔隙度高、生物相容性好的特点,将其用于药物传递系统,可实现药物尤其是促细胞再生性药物的控释。如Jeong等[22]将壳聚糖和海藻酸盐溶液混合,并经电纺,通过离子相互作用而获得纳米纤维,该纳米纤维由于未使用交联剂而降低了毒性,同时由于使用了壳聚糖而增加了对血清蛋白的黏附性,因而更适宜用作组织工程支架材料。
3 葡聚糖
葡聚糖是从细菌(如白念珠菌)代谢产物中提取的一种水溶性多糖,由D-葡萄糖以1→6键连接,并在支链点1→2、1→3和1→4处连接配糖而组成。根据来源不同,可得到平均相对分子质量不同的各种支链葡聚糖。最初,葡聚糖被用作血浆替代品,由于其具有生物可降解、非特异性细胞黏附、抵御蛋白吸附、价格便宜及易于结构改造等特点,成为药物载体材料研究的热点。
将不同的功能基团连接在葡聚糖上,可得到原位凝胶或温度敏感、pH敏感等不同类型的水凝胶(见表4)。迄今,研究者们已制备出以葡聚糖衍生物凝胶为载体的吲哚美辛、牛血清蛋白、免疫球蛋白G及溶菌酶等各类药物的控释制剂。
Sun等[23]利用二硫键将葡聚糖和聚己内酯连接而制得粒径约60 nm的对还原性环境敏感的载药嵌段共聚物胶束。结果显示:其在非还原性环境中于20 h内仅释药20%,而在还原性环境中于10 h内可持续并完全释药。葡聚糖还被广泛用于前药和纳米给药系统的制备。如Varshosaz等[24]将布地奈德通过戊二酸连接于不同相对分子质量的葡聚糖上制成前药,结果表明:使用相对分子质量为10 000和70 000的葡聚糖制得的前药不但可使布地奈德溶解度提高,还可用于结肠靶向释药,治疗溃疡性结肠炎。
4 透明质酸
透明质酸是由(1→4)-β-D-葡醛酸和(1→3)-β-N-乙酰-D-葡糖胺组成的线性水溶性多糖,骨架中的羟基和羧基均可被化学修饰。透明质酸最初在牛眼玻璃体中被发现,随后的研究表明其广泛存在于生物体内,尤其是细胞外基质和关节液中。虽然透明质酸可从活体中提取,但为避免污染和病毒感染,人们主要从微生物发酵物中获取该物质。
透明质酸具有生物可降解、生物相容、低毒、非免疫原性、无致炎性等特点,因此被广泛用于药物传递系统。Homma等[25]通过肽段将甲氨蝶呤连接于透明质酸而制成前药,该前药中肽段被酶降解后释放出具有止痛作用的透明质酸和具有抗炎作用的甲氨蝶呤,从而对骨关节炎发挥协同治疗作用;试验表明:该前药在体外可抑制人成纤维细胞样滑膜细胞的增殖,在大鼠关节炎模型中可减轻关节肿胀。
此外,为了使透明质酸制备的药物传递系统更具靶向性和长效作用,研究者们通过多种化学修饰方法制备透明质酸衍生物,其羧基是常见的修饰部位(见表5)。但值得注意的是,透明质酸的羧基是透明质酸酶的识别位点,因此,羧基部位的修饰可能改变透明质酸衍生物的体内降解行为。
透明质酸的相对分子质量从103到107不等,不同相对分子质量的透明质酸在体内具有不同功能:高相对分子质量的透明质酸主要存在于疏松结缔组织中,以维持细胞外基质中的水分含量和细胞完整性;而低相对分子质量的透明质酸在受体介导的细胞信号通路中发挥作用。CD44(cluster determinant44)、RHAMM(receptor for hyaluronate-mediated motility)、HARE(hyaluronan receptor for endocytosis)、LYVE-1(lymphatic vessel endothelial hyaluronan receptor-1)等均是透明质酸受体。Choi等[26]将5β-去羟基胆酸连接于透明质酸而制成两亲性聚合物纳米粒,共聚焦显微图像显示,该纳米粒对CD44受体具有明显的靶向作用,当游离透明质酸与CD44受体的结合达饱和状态后,纳米粒便不能进入细胞;而荷瘤小鼠活体成像实验也表明,该纳米粒可有效富集于CD44受体过度表达的肿瘤部位。Upadhyay等[27]研究发现,荷载阿霉素的聚(γ-苯甲基谷氨酸)-透明质酸嵌段共聚物给药系统具有明显的CD44受体靶向性。

表5 用于制备药物传递系统的透明质酸衍生物类型Table5 Different derivatives of hyaluronic acid used for preparing drug delivery system
通过物理或化学方法交联的透明质酸还可用于制备储库型给药系统,实现蛋白药物的缓释(见表6)。蛋白药物粒径一般为3~15 nm,故透明质酸储库型给药系统中的通道孔径应为5~25 nm。

表6 储库型透明质酸给药系统类型Table6 Depot-type drug delivery system with hyaluronic acid
5 肝素
肝素是由D-葡糖胺、L-艾杜糖醛酸及β-D-葡糖醛酸交替连接而成的黏多糖硫酸酯,相对分子质量在1 200~40 000之间,广泛存在于动物体内,主要从牛肺和猪小肠黏膜中提取。
肝素中每个二糖单元中平均含有2.7个磺基,加之其含有羧基,使得肝素成为至今已知的天然产物中负电性最强的物质,故其可与许多蛋白药物(如血管内皮生长因子和蛋白酶等)发生静电相互作用,从而对蛋白起稳定作用,防止其变性。近来,有研究者将肝素与其他高分子材料聚合,生成机械和化学性能更优的载体材料。Choi等[35]将肝素与普朗尼克聚合制备纳米凝胶,该凝胶制备工艺简单,稳定性好,其粒径适用于细胞内药物传递;试验发现,选用RNase A作为蛋白模型药物时,因其与肝素结合率高,故该凝胶载药量大大提高(大于78%),可使药物更多地进入细胞浆和细胞核。
肝素在临床上常用作抗凝剂,且具有抗病毒(如抑制HIV-1的复制)、抑制补体的级联放大及促进脂蛋白脂肪酶的释放等作用。近年来,有研究者将肝素与其他纳米材料结合形成新型给药系统(见表7)。

表7 肝素与其他纳米材料组成的给药系统类型Table7 Types of drug delivery system composed of heparin and other nanomaterials
此外,肝素还具抑制肿瘤生长和抗血管新生作用。Park等[44]发现,将疏水性抗肿瘤药物维甲酸连接于肝素,可在提高维甲酸水溶性的同时发挥协同抗肿瘤作用;在肝素骨架上化学连接靶向配体叶酸而形成的两亲性聚合物HFR抗凝活性降低,但仍具有抗血管新生作用,且在水中可迅速形成纳米粒,此纳米粒可富集于叶酸受体过度表达的肿瘤细胞,增强了抗肿瘤活性。
6 结语
随着对多糖及其衍生物的进一步深入研究与了解以及更多功能性高分子的发现,人们可根据需要,通过化学和生物合成方法更为精确地控制多糖的序列,并对其结构进行各种修饰,从而改善多糖的特性,如亲水性、疏水性、温度敏感性、pH敏感性、离子强度敏感性等,进一步拓展了多糖及其衍生物在药物传递系统中的应用。
[1] CallewaertM,Millot JM,Lesage J,et al.Serum albuminalginate coated microspheres:role of the inner gel in binding and release of the KRFK peptide[J].Int J Pharm,2009,366(1/2):103-110.
[2] Oddo L,MasciG,DiMeo C.Novel thermosensitive calcium alginate microspheres:physico-chemical characterization and delivery properties[J].Acta Biomater,2001,6(9): 3657-3664.
[3] Basu SK,Rajendran A.Studies in the development of nateglinide loaded calcium alginate and chitosan coated calcium alginate beads[J].Chem Pharm Bull,2008,56 (8):1077-1084.
[4] Jayant R D,McShane M J,Srivastava R.Polyelectrolytecoated alginatemicrospheres as drug delivery carriers for dexamethasone release[J].Drug Deliv,2009,16(6): 331-340.
[5] Lim SY,Kim K O,Kim D M,et al.Silica-coated alginate beads for in vitro protein synthesis via transcription/translation machinery encapsulation[J].J Biotechnol,2009,143(3):183-189.
[6] Lee M,Li W,Siu R K,et al.Biomimetic apatite-coated alginate/chitosan microparticles as osteogenic protein carriers[J].Biomaterials,2009,30(30):6094-6101.
[7] KulkarniR,Sa B.Novel pH-sensitive interpenetrating network hydrogel beads of carboxymethylcellulose-(polyacrylamide-grafted-alginate)for controlled release of ketoprofen:preparation and characterization[J].Curr Drug Deliv,2008,5(4):256-264.
[8] De Moura M R,Ahmad A F,Favaro SL,et al.Release of BSA from porous matrices constituted of alginate-Ca2+and PNIPAAm-interpenetrated networks[J].Mater Sci Eng C,2009,29(8):2319-2325.
[9] Gao C,Liu M,Chen S,etal.Preparation ofoxidized sodium alginate-graft-poly((2-dimethylamino)ethyl methacrylate)gel beads and in vitro controlled release behavior of BSA[J].Int JPharm,2009,371(1/2):16-24.
[10]George M,Abraham T E.pH Sensitive alginate-guar gum hydrogel for the controlled delivery of protein drugs[J].Int JPharm,2007,335(1/2):123-129.
[11]Mohamadnia Z,Zohuriaan-Mehr M,Kabiri K,et al.Ionically cross-linked carrageenan-alginate hydrogel beads[J].J Biomater Sci Polym Ed,2008,19(1):47-59.
[12]Yu CY,Yin BC,ZhangW,etal.Compositemicroparticle drug delivery systems based on chitosan,alginate and pectin with improved pH-sensitive drug release property[J].Colloids Surf B Biointerf,2009,68(2):245-249.
[13]Alsberg E,Anderson KW,Albeiruti A,et al.Cell-interactive alginate hydrogels for bone tissue engineering[J].J Dent Res,2001,80(11):2025-2029.
[14]Zhang C,Ding Y,Yu L,et al.Polymeric micelle systems of hydroxycamptothecin based on amphiphilic N-alkyl-N-trimethyl chitosan derivatives[J].Colloids Surf B Biointerf,2007,55(2):192-199.
[15]Zhang C,Qu G,Sun Y,et al.Pharmacokinetics,biodistribution,efficacy and safety of N-octyl-O-sulfate chitosan micelles loaded with paclitaxel[J].Biomaterials,2008,29 (9):1233-1241.
[16]Qu G,Yao Z,Zhang C,et al.PEG conjugated N-octyl-O-sulfate chitosan micelles for delivery of paclitaxel:in vitro characterization and in vivo evaluation[J].Eur J Pharm Sci,2009,37(2):98-105.
[17]Cao Y,Zhang C,Shen W,et al.Poly(N-isopropylacrylamide)-chitosan as thermosensitive in situ gel-forming system for ocular drug delivery[J].JControlled Release,2007,120(3):186-194.
[18]Li H,Liu J,Ding S,et al.Synthesis of novel pH-sensitive chitosan graft copolymers and micellar solubilization of paclitaxel[J].Int J Biol Macromol,2009,44(3): 249-256.
[19]Kim S,Nishimoto SK,Bumgardner JD,etal.A chitosan/ β-glycerophosphate thermo-sensitive gel for the delivery of ellagic acid for the treatment of brain cancer[J].Biomaterials,2010,31(14):4157-4166.
[20]Ranjha N,Ayub G,Naseem S,et al.Preparation and characterization of hybrid pH-sensitive hydrogels of chitosanco-acrylic acid for controlled release of verapamil[J].J Mater Sci Mater Med,2010,21(10):2805-2816.
[21]Lee K Y,Jeong L,Kang Y O,etal.Electrospinning of polysaccharides for regenerative medicine[J].Adv Drug Del Rev,2009,61(12):1020-1032.
[22]Jeong S I,Krebs M D,Bonino C A,et al.Electrospun chitosan-alginate nanofiberswith in situ polyelectrolyte complexation for use as tissue engineering scaffolds[J].Tissue Eng Part A,2010,17(1/2):59-70.
[23]Sun H,Guo B,Li X,et al.Shell-sheddablemicelles based on dextran-SS-poly(ε-caprolactone)diblock copolymer for efficient intracellular release of doxorubicin[J].Biomacromolecules,2010,11(4):848-854.
[24]Varshosaz J,Emami J,Ahmadi F,et al.Preparation of budesonide-dextran conjugates using glutarate spacer as a colon-targeted drug delivery system:in vitro/in vivo evaluation in induced ulcerative colitis[J].J Drug Targeting,2011,19(2):140-153.
[25]Homma A,Sato H,Tamura T,et al.Synthesis and optimization of hyaluronic acid-methotrexate conjugates tomaximize benefit in the treatment of osteoarthritis[J].Bioorg Med Chem,2010,18(3):1062-1075.
[26]Choi K Y,Chung H,Min K H,et al.Self-assembled hyaluronic acid nanoparticles for active tumor targeting[J].Biomaterials,2010,31(1):106-114.
[27]Upadhyay K K,Bhatt,A N,Mishra A K,et al.The intracellular drug delivery and anti tumor activity of doxorubicin loaded poly(γ-benzyl-L-glutamate)-b-hyaluronan polymersomes[J].Biomaterials,2010,31(10): 2882-2892.
[28]Kim SJ,Hahn SK,Kim M J,etal.Developmentofa novel sustained release formulation of recombinant human growth hormone using sodium hyaluronate microparticles[J].JControlled Release,2005,104(2):323-335.
[29]Surendrakumar K,Martyn G P,Hodgers ECM,etal.Sustained release of insulin from sodium hyaluronate based dry powder formulations after pulmonary delivery to beagle dogs[J].JControlled Release,2003,91(3):385-394.
[30]Motokawa K,Hahn S K,Nakamura T,et al.Selectively crosslinked hyaluronic acid hydrogels for sustained release formulation oferythropoietin[J].JBiomed Mater Res Part A,2006,78A(3):459-465.
[31]Hahn S K,Kim J S,Shimobouji T.Injectable hyaluronic acid microhydrogels for controlled release formulation of erythropoietin[J].JBiomed Mater Res Part A,2007,80A (4):916-924.
[32]Hirakura T,Yasugi K,Nemoto T,etal.Hybrid hyaluronan hydrogel encapsulating nanogel as a protein nanocarrier: new system for sustained delivery of protein with a chaperone-like function[J].J Controlled Release,2010,142 (3):483-489.
[33]Baumann M D,Kang C E,Stanwick JC,et al.An injec-table drug delivery platform for sustained combination therapy[J].J Controlled Release,2009,138(3): 205-213.
[34]Wang Y,Lapitsky Y,Kang C E,et al.Accelerated release of a sparingly soluble drug from an injectable hyaluronanmethylcellulose hydrogel[J].J Controlled Release,2009,140(3):218-223.
[35]Choi JH,Jang JY,Joung Y K,etal.Intracellular delivery and anti-cancer effect of self-assembled heparin-Pluronic nanogels with RNase A[J].J Controlled Release,2011,147(3):420-427.
[36]Jiao Y,Ubrich N,Marchand-Arvier M,et al.In vitro and in vivo evaluation of oral heparin-loaded polymeric nanoparticles in rabbits[J].Circulation,2002,105(2): 230-235.
[37]Rai B,Grondahl L,Trau M.Combining chemistry and biology to create colloidally stable bionanohydroxyapatite particles:toward load-bearing bone applications[J].Langmuir,2008,24(15):7744-7749.
[38]Lee K,Lee H,Bae K H,et al.Heparin immobilized gold nanoparticles for targeted detection and apoptotic death of metastatic cancer cells[J].Biomaterials,2010,31(25): 6530-6536.
[39]Min K A,Yu F,Yang V C,etal.Transcellular transportof heparin-coated magnetic iron oxide nanoparticles(hep-MION)under the influence of an applied magnetic field[J].Pharmaceutics,2010,2(2):119-135.
[40]Na K,Kim S,Park K,et al.Heparin/poly(L-lysine) nanoparticle-coated polymeric microspheres for stem-cell therapy[J].JAm Chem Soc,2007,129(18):5788-5789.
[41]Chung Y I,Kim JC,Kim Y H,et al.The effect of surface functionalization of PLGA nanoparticles by heparin-or chitosan-conjugated Pluronic on tumor targeting[J].J Controlled Release,2010,143(3):374-382.
[42]Park K,Lee G Y,Kim Y S,et al.Heparin-deoxycholic acid chemical conjugate as an anticancer drug carrier and its antitumor activity[J].JControlled Release,2006,114 (3):300-306.
[43]Passirani C,Barratt G,Devissaguet JP,et al.Long-circulating nanopartides bearing heparin or dextran covalently bound to poly(methyl methacrylate)[J].Pharm Res,1998,15(7):1046-1050.
[44]Park IK,Tran T H,Oh IH,et al.Ternary biomolecular nanoparticles for targeting of cancer cells and anti-angio-genesis[J].Eur J Pharm Sci,2010,41(1):148-155.
