* 印度块菌粗多糖的提取及抗氧化活性研究
2011-01-11曹晋忠魏磊苏红范黎李玉
曹晋忠,魏磊,苏红,范黎* ,李玉*
(1.吉林农业大学菌物研究所,长春 130118;2.首都师范大学生命科学学院,北京 100048)
*印度块菌粗多糖的提取及抗氧化活性研究
曹晋忠1,魏磊2,苏红2,范黎2*,李玉1*
(1.吉林农业大学菌物研究所,长春 130118;2.首都师范大学生命科学学院,北京 100048)
采用正交试验研究了热水浸提法提取印度块菌(Tuber indicumCooke&Massee)子实体粗多糖(TICP)的最优工艺,根据方差分析结果确定了热水浸提法的最优工艺为:料液比1∶15,提取时间120 min,提取温度100℃,提取2次,多糖提取率为6.790 2%.用95%乙醇对粗多糖进行醇沉,然后利用总抗氧化能力(T-AOC)测定法、羟基自由基(OH·)清除法、铁离子螯合能力及测定还原能力等方法对上述印度块菌粗多糖的抗氧化活性进行评价,结果显示块菌粗多糖对羟基自由基的清除活性最高,其EC50值为0.26 mg/mL,其次为还原能力和铁离子螯合能力,其EC50值分别为1.15 mg/mL、2.80 mg/mL,同时块菌粗多糖具有较好的总抗氧化能力(T-AOC),当浓度为20 mg/mL时,其总抗氧化能力为72.06 U/mL.
印度块菌;多糖;抗氧化
块菌(Tuber)属于珍稀食、药用真菌,在我国主要分布于云南和四川.块菌除本身味美外,且营养丰富,并含有多种生物活性物质.如α-雄烷醇能调节女性月经周期,神经酰胺作为一种天然的人体皮肤保湿成分可用于化妆品的开发,块菌多糖具有抗肿瘤和调节免疫功能的作用[1].机体在正常生物代谢过程中会产生超氧阴离子(O2-)、过氧化氢(H2O2)、羟基自由基(OH·)等,进而导致机体脂质过氧化,对脂类、蛋白质、核酸造成损害[2],引发机体衰老以及癌症、动脉粥样硬化、风湿性关节炎等疾病[3].研究发现,许多食用菌都具有各种生理活性,如抗癌、抗氧化、抗炎以及产生抗生素等[4],其中抗氧化活性可能与菌体的多糖含量有关.本研究对印度块菌(Tuber indicumCooke&Massee)粗多糖的热水浸提工艺进行了研究,并测定其体外抗氧化活性,以期为块菌多糖的研究、开发和应用提供基础数据.
1 材料与方法
1.1 材料
冻干、成熟的印度块菌.新鲜的印度块菌购自云南当地农贸市场,由首都师范大学生命科学学院范黎老师鉴定.
1.2 主要试剂和仪器
Ferrozine、VC等购自Sigma公司;羟基自由基测定试剂盒、总抗氧化能力(T-AOC)测定试剂盒等购自南京建成生物工程研究所;EDTA二钠盐、氯化亚铁、氯化铁、硫酸亚铁、乙醇、甲醇、葡萄糖、冰乙酸、浓硫酸、磷酸氢二钠、磷酸二氢钠等购自北京化工厂.所有试剂均为分析纯.
紫外分光光度计(Lambda 35,Perkin Elmer),冷冻干燥仪(Wizard 2.0,VirTis),旋转蒸发仪(Heizbad HB digit,Heidolph),台式高速离心机(Lab way Science Rotina 35),恒温水浴锅(HW.SY21-K4型,北京长风仪器仪表公司),鼓风干燥箱(ZRD-A 7140型,上海智城分析仪器制造有限公司),循环水式多用真空泵(SHB-B95型,河南巩义市英峪予华仪器厂).
1.3 印度块菌多糖的提取及测定
称取冻干后的块菌子实体20 g,粉碎至100目,加15倍蒸馏水,于100℃浸提120 min.抽滤,将滤渣加入第1次水量的80%,同样条件再浸提1次,抽滤后合并两次滤液,真空浓缩后加入3倍体积的95%的乙醇过夜醇沉,70℃烘干后得到块菌粗多糖(Tuber indicumcrude polysaccharide,TICP).采用苯酚-硫酸法[5]测定样品中多糖含量.将干燥的待测粗多糖定容至100 m L,准确吸取1 m L该溶液定容至100 m L,取0.6 m L稀释液加入蒸馏水1.4 mL、苯酚液1 mL、浓硫酸5 m L.振荡,沸水浴10 min,迅速冷却,然后在490 nm波长下比色,所得的仪器读数即为样品中多糖含量.多糖提取率(%)=多糖含量(g)/原料干重(g)×100%.
1.4 印度块菌粗多糖的热水浸提工艺
1.4.1 料液比单因素优化
在 90 ℃,分别按照料水(蒸馏水)1∶5、1∶10、1∶15、1∶20、1∶25水浴煮提 1 h,煮提两次 ,第 2次水量为第1次的80%,每次煮提后均进行抽滤,滤液旋蒸浓缩后进行醇沉,70℃烘干复溶后测多糖含量(下同).
1.4.2 提取时间单因素优化
按照料液比为1∶10,在90 ℃水浴分别提取30 min、60 min、90 min、120 min、150 min,测定多糖含量.
1.4.3 煮提温度单因素优化
按照料水比为1∶10,分别在60 ℃、70 ℃、80 ℃、90 ℃、100 ℃水浴提取1 h,测定多糖含量.
1.4.4 p H单因素优化
在90℃,料液比为1∶15水浴提取1 h,第2次水量为第1次的80%.p H值分别调节为4.14、5.64、7.14、8.64、10.14,测定多糖含量.
1.4.5 正交试验
在单因素实验的基础上,以料液比、提取时间、提取温度等为3因素,各取3个水平,并考虑各因素间的交互作用,按L18(37)进行正交实验,以确定其最佳提取工艺条件.
1.5 印度块菌粗多糖抗氧化活性的测定
1.5.1 羟基自由基、超氧阴离子自由基清除能力和总抗氧化能力(T-AOC)的测定
上述实验均采用南京建成生物工程研究所生产的试剂盒进行测定,其中总抗氧化能力(T-AOC)定义为在37℃时,每分钟每毫升样品使反应体系的吸光度(OD)值每增加0.01时,为一个总抗氧化能力单位/U.
1.5.2 还原能力测定
还原能力(将Fe3+还原为Fe2+)测定参照 Yen&Chen的方法[6].OD值越高,说明反应物的还原性越强,每个样品平行测3次,取其平均值.用VC作为阳性对照.
1.5.3 铁离子螯合能力测定
铁离子(Fe2+)螯合能力测定参照Decker&Welch的方法[7].每个样品平行测定3次,取平均值.以蒸馏水作为空白对照,EDTA二钠盐作为阳性对照.根据下面公式计算块菌多糖提取物的铁离子螯合能力:

其中A0为空白对照的OD值,A1为加有样品或者阳性对照后的OD值.
1.5.4 EC50值
EC50值指清除率为50%时所需样品的浓度,是评价块菌提取物抗氧化活性的重要参数.上述1.5.1、1.5.3中各试验的EC50值分别指当羟基自由基清除率和当铁离子螯合率为50%时的样品浓度,而1.2.5.2还原力测定的试验中其EC50值是指在700 nm处OD值为0.5时块菌粗多糖的浓度.EC50值的计算应用中值效应分析通过软件Calcusyn 1.0(Biosoft)完成.
2 结果与分析
2.1 印度块菌粗多糖(TICP)的热水浸提工艺
2.1.1 单因素试验
试验结果(图1,P139)表明,提取粗多糖的最佳料液比为1∶15(图1,a);最佳提取时间为120 m in(图1,b);粗多糖的提取率随着提取温度的升高而增大,考虑到实验条件限制和能源节约等实际问题没有尝试高于100℃的温度,故最佳提取温度为100℃(图1,c);在酸性(p H=4.14)和中性偏碱性(p H=7.14)条件下多糖的提取率较高,蒸馏水(p H=5.64,弱酸性)对多糖的提取率相对稍低(图1,d).鉴于不同的酸碱度,尤其是过酸或过碱时会影响多糖的结构,故选择p H为蒸馏水自然p H时的提取条件进行正交优化.选取的正交优化因素为:料液比、提取时间、提取温度.

图1 印度块菌粗多糖提取的单因素试验Fig.1 Effect of different factors on extraction yield of Tuber indicum crude polysaccharide

表1 正交试验结果Table 1 Results of experiment by orthogonal design

表2 方差分析表Table 2 ANOVA for the results of experiment by orthogonal design
2.1.2 正交试验
由正交试验方差分析表(表2)可知,料液比、提取时间、提取温度等3个因素之间相互作用的F值小于临界值,所以这3个因素之间无交互作用.影响块菌多糖提取率的因素大小依次为A(料液比)>B(时间)>C(温度),其中料液比的F值为3.697,大于临界值(3.110),所以在α=0.1的条件下,料液比为显著影响因素.由直观分析表(表1)可知,块菌多糖提取的最佳组合为A 2B3C2,即料液比为1∶15;温度为100℃;提取时间为120 m in,最终多糖的提取率为6.790 2%.这与单因素实验的结果相一致.
2.2 印度块菌粗多糖(TICP)的抗氧化能力测定
2.2.1 总抗氧化能力(T-AOC)的测定
试验结果(图2)表明,随着块菌粗多糖浓度的升高,其所对应的总抗氧化能力也呈线性增长.浓度为20 mg/m L的粗多糖总抗氧化能力达到72.06 U/m L,但明显小于相同浓度下VC的总抗氧化能力(157.18 U/mL).
2.2.2 羟基自由基清除能力测定
结果(图3)表明,浓度为0.2~10 mg/m L的块菌粗多糖对OH·的清除率随其浓度的增加而增加,浓度为10 mg/mL的粗多糖溶液对OH·的清除率达到96.89%,明显接近于相同浓度下的VC溶液对OH·的清除率(99.80%).EC50值计算结果也表明,块菌粗多糖对羟基自由基有很强的清除活性,其 EC50值为0.26 m g/m L,而 VC的 EC50值为 0.23 mg/m L.
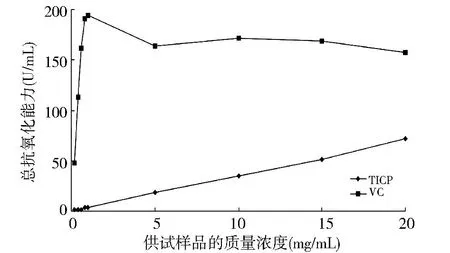
图2 印度块菌粗多糖(TICP)总抗氧化能力(T-AOC)的测定Fig.2 Total antioxidative capacity of crude polysaccharides from Tuber indicum(TICP)

图3 印度块菌粗多糖(TICP)羟基自由基的清除能力Fig.3 Hydroxyl radical scavenging activities of crude polysaccharides from Tuber indicum(TICP)
2.2.3 还原能力测定
本试验的研究结果(P141图4)表明,块菌粗多糖的还原力低于VC,并呈现出剂量依赖性.通过计算,粗多糖的EC50值为1.15 mg/mL.虽然20 mg/mL块菌粗多糖的还原力(OD值为2.767)比5 mg/m L的VC溶液(OD值为2.900)还要略低一些,但已表明块菌粗多糖具较好的还原力.
2.2.4 铁离子螯合能力测定
本试验的结果(P141图5)表明,随着样品浓度的增加,块菌粗多糖的铁离子螯合能力也随之增加.浓度为10 mg/m L的块菌粗多糖溶液对铁离子的螯合能力达到了96.94%,而EDTA的螯合能力在1 mg/m L时就几乎达到了100%.通过计算,粗多糖的 EC50值(2.80 m g/m L)也要高于 EDTA(0.20 mg/m L).综上所述,块菌粗多糖对铁离子的螯合能力虽然与EDTA有一定的差距,但是仍表现出良好的活性.
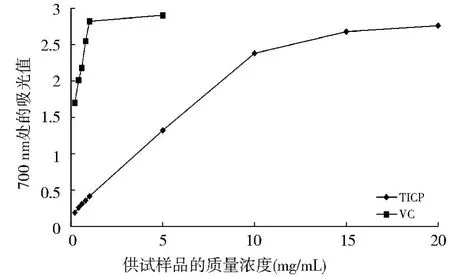
图4 印度块菌粗多糖(TICP)还原能力的测定Fig.4 Reducing power of crude polysaccharides from Tuber indicum(TICP)

图5 印度块菌粗多糖(TICP)铁离子螯合能力测定Fig.5 Chelating ferrous ion capacity of crude polysaccharides from Tuber indicum(TICP)
3 讨论
多糖类物质在食用菌中普遍存在,食用菌多糖作为保健食品和药品已经逐渐为人们所认识,尤其在生物活性方面很受重视[8].大量研究发现,许多食用菌多糖具有清除自由基、提高抗氧化酶活性和抑制脂质过氧化的活性,起到保护生物膜和延缓衰老的作用[9].
印度块菌多糖水溶液的浓度为1 mg/m L时其总抗氧化能力为20.84 U/m L,低于0.85 mg/m L的黄伞菌(Pholiota ad iposa(Batsch)P.Kumm.)菌丝体多糖(35.2 U/m L)[10],而10 mg/mL块菌的粗多糖水溶液的总抗氧化能力为35.03 U/mL,高于相同浓度的榛蘑(Arm illariella mellea(Vahl)P.Kumm.)(13 mg/m L)[11].10 mg/m L块菌的粗多糖水溶液对OH·的清除率达到了96.89%,其EC50值为0.26 mg/m L,远远低于金顶侧耳(Pleurotus citrinopileatusSinger)(2.45 mg/m L)、姬菇(P.cornucopiae(Paulet)Rolland)(2.60 mg/mL)、毛头鬼伞(Coprinus com atus(O.F.Müll.)Pers.)(2.59mg/mL)[12]和松衫灵芝(Ganoderm a tsugaeMurrill)子实体(>20 mg/mL)[13],显示了较好的羟基自由基清除能力,这意味着印度块菌粗多糖能有效地阻止羟基自由基对人体的氧化损伤.印度块菌粗多糖表现出较好的还原能力,1mg/m L时的还原力在700 nm下OD值为0.42 A,高于姬松茸(Agaricus blazei M urrill)多糖(0.12 A)[14],略高于双孢菇(Agaricus bisporus(J.E.Lange)Imbach)(0.41 A)[15]和树舌(Ganoderm a applanatum(Pers.)Pat.)胞内多糖(0.38 A)[16].在0.2 mg/mL时的还原力(0.23 A)与相同浓度的杏鲍菇(P.eryngii(DC.)Quél.)胞内多糖(0.25 A)[17]相当;其EC50值为1.15 mg/m L,低于松衫灵芝子实体(8.09 mg/mL)[13].1 mg/mL的双孢菇粗多糖铁离子的鳌合力接近85%[15],2 mg/m L的姬松茸为40.1%[14],印度块菌粗多糖虽然在低浓度下不及上述两种食用菌,但在20 mg/mL时达到了96.94%,显示出了良好的Fe2+的螯合能力,其 EC50值为2.80 mg/m L,低于松衫灵芝 (3.32 mg/m L)[13].
综上可知,印度块菌水溶性多糖有较好的自由基清除和铁离子螯合能力,具有良好的抗氧化活性.EC50值是评价真菌提取物抗氧化活性强弱的重要参数,通常当EC50值低于10 mg/m L,表明真菌提取物具有很好的抗氧化活性[18].本课题研究的印度块菌粗多糖在所检测的抗氧化试验中均表现出良好的活性,表明印度块菌的多糖对人体的氧化损伤有一定的保护作用.对于印度块菌多糖的抗氧化作用机制以及抗氧化活性物质还有待于进一步的研究.
[1] 汤亚杰,孔国平,朱伶俐,等.块菌活性成分及其人工栽培研究进展[J].中草药,2007,8(4):629-632.
[2] Halliwell B,Murcia H A,Chirco S,et al.Free Radical and Antioxidants in Food an in Vivo:W hat They do and How They Work[J].Critical Reviews in Food Science and Nutrition,1995,35:7-20.
[3] Lee J,Koo N,M in D B.Reactive Oxygen Species,Aging,and Antioxidative Nutraceuticals[J].Com prehensive Reviews in Food Science and Food Safety,2004,3:21-33.
[4] Longvah T,Deosthale Y G.Compositional and Nutritional Studies on Edible wild Mushroom from No rtheast India[J].Food Chemistry,1998,63:331-334.
[5] 张治安,张美善,蔚荣海.植物生理学实验指导[M].北京:中国农业科学技术出版社,2004:67-68.
[6] Yen GC,Chen H Y.Antioxidant Activity of Various Tea Extract in Relation to Their Antimutagenicity[J].Agric Food Chem,1995,43:27-32.
[7] Decker E A,Welch B.Role of Ferritin as a Lipid Oxidation Catalyst in Muscle food[J].J Agric Food Chem,1990,38:674-677.
[8] 朱建燕,于智勇.真菌多糖的研究与利用[J].扬州教育学院学报,2000(3):18-21.
[9] 陈爱葵,易广,李爱群.食用菌在提高人体免疫力方面的功效[J].中国食用菌,2004,23(3):7-9.
[10] 杨立红,黄清荣,冯培勇,等.黄伞菌丝体多糖的分离鉴定及其抗氧化性研究[J].食品科学,2009,30(23):131-134.
[11] 沈明花,崔海丹,王欣彤.榛蘑多糖的抗氧化作用研究[J].食品科技,2010,35(5):77-79.
[12] 陶明煊,王峰,刘俊,等.3种食用菌多糖自由基清除作用研究[J].食品科学,2009,30(23):135-137.
[13] Tseng Y H,Yang J H,Mau J L.Antioxidant Properties of Polysaccharides fromGanoderma tsugae[J].Food Chem istry,2008,107:732-738.
[14] 吕喜茹,郭亮,常明昌,等.姬松茸粗多糖抗氧化作用[J].食用菌学报,2010,17(1):69-71.
[15] 张强,宫璐婵,孟凡荣,等.双孢菇多糖抗氧化活性的研究[J].中国林副特产,2010,104(6):16-19.
[16] 李正鹏,吴萍,吴苏青.树舌胞内多糖抗氧化活性研究[J].食品工业科技,2010,6:108-110.
[17] 盛伟,方晓阳.杏鲍菇菌丝体胞内与胞外多糖体外抗氧化活性研究[J].中国林副特产,2010,98(1):7-10.
[18] Lee Y L,Yen M T,Mau JL.Antioxidant Propertiesof Various Extracts fromH ypizigus M armoreus[J].Food Chem istry,2007,104:1-9.
Study on Extraction and Anti-oxidan t Activity of Crude Polysaccharides from Tuber indicum
CAO Jin-zhong1,WEILei2,SU Hong2,FAN Li2,LI Yu1
(1.Institute of Mycology,Jilin Agricultural University,Changchun130118,China;
2.College of Life Science,Capital Normal University,Beijing100048,China)
With orthogonal design,the optimal conditions for extraction of crude polysaccharide from fruitbodies ofTuber indicumwere studied by hot water.Based on the result from ANOVA,the optimal conditions of hot water extraction method w ere as follow s:the material and liquid in the ratio of 1 to 15,for 120 min of extraction duration,at 100℃and extraction for 2 times.The extraction rate of polysaccharide was 6.790 2%under this condition.After ethanol precipitation with 95%ethanol,the antioxidant activity of above-mentioned crude polysaccharide was evaluated by fourmethods,including determining total antioxidative capacity(T-AOC),scavenging hydroxyl free radical(OH·),determining chelating and reducing capacity of ferrous ion.The result showed that the crude polysaccharide fromT.indicumpossessed the most potent capacity fo r scavenging hydroxyl free radical(OH·)w ith EC50values reaching 0.261 m g/m L,followed by the capacity for reducing and chelating ferrous ion w ith EC50values reaching 1.15 mg/mL and 2.80 mg/mL.Meanw hile,the crude polysaccharide fromT.indicumhad good total anti-oxidative capacity,w hen the concentration was 20 mg/mL,its total antioxidative capacity was 72.06 U/m L.
Tuber indium;polysaccharide;extraction;antioxidation
Q949.91;S646
A
0253-2395(2011)01-0137-06*
2010-05-11;
2010-08-30
国家自然科学基金(30770005;30870008)
曹晋忠(1963-),男,山西太原人,博士研究生,从事菌物分类学及菌物次生代谢产物研究.通讯作者:E-mail:fanli@mail.cnu.edu.cn;yuli966@126.com
