中国15种海参的分子系统发育和骨片演化的分析
2011-01-11胡超群范嗣刚
文 菁, 胡超群, 范嗣刚
(1.湛江师范学院 生命科学与技术学院, 广东 湛江 524048; 2.中国科学院 南海海洋研究所, 中国科学院海洋生物资源可持续利用重点实验室, 广东省应用海洋生物学重点实验室, 广东 广州 510301)
中国15种海参的分子系统发育和骨片演化的分析
文 菁1,2, 胡超群2, 范嗣刚2
(1.湛江师范学院 生命科学与技术学院, 广东 湛江 524048; 2.中国科学院 南海海洋研究所, 中国科学院海洋生物资源可持续利用重点实验室, 广东省应用海洋生物学重点实验室, 广东 广州 510301)
基于线粒体16S rRNA基因部分序列, 对我国15种海参的分子系统发育进行了分析。结果表明,片段长度约为 570bp, A+T的平均含量为 54.7%。15种海参的遗传距离在 0.041(花刺参与糙刺参)至0.327(红腹海参与花刺参)之间, 不同海参种类间的遗传距离差别很大。NJ和MP聚类分析方法一致, 符合传统的形态学分类结果。刺参科、海参科、刺参属、梅花参属和辐肛参属均呈单态性。利用系统发育方法对刺参科与海参科内骨片的进化关系进行了推断, 发现桌形体和扣状体是较原始的骨片类型,随后进化为杆状体和花纹样体。
海参; 16S rRNA基因; 系统发育; 骨片演化
海参是棘皮动物门(Echinodermata)、海参纲(Holothuroidea)的海洋无脊椎动物。全世界约有1 400种海参, 分属于25科和160属[1], 我国约有140余种海参[2]。海参是名贵的珍馐海味, 名列于八大海珍之中, 具有较高的食用价值和药用价值, 自古以来就受到亚洲尤其是我国人民的青睐。世界范围内可供食用的海参有50余种[3], 我国有20余种, 除了仿刺参(Apostichopus japonicus), 绝大部分分布于我国南海的亚热带和热带海域[2]。
海参骨片是位于海参真皮表层的内骨骼, 是海参的重要分类特征。根据传统分类学, 海参骨片用于在科的水平对海参种类进行鉴定和区分[4]。Samyn等[5]利用海参骨片的种类和形态, 对海参科海参属麦太森亚属(Mertensiothuria)进行了重新鉴定和分类,认为该亚属中的海参骨片有一定的共性。廖玉麟[2]曾对我国的 134种海参进行过形态学的分类, 并对其骨片进行了较详细的描述。文菁[6]和范嗣刚等[7]分别运用扫描电子显微镜对我国南海海参的骨片形态及结构进行观察, 丰富了海参骨片的形态学研究信息。国外学者认为海参的骨片与物种的进化有直接关系, Rowe认为海参骨片类型由简单到复杂是进化的过程, 如由杆状体和花纹样体进化到桌形体和扣形体; 但 Levin[8]的结论则与之相反, 认为骨片进化是由复杂到简单的过程。像其他棘皮动物一样, 有关海参的化石记录很少, 因此从形态学角度确定海参物种间的进化关系缺乏足够的证据[4]。
越来越多的研究表明, 线粒体DNA是进行物种系统发育分析的有效分子标记。目前, 已有国内外学者对海参的分子系统发育和种群遗传多态性进行了研究, Arndt等[4]采用16S rRNA 和COI片段对瓜参科的科、属系统水平发生进行了研究; Kerr等[8]用16S rRNA对海参科内5个属之间的亲缘关系进行了研究; 李颖等[9]基于 16S rRNA 和 COI片段对仿刺参的系统发育和遗传多样性进行了研究。利用分子系统发育方法来分析不同海参骨片的形态差异, 可以为海参骨片形态的进化关系提供有力证据[8]。因此,本研究基于海参线粒体 16S rRNA基因, 对我国 15种经济海参进行了系统发育分析, 并以此推断海参骨片的进化关系。
1 材料与方法
1.1 实验材料
14种热带海参分别取自广西涠洲岛、海南岛三亚和西沙群岛, 仿刺参由大连庄河新华水产有限公司仿刺参养殖基地提供, 完整的海参个体用无水乙醇固定后运回实验室, 15种海参均属于海参纲(Holothuroidea)楯手目(Aspidochirotida), 物种鉴定参照廖玉麟[2]和Massin[10]的描述, 基本信息见表1。

表1 15种海参名称和来源Tab. 1 Names and sources of 15 sea cucumber species
1.2 DNA提取
剪取海参样品体壁组织约 30 mg, 用双蒸水洗净, 灭菌吸水纸吸干水分, 按照 TIANamp海洋动物DNA 提取试剂盒(北京天根生物技术有限公司)提取样品DNA, 溶解于50 μL TE, -20℃保存。
1.3 聚合酶链式反应(PCR)
参 照 Kerr[8]的 引 物 (16Sar: 5′-CGCCTGTTTATCAAAAACAT-3′, 16Sbr: 5′-CTCCGGTTTGAACTCAGATCA-3′), 以基因组 DNA为模板, 扩增海参样品线粒体16S rRNA基因片段。反应体系: 总反应体积 50 μL, 包括 10×PCR 缓冲液 5 μL(内含 Mg2+50 mmol/L)、dNTPs l μL (10 mmol/L)、每种引物 2 μL (10 μmol/L )、DNA 模板 40 ng、Taq酶 0.5 μL (2 U/μL), 灭菌的双蒸水补充至50 μL。PCR反应程序为: 95℃变性30 s, 然后95℃ 30 s、50℃退火30 s、72℃ 1 min,经40个循环, 72℃延伸4 min。
1.4 PCR产物检测, 纯化, 测序
参照Wen[11]的方法, 取5 µL PCR产物, 用1.2%的琼脂糖凝胶电泳成像检测。电泳产物用AxyPrepTMDNA 胶回收试剂盒(Axygen, 美国)纯化, 然后送上海英维捷基生物有限公司进行双向测序。
1.5 数据处理
双向测序后用DNASTAR和Clustal X软件进行拼接和比对, 剪切引物序列, 用MEGA 4.1软件分析它们的碱基组成和遗传距离, 从 GenBank中选取海胆Arbacia lixula(序列号 X80396)为外群, 运用PHYLIP软件包进行海参分子系统发育的分析, 通过邻接法(NJ)和最大简约法(MP)构建系统树。自展(Bootstrap)法检测系统树的置信度, 重复数为1000。系统树用TREEVIEW程序进行构图, 刺参科和海参科种类的骨片进化树根据海参线粒体 16S rRNA基因部分序列的NJ系统树绘制。各种海参的不同骨片形态根据廖玉麟[2]和Massin[10]的描述。
2 结果
2.1 测序结果
用引物对16Sar和16Sbr能够容易地从所有样品中扩增出约570 bp大小的线粒体16S rRNA基因片段。产物经纯化和测序后, 序列简单而明晰, 种内扩增 16S rRNA 基因只得到一种单倍型, 序列递交到NCBI的GenBank数据库, 序列号见表2。
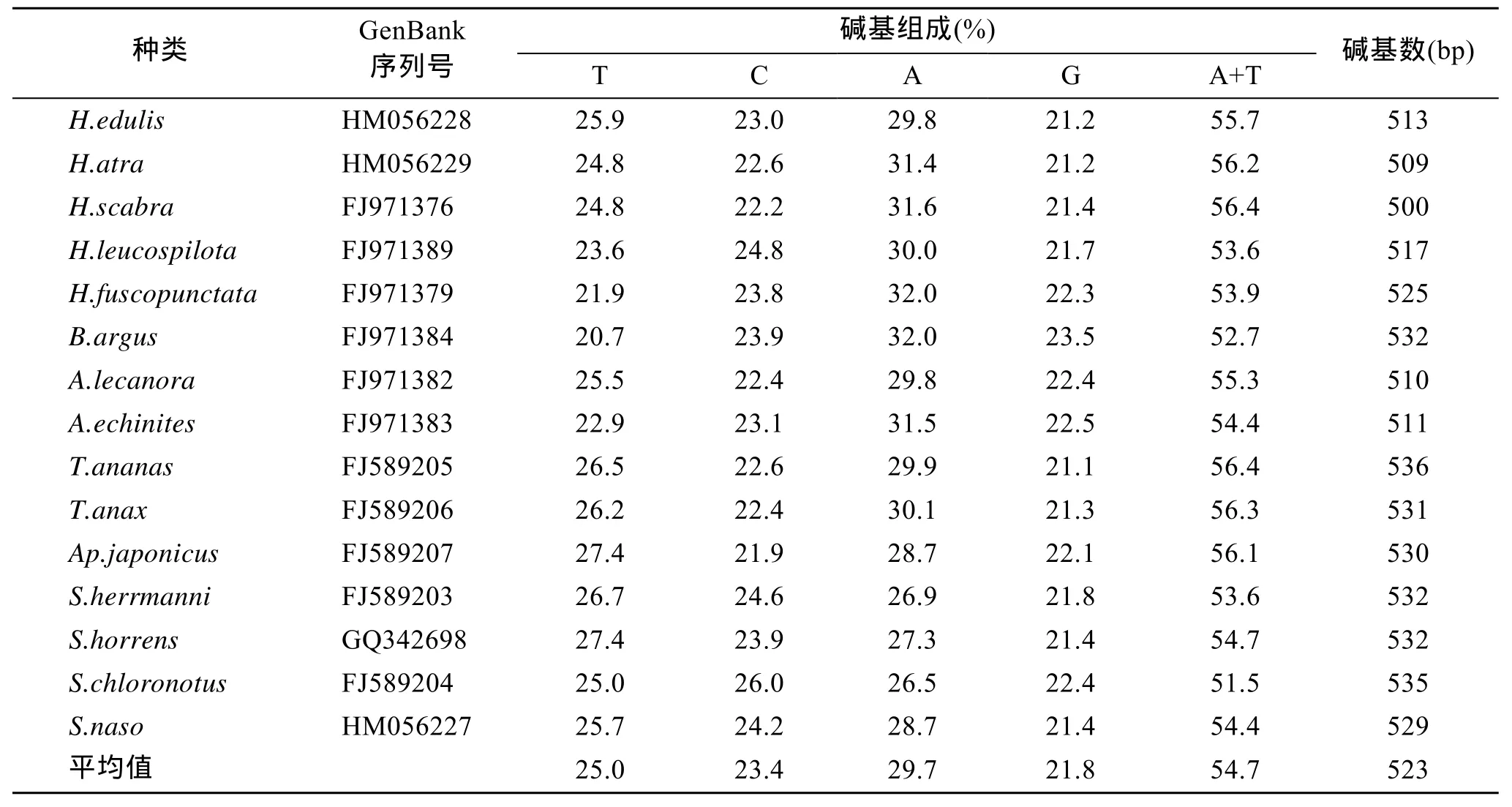
表2 15种海参16S rRNA基因片段长度和碱基组成Tab. 2 Lengths and base contents of 16S rRNA gene fragments
2.2 碱基组成
经比对发现, 15种海参16s rRNA基因片段序列存在保守位点 281个(51.6%), 多态位点 261个(47.9%), 简约信息位点214个(39.3%)。平均碱基组成中含25.0%的T, 23.4%的C, 29.7%的A, 21.8%的G, A+T的平均含量为54.7%, 高于G+C的平均含量(表 2)。
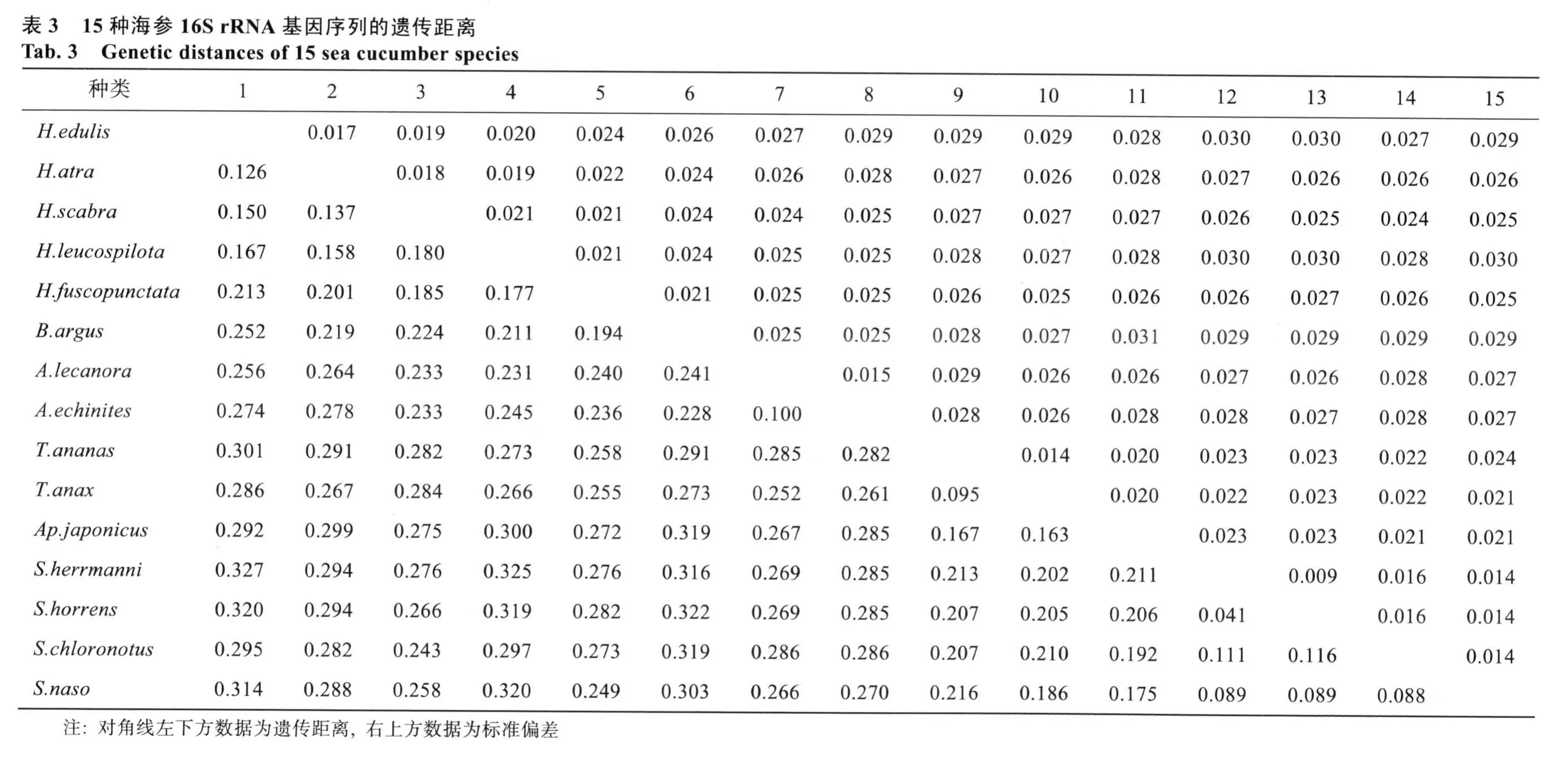
2.3 遗传距离
利用Kimura双参数法, 以转换加颠换计算相对遗传距离显示, 15种海参的遗传距离在0.041(花刺参与糙刺参)至 0.327(红腹海参与花刺参)之间(表 3)。对15种海参遗传距离的比较发现, 不同海参种类间的遗传距离差别很大。刺参属内的遗传距离为0.041~0.116, 梅花参属内的遗传距离为 0.095, 辐肛参属内的遗传距离为 0.100, 海参属内的遗传距离为0.126~0.213。在科水平内, 刺参科内的遗传距离为0.041~0.216, 海参科内的遗传距离为 0.100~0.278。海参科与刺参科之间的遗传距离为0.243~0.327。
2.4 分子系统发育树
图1显示了根据遗传距离构建的NJ和MP系统树, 两种分析方法的结果一致, 7种刺参科种类聚为一簇, 8种海参科种类聚为一簇。并且刺参属、梅花参属和辐肛参属都显示明确的单态性, 置信度都在98以上。
2.5 骨片进化树
根据NJ系统发育树构建的骨片进化树以及前人学者对海参骨片的描述[2,10], 在刺参科内, 刺参属的种类和仿刺参属具有桌形体, 而梅花参属的种类具有杆状体, 没有桌形体, 刺参属的种类聚为一簇, 仿刺参属和梅花参属聚为一簇; 刺参属的种类具有 C形体和花纹样体, 聚为一簇, 仿刺参属和梅花参属的种类均没有C形体和花纹样体, 聚为一簇(图2)。在海参科内, 海参属的种类具有桌形体, 聚为一簇,而白尼参属的蛇目白尼参和辐肛参属的种类没有桌形体, 两者聚为一簇; 玉足海参、象牙海参和糙海参具有扣状体, 其余5种海参科种类没有扣状体; 白尼参属的蛇目白尼参和辐肛参属的种类有花纹样体,除了黑海参, 其余 4种海参属种类均没有花纹样体(图 3)。
3 讨论
3.1 海参线粒体16S rRNA基因
?
本研究充分考虑到线粒体 16S rRNA基因作为分子标记用于分析海参系统发育的适合性。线粒体基因比核基因进化速度快, 16S rRNA基因相对于其他线粒体基因来说在种类极其保守[9]。Arndt等研究东太平洋 15种海参的系统发育和亲缘关系时指出,16S rRNA基因相对于 COI基因, 在种内更加保守,非常适合种间关系的研究, 能够被用来区分亲缘关系较近的物种[4]。而且, 线粒体 DNA作为独立的核外遗传物质, 在细胞内具有很高的拷贝数, 闭合双环的结构使得线粒体 DNA更加稳定, 因此, 相对于核基因组DNA来说, 线粒体DNA序列能够更加容易的扩增获得。
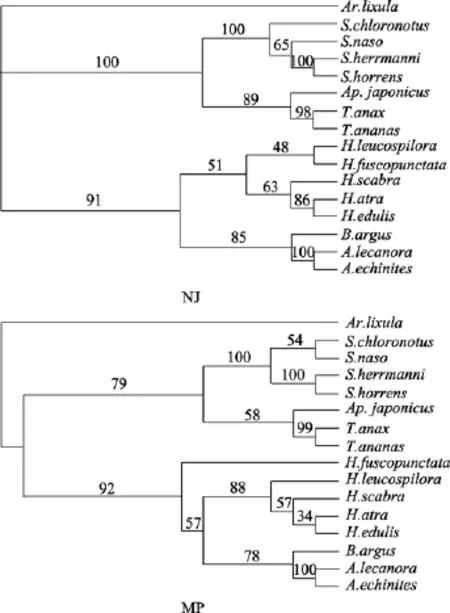
图1 基于海参16S rRNA基因片段的NJ和MP系统树Fig.1 Molecular phylogenetic tree of sea cucumbers based on NJ and MP analyses of 16S rRNA gene sequences.节点上的数字为 1000次重复的 Bootstrap值, 缩写见表 1,Ar.lixula 为外群Numbers above branches indicate bootstrap proportions (percentage of 1000 replicates) based on NJ and MP analyses. Genera abbreviations are as given in the legend of Tab.1, Ar.lixula was outgroup
15种海参中, A+T的平均含量为 54.7%, 高于G+C的含量, 这与其他学者在海参线粒体DNA序列研究中得到的 A+T含量高于 G+C含量的结果相一致[4,8-9,12]。从遗传距离可以看出, 海参科与刺参科之间的遗传距离大于刺参科内的遗传距离, 存在海参科内的遗传距离大于两科之间的遗传距离的现象。Kerr[13]等曾对海参科与刺参科种类的47种形态学特征进行研究, 发现两者除了刺参科种类具有发达的疣足外, 其余46种形态学特征存在共性[13]。除了不同属的玉足海参(海参属)与蛇目白尼参(白尼参属)的遗传距离(0.211)大于同属(海参属)的红腹海参与象牙海参的遗传距离(0.213)外, 基本上不同属之间的遗传距离大于属内的遗传距离。海参科是海参纲内的第二大科, 约有185种, 其中海参属又是数量最多的类群, 约有 150种[1], 因此, 在这一庞大类群内部的海参种类间的遗传距离难免会出现较大的差异,而刺参科是相对较小的海参类群, 仅有 24种, 因此在分类上比较的简单和清晰。
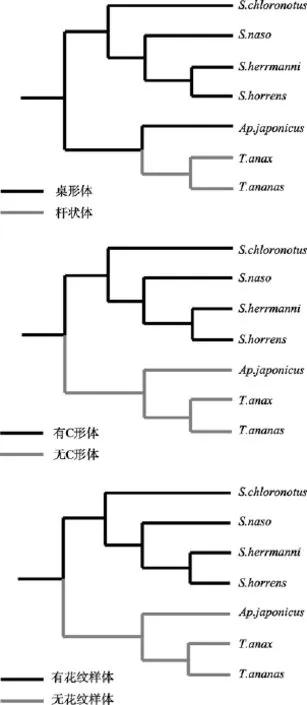
图2 基于16S rRNA基因片段的刺参科骨片NJ进化树Fig. 2 Ossicle phylogenetic tree of family Stichopodidae based on 16S rRNA genes

图3 基于16S rRNA基因片段的海参科骨片NJ进化树Fig. 3 Ossicle phylogenetic tree of family Holothuriidae based on 16S rRNA genes
3.2 基于 16S rRNA基因片段的海参分子系统发育
本研究中, 分子系统发育的结果与传统的形态学分类结果一致, 较高的置信度表明, 刺参科和海参科是界限明晰的两个类群。刺参属、梅花参属和棘辐肛参属在系统树上显示出唯一的单态性, 说明三者是理想的分类阶元。从进化树可以看出, 刺参属内花刺参与糙刺参的亲缘关系较近, 两者先聚为一簇, 然后与其他刺参属海参聚在一起。蛇目白尼参与辐肛参属的亲缘关系较近, 两者先聚为一簇, 然后与海参属聚为一簇。仿刺参与梅花参属的亲缘关系较近, 两者先聚为一簇, 再与刺参属聚为一簇。
3.3 基于 16S rRNA基因片段的海参骨片进化关系
本研究基于海参线粒体 16S rRNA基因对刺参科和海参科内骨片的进化规律进行了推断。结果表明, 在刺参科内, 刺参属种类的体壁存在桌形体、C形体和花纹样体; 仿刺参的体壁骨片主要是桌形体;梅花参属种类的体壁只有杆状体, 没有桌形体、C形体和花纹样体(图 2)。骨片的进化关系显示, 桌形体存在于刺参属和仿刺参属, 在梅花参属内消失, 实际上, 仿刺参的桌形体在随着个体的生长发育, 逐渐呈退化趋势, 幼体仿刺参体壁的桌形体具有完整的塔部, 而在成年仿刺参体壁内, 桌形体的塔部已经退化[2]。因此, 仿刺参可以看做是桌形体在刺参科内退化的过渡阶段。C形体和花纹样体只存在于刺参属内, 在仿刺参和梅花参属内已经完全退化消失。在海参科内, 桌形体存在于海参属种类, 白尼参属和辐肛参属内桌形体退化消失; 扣状体只存在于部分海参属种类(玉足海参、象牙海参和糙海参), 从黑海参直到辐肛参属, 扣状体退化; 海参属内, 除了黑海参, 其他海参属海参均不具有花纹样体, 花纹样体在白尼参属和辐肛参属中进化产生(图 3)。Rowe认为海参骨片的进化过程是从古老的花纹样体和杆状体进化到桌形体和扣状体, 而Levin等则认为桌形体和扣状体比较原始, 随后进化产生花纹样体和杆状体。本研究的结果表明, 在刺参科内, 桌形体逐步退化消失, 杆状体随之进化产生; 在海参科内, 桌形体和扣状体慢慢退化, 随后进化产生花纹样体, 比较支持Levin的观点。Kerr等[8]研究了海参科内8种海参的骨片系统发育, 表明海参科种类至少经过两轮的从桌形体和扣状体到花纹样体的进化过程。本研究中海参科内花纹样体的进化结果也显示, 海参科内骨片的进化不是直接的, 与Kerr的观点一致。
[1]Smiley S. Holothuroidea[M]// Harrison FW, Chia FS.Microscopic Anatomy of Invertebrates. Vol 14, Echinodermata, New York, N.Y: Wiley-Liss, 1994: 401-471.
[2]廖玉麟. 中国动物志, 棘皮动物门, 海参纲 [M]. 北京: 科学出版社, 1997.
[3]FAO. Sea cucumbers: A global review of fisheries and trade [C]// FAO Fisheries and Aquaculture Technical Paper, No. 516, Rome: FAO, 2008: 1-317.
[4]Arndt A, Marquez C, Lambert P, et al. Molecular phylogeny of eastern Pacific sea cucumbers (Echinodermata: Holothuroidea) based on mitochondrial DNA sequence [J]. Mol Phylogen Evol, 1996, 6 (3): 425-437.
[5]Yves S, Claude M. The holothurian subgenusMertensiothuria(Aspidochirotida: Holothuriidae) revisited [J].J Natural History, 2003, 37(20): 2487-2519.
[6]文菁, 张吕平, 胡超群, 等. 中国热带六种海参骨片的种类和形态研究 [J]. 海洋学报, 2009, 31 (2):139-145.
[7]范嗣刚, 胡超群, 张吕平, 等. 西沙群岛八种热带海参的骨片形态特征 [J]. 热带海洋学报, 2010, 29 (4):148-153.
[8]Kerr M A, Janies A D, Clouse M R, et al. Molecular phylogeny of Coral-Reef Sea cucumbers (Holothuriidae:Aspidochirotida) based on 16S mitochondrial ribosomal DNA sequence [J]. Mar Biotech, 2005, 7: 53-60.
[9]李颖, 刘萍, 孙慧玲, 等. 仿刺参(Apostichopus japonicus)mtDNA三个基因片段的序列分析 [J]. 海洋与湖沼, 2006, 37 (2): 143-153.
[10]Massin C. Reef-dwelling Holothuroidea (Echinodermata) of the Spermonde Archipelago (South-West Sulawesi, Indonesia) [J]. Zoologische Verhandelingen,1999, 329: 1-144.
[11]Wen J, Hu C Q, Zhang L P, et al. The application of PCR-RFLP and FINS for species identification used in sea cucumbers (Aspidochirotida: Stichopodidae) products from the market [J]. Food Cont, 2010, 21:403-407.
[12]陈丽梅, 李琪, 李费. 4种海参16S rRNA和COI基因片段序列比较及系统学研究 [J]. 中国水产科学,2008, 15 (6): 935-942.
[13]Kerr A M, Kim J. Phylogeny of Holothuroidea (Echinodermata) inferred from morphology [J]. Zool J Linn Soc, 2001, 133, 63-81.
Molecular phylogeny of 15 sea cucumbers and the inferences about the evolution of ossicles
WEN Jing1,2, HU Chao-qun2, FAN Si-gang2
(1.Department of Biology, Zhanjiang Normal University, Zhanjiang 524048, China; 2.LMB, LAMB, South China Sea Institute of Oceanology, the Chinese Academy of Sciences, Guangzhou 510301, China)
Nov., 22, 2010
sea cucumber; 16S rRNA gene; phylogeny; ossicle evolution
Molecular phylogeny of 15 recognized species of sea cucumbers were elucidated based on the partial sequences of the mitochondrial large ribosomal subunit (16S rRNA) gene. The results showed that the aligned sequences were 570 bp and the mean content of A+T was 54.7%. Their genetic distance ranged from 0.041 (betweenStichopus herrmanniandStichopus horrens) to 0.327 (betweenS. herrmanniandHolothuria edulis). The global branching pattern was coincident in neighbor-joining and maximum parsimony analyses, and both phylogenic trees supported the Linnean classification. Monophyly of family Stichopodidae, Holothuriidae, genusStichopus,ThelenotaandActinopygawere strongly supported by bootstrap analysis. Moreover, the phylogeny permited inferences about the evolution of ossicles within Stichopodidae and Holothuriidae. Our study indicates that tables and buttons are ancestral and later evolve into rods and rosettes.
Q178.53
A
1000-3096(2011)05-0066-07
2010-11-22;
2011-02-04
国家科技支撑计划项目(2009BAB44B02); 广东省海洋渔业科技项目(A200899E02, A200901E01); 广东省科技计划项目(2007A020300007-15); 广东省省院合作计划项目(2009B091300155);广西自治区重点科技项目(桂科攻0815006-2)
文菁(1982-), 男, 湖南株洲人, 讲师, 博士, 主要从事海参种质资源及水产养殖研究, 电话: 020-89023216, E-mail:jw82123@yahoo.com.cn; 胡超群, 通信作者, 博士生导师, 研究员,E-mail: cqhu@scsio.ac.cn
梁德海)
