焙烧镁铝层状双氢氧化物对Cr(VI)的吸附
2011-01-11李常浩杨国庆
李 燕,李常浩,杨国庆
(长治学院 化学系,山西 长治 046011)
焙烧镁铝层状双氢氧化物对Cr(VI)的吸附
李 燕,李常浩,杨国庆
(长治学院 化学系,山西 长治 046011)
用液相非稳态共沉淀法制备了镁铝层双氢氧化物(Mg-Al LDHs),Mg-Al LDHs于450℃焙烧转化为镁铝复合氧化物(LDO)。用TEM、FT-IR、XRD和粒度分布对Mg-Al LDHs和LDO进行表征分析,并研究了LDO对水体中Cr(VI)的吸附行为。实验结果表明:LDO对Cr(VI)有很强的吸附能力,其吸附动力学和吸附等温线分别符合准二级速率方程和Langmuir方程,吸附量随初始pH的增大、温度的升高和无机电解质浓度的增加而显著降低,探讨了吸附机理。
层状双氢氧化物;镁铝复合氧化物;铬(VI);吸附;结构重建
层状双氢氧化物(layered double hydroxides,LDHs)是由二价金属和三价金属离子组成的具有水滑石层状结构的氢氧化物[1-3]。LDHs的化学通式为:·m H2O,M2+指二价金属阳离子,如 Mg2+、Mn2+、Fe2+、Co2+、Zn2+、Cu2+等;M3+指三价金属阳离子,如 Al3+、Cr3+、Fe3+、Sc3+、V3+等;A指价数为-n的阴离子,如等;x指每摩尔LDHs中M3+的摩尔数;m为每摩尔LDHs中结晶水的摩尔数[1]。LDHs的层间阴离子具有一定的迁移性和很强的可交换性[4],即处于结构层之间的阴离子可与环境中的其它无机或有机阴离子交换,因而可用于去除废水中的阴离子污染物[5-12]。LDHs焙烧后失去层间水与层间阴离子而形成的混合金属氧化物(LDO),具有结构尺寸均匀、表面积大、稳定性好等特点,具有“记忆效应”,与水溶液接触时可重新吸收水和阴离子而恢复LDHs结构[1,13],因此,LDO也可用作污水阴离子污染物的处理剂[14-17]。
铬(Cr)是一种毒性较强的重金属元素,主要以金属铬、三价铬及六价铬三种形式出现。其中六价铬的毒性是三价铬的100倍,可导致人体皮肤过敏、遗传性基因缺陷及致癌等。而各种各样的六价铬化合物用于制革、纺织品生产、印染、颜料及镀铬等行业,每年均产生大量的含Cr(VI)废水,造成严重的水质和土壤污染,对环境安全形成巨大威胁。因此,研究开发重金属六价铬离子处理剂对污水处理及污染土壤的修复具有重要意义。
文章合成了镁铝层状双氢氧化物(Mg-Al LDHs),并于450℃焙烧制得镁铝复合氧化物(LDO),开展了以LDO吸附去除水中Cr(VI)的实验研究,并对主要影响因素和吸附机理进行了探讨,以期为研究开发高效含Cr(VI)污水处理剂提供依据。
1 实验部分
1.1 Mg-Al LDHs的合成与表征
Mg-Al LDHs采用非稳态共沉淀合成。配制总金属离子浓度为 0.5 mol·L-1、n(Mg):n(Al)=2:1 的MgCl2·6H2O的混合盐溶液,室温搅拌下加入1:5的共沉淀剂NH3·H2O,调节体系的pH值在9~10之间,静置老化1 h后,抽滤,洗涤,将滤饼密封于广口瓶中,80℃胶溶24 h,得Mg-Al LDHs溶胶,其固含量为10.16%,pH值为9.48,pHIEP=11.1。
Mg-Al LDHs样品100℃烘干,研磨,马弗炉中450℃焙烧4 h,即得类水滑石的焙烧产物(LDO)粉末,置于干燥器中保存。
对合成的Mg-Al LDHs及LDO样品进行TEM(日立H-800透射电子显微镜,日本日立公司)、FT-IR(Avatar370型傅里叶变换红外仪,美国Nicolet公司KBr压片,分辨率1 cm-1)、XRD(Rigaku D/MAX-γB型X射线衍射仪,日本理学公司,Cukα射线,管电压40 kV,管电流100 mA,扫描速度4°/min,扫描范围 5°~70°)和粒度分布(Zetasizer3000 型激光粒度分析仪,英国Malvern)表征。
1.2 吸附实验
在系列100mL的玻璃心管中分别加入一定量的 Cr(VI)母液、NaCl溶液和蒸馏水,混合均匀,用氢氧化钠和盐酸溶液调节pH至设计值。将一定量预先调节至相同pH值的LDO的质量恒为0.1 g。离心管置于SHA-C多功能水浴恒温振荡器(中国常州澳森电器有限公司)中恒温振荡一定时间(r),16000 r/min高速离心(TGL-16G高速离心机,上海安亭科学仪器厂)30min,采用国家标准(GB7467)二苯碳酰二肼光度法(TU-1900双光束紫外可见分光光度计,北京普析通用仪器有限公司)测定上清液中Cr(VI)的浓度(ct)(测定条件:λmax=540 nm,1 cm比色皿)。同时做空白实验以消除误差。根据吸附前后Cr(VI)浓度变化计算吸附量(qe)。每个实验平行测定3次。同时,对吸附500mg/L Cr(VI)后的LDO样品进行FT-IR和XRD分析。
取上述悬浮体,调节PH值为9.00,24 h内测定25℃时Cr(VI)在LDO上的吸附量(qt)随时间(t)的变化,研究吸附动力学。
2 结果与计论
2.1 Mg-Al LDHs及LDO的表征
图1a和b分别是Mg-Al LDHs和LDO样品的TEM图片,LDHs为较规则的六角形片状颗粒,LDO样品为不规则形状颗粒。经粒度分析,LDHs和LDO的平均粒径分别为150.2 nm和282 nm。
图2a和b分别为Mg-Al LDHs和LDO的FT-IR图谱。Mg-Al LDHs样品出现了层状双氢氧化物的特征吸收峰:3445 cm-1处的吸收峰对应于层板上νO-H的伸缩振动,1630 cm-1处的吸收峰对应于层间水分子δH-O-H的弯曲振动,400~1000 cm-1范围的吸收峰是层间阴离子和金属-氧键产生的红外吸收,1370 cm-1和680 cm-1处的吸收峰对应于的伸缩振动,表明层间存在离子,这是因为制备时水中含有离子所致。LDO在3445 cm-1和1630 cm-1处的吸收峰是样品吸附空气中少量水分所致,1370 cm-1处的特性振动峰消失,证明焙烧后被完全分解。
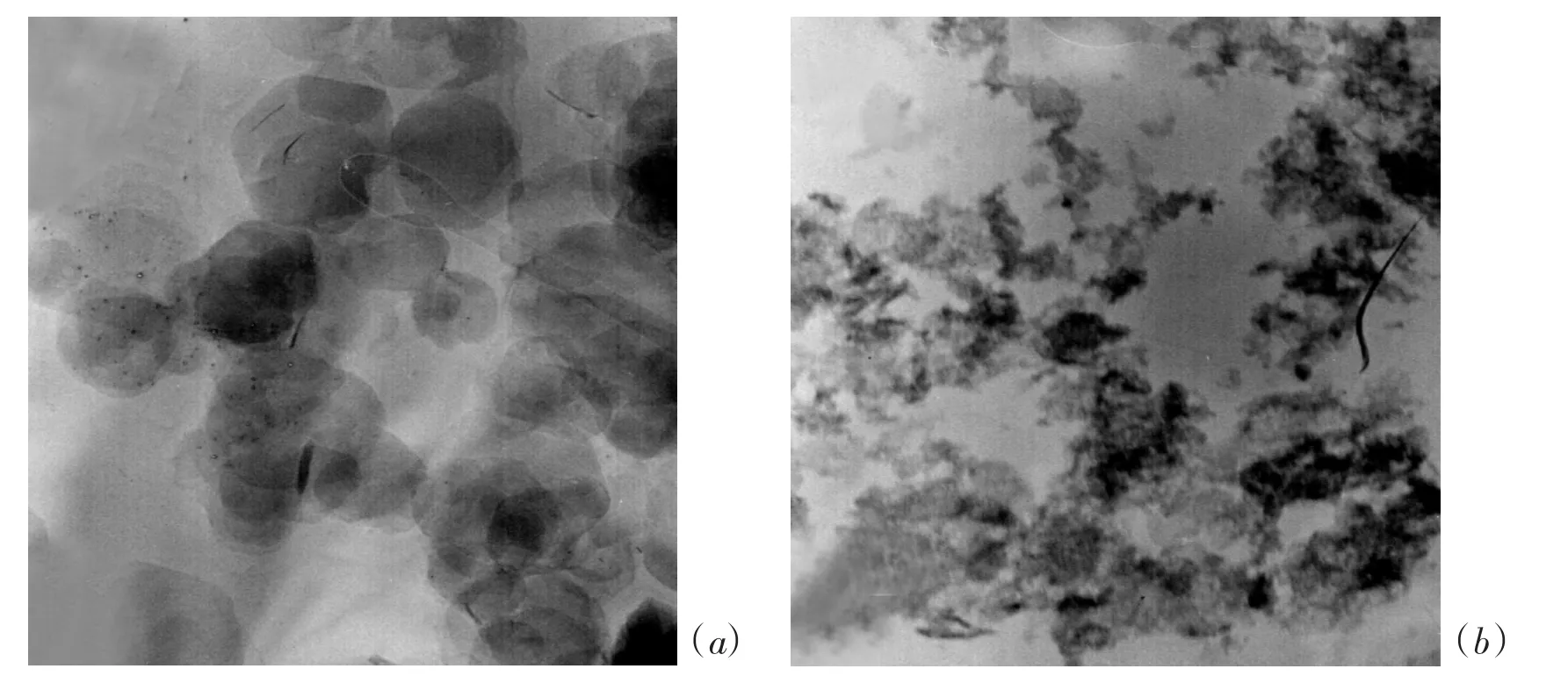
图1 LDHs(a)和 LDO(b)的透射电镜照片Fig.1 TEM images of LDHs(a)and LDO(b)
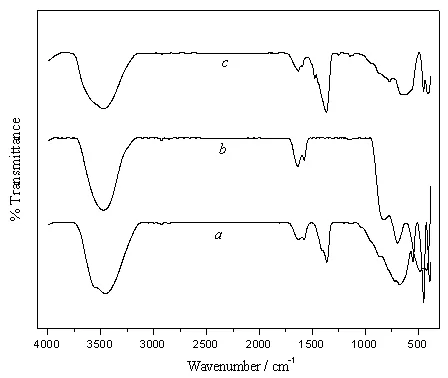
图2 LDHs(a)、吸附Cr(VI)前(b)和吸附Cr(VI)后(c)LDO 的 FT-IR 图谱Fig.2 FT-IR spectraof LDHs( a),LDObefore adsorption(b)and LDOafteradsorption(c)
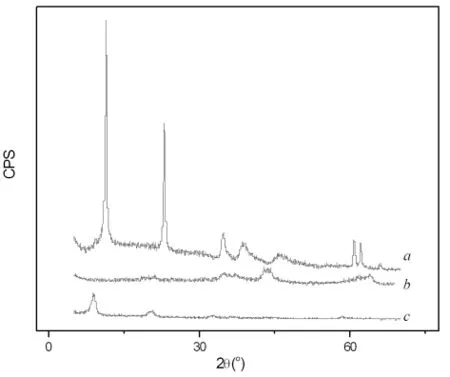
图3 LDHs(a)、吸附Cr(VI)前(b)和吸附C(VI)后(c)LDO的XRD图谱Fig.3 XRD patterns of LDHs(a),LDO before adsorption(b)and LDO after adsorption(c)
图3a和b分别为Mg-Al LDHs和LDO的XRD图谱。Mg-Al LDHs具有尖锐的衍射峰,d003=7.7214 Å,d006=3.8616 Å,d009=2.5787 Å,d110=1.5230Å,d113=1.4949Å,与类水滑石的特征衍射峰完全一致[18],证明合成的LDHs样品是结晶度良好、具有六方晶系的类水滑石相。LDO的XRD图上已无LDHs的尖锐衍射峰,代之以几个低强度衍射峰,说明原有的LDHs层状晶体结构已破坏,形成无定型氧化物。
2.2 吸附动力学
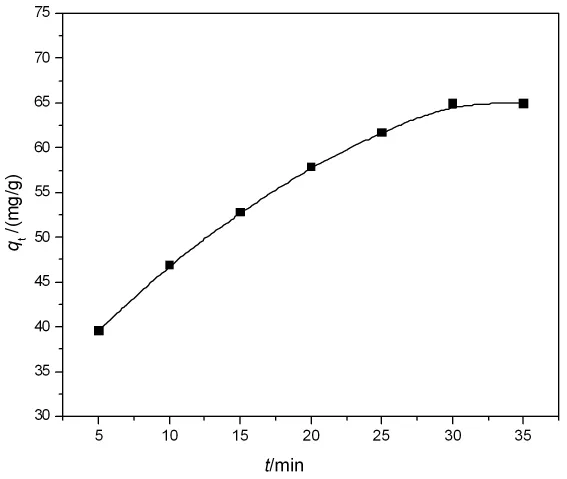
图4 Cr(VI)在LDO上的吸附动力学曲线Fig.4 Adsorption kinetics of Cr(VI)on LDO(25℃,c0=500mg/L,pH=5.00)
测定了 pH=5.00,25 ℃和不同 Cr(VI)初始浓度(c0)下,Cr(VI)在LDO上的吸附动力学曲线,图4是c0=500mg/L时的实验结果,其它条件下的结果与之相似。由图4可见,Cr(VI)在LDO上的吸附速率较高,30min左右即达吸附平衡。将实验数据带入准一级动力学和准二级动力学方程进行拟合,结果列于表 1。由表 1可知,Cr(VI)在LDO 上的吸附动力学符合准二级动力学方程。
2.3 吸附等温线
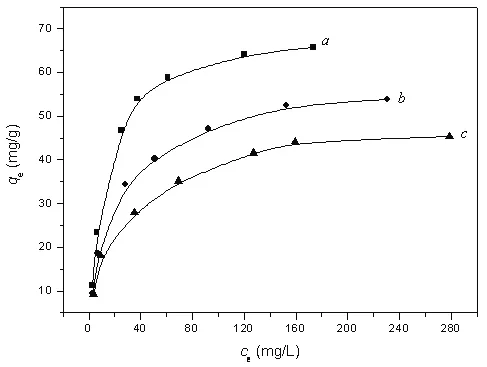
图5 Cr(VI)在LDO上的吸附等温线Fig.5 Adsorption isotherms of Cr(VI)on LDO((a)25℃,(b)35℃,(c)45℃,pH=5.00)
图 5a是 25 ℃,pH=5.00条件下,Cr(VI)在LDO上的吸附等温线,平衡吸附量(qe)随平衡浓度(ce)的增加先急剧增加再趋于平衡。分别用Lang-muir和Freundlich等温式进行线性拟合,表明Cr(VI)在LDO上的吸附的符合Langmuir等温式,相关系数(R2)为0.9992。Langmuir等温式为:ce/qe=1/(K·qm)+ce/qm,式中,qm为饱和吸附量,K为吸附系数。Cr(VI)在LDO上的吸附等温式中最大吸附量(qm)和吸附系数K分别为72.5mg/g和0.075 L/mg。

表1 Cr(VI)在LDO上的吸附动力学方程Table 1 Adsorption kinetic equations of Cr(VI)on LDO(25℃,c0=500mg/L,pH=5.00)
2.4 初始pH值对吸附的影响
图6是初始pH值对LDO吸附Cr(VI)的影响(c0=500mg/L,25℃)。由于LDHs有很强的pH缓冲作用[19],难以恒定pH值,因此在吸附过程中没有对体系的pH进行调控。由图6可知,在pH=5~11范围内,吸附量随pH值的增加而降低,且在pH=5~9范围内显著降低。
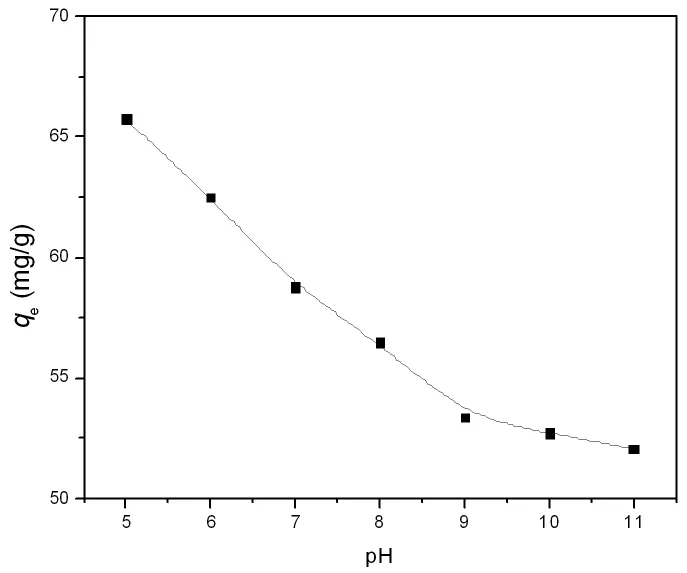
图6 pH对Cr(VI)在LDO上吸附量的影响(25℃,c0=500mg/L)Fig.6 Effectof pH on the adsorption of Cr(VI)on LDO
2.5 温度对吸附的影响
图 5b和 c分别是 35℃和 45℃时 Cr(VI)在 L DO上的吸附等温线(pH=5.00)。比较图5a,b和c曲线可知,吸附量随温度升高而降低,即,温度升高不利于吸附进行。
2.6 无机电解质对吸附的影响
图7是无机电解质NaCl浓度对25℃,pH=5.00时Cr(VI)在LDO上吸附量的影响。由图7可知随着NaCl浓度的增加,Cr(VI)的吸附量下降,说明NaCl对Cr(VI)在LDO上的吸附有极强的抑制作用。
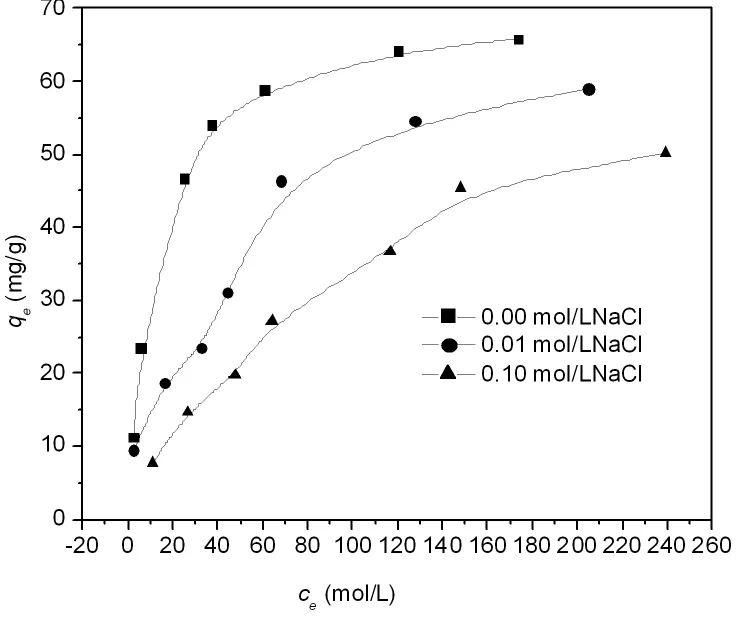
图7 NaCl浓度对Cr(VI)在LDO上吸附量的影响Fig.7 Effectof NaCl concentration on the adsorption of Cr(VI)on LDO(25℃,pH=5.00)
2.7 吸附机理探讨
从吸附等温线(图5)可知,Cr(VI)可在LDO上发生强烈吸附。由图2和3可知,LDO吸附Cr(VI)后形成产物的FT-IR和XRD图谱与焙烧前LDHs的FT-IR和XRD图谱基本一致,表明LDO经吸附溶液中的水和铬酸根阴离子而恢复了LDHs结构。但对产物的吸附强度明显低于LDHs,表明其结晶度显著低于LDHs,且吸附产物的003峰比焙烧前LDHs的003峰向小角度方向发生了明显位移:前者 d003值(层间距)为 10.1Å,后者 d003值为 7.7Å。而LDHs层板的厚度大约为4.8Å[20],即吸附前后的通道高度分别约为2.9和5.3Å,层间距的增大证明铬酸根阴离子插入了LDHs的层间。
同时,由于结构重建形成的LDHs表面带正电荷,因此可通过静电引力吸引铬酸根阴离子,随着pH的增加,LDHs表面净正电荷减少,吸附量减少,但在pH=11左右(pHIEP约为11,pH=11时LDHs表面净正电荷基本为零),仍有明显吸附(吸附量为52mg/g)(图6),说明除了静电引力外,铬酸根阴离子与LDHs表面功能基团有化学键合作用。另外,铬酸根阴离子在pH=1~6范围内主要以存在,而pH>7时主要以存在[21]。因此,随着pH的增大,铬酸根阴离子将从转变为,即平均单个Cr(VI)离子吸附所占据的面积明显增大,故吸附量也降低。温度升高减弱静电作用和化学键合作用,因此吸附量随温度升高而降低(图5)。无机电解质的加入可产生两种影响:一方面屏蔽铬酸根阴离子和LDHs的静电作用力;另一方面电解质阴离子与铬酸根阴离子产生竞争吸附,因此,随着无机电解质浓度的增加,Cr(VI)在LDO上的吸附量降低。
3 小结
Mg-Al LDHs的焙烧产物 LDO 对 Cr(VI)具有很强的吸附能力,其吸附动力学和吸附等温线分别符合准二级速率方程和Langmuir方程,饱和吸附量达 72.5 mg/g,是一种优良的含 Cr(VI)污水的处理剂。在初始pH=5~11范围内,吸附量随pH的增加而降低。吸附量随温度升高而降低。无机电解质NaCl的添加能明显抑制Cr(VI)在LDO上的吸附,随着电解质NaCl浓度的增加,Cr(VI)在LDO上的吸附量明显降低。
[1]Cavani F,Trifiro F,Vaccari A.Hydrotalcite-type anionic clays:Preparation,properties and applications[J].Catal.Today,1991,11(2):173-301.
[2]Khan A I,O'Hare D.Intercalation chemistry of layered double hydroxides:recent developments and applications[J].J.Mater.Chem.,2002,12(11):3191-3198.
[3]Rives V.Layered Double Hydroxides:Present and Future[M].New York:Nova Science Publishers,2001.
[4]Das N N,Konar J,Mohanta M K,et al.Adsorption of Cr(VI) and Se(IV) from their aqueoussolutionsontoZr4+-substituted ZnAl/MgAllayered double hydroxides:effect of Zr4+substitution in the layer[J].J.Colloid Interf.Sci.,2004,270(1):1-8.
[5]Patricia A T.Characterization of Cr ion exchange with hydrotalcite[J].Chemosphere,2004,57:541-546.
[6]Dadwhal M,Sahimi M,Tsotsis T T.Adsorption isotherms of arsenic on conditioned layered double hydroxides in the Presence of Various Competing Ions[J].Ind.Eng.Chem.Res.,2011,50(4):2220-2226.
[7]朱玲,梁存珍,於俊杰等.CuAl水滑石衍生物吸附Cr(VI)的性能研究[J].环境科学与技术,2010,33(5):39-42.
[8]臧运波,侯万国,王文兴.Cr(VI)在 Mg-Al型类水滑石上的吸附-脱附性研究 I.吸附性[J].化学学报,2007,65(9):773-778.
[9]Seida Y,Nakano Y.Removal of humic substances by layered double hydroxide containing iron[J].Water Res.,2000,34(5):1487-1494.
[10]Celis R,Koskinen W C,Cecchi A M,et al.Sorption of the ionizable pesticide imazamox by organo-clays and organohydrotalcites[J].J.Environ.Sci.Health B,1999,34(6):929-941.
[11]Villa M V,Sanchez-Martin M J,Sanchez-Camazano M.Hydrotalcites and organo-hydrotalcites as sorbents for removing pesticides from water[J].J.Environ.Sci.Health B,1999,34(3):509-525.
[12]Barriga C,Gaitan M,Pavlovic I,et al.Hydrotalcites as sorbent for 2,4,6-trinitrophenol:influence of the layer composition and interlayer anion[J].J.Mater.Chem.,2002,12(4):1027-1034.
[13]You Y W,Vance G F,Zhao H T.Selenium adsorption on Mg-Al and Zn-Al layered double hydroxides[J].Applied Clay Science,2001,20(1-2):13-25.
[14]ÁIvarez-Ayuso E,Nugteren H W.Purification of chromium (VI) finishing wastewa ters using calcined and uncalcined Mg-Al-CO3-hydrotalcite[J],Water Res.,2005,39(12):2535-2542.
[15]Lazaridis N K,Asouhidou D D.Kinetics of sorptive removal of chromium(VI) from aqueous solutions by calcined Mg-Al-CO3hydrotalcite[J],Water Res.,2003,37(12):2875-2882.
[16]Martínez-Gallegos S,Bulbulian S.Neutron activation analysis for chromium(III)and(VI)in lixiviat ed liquid through a calcined chromium(VI)adsorbed hydrotalcite[J],J.Radioanal.Nucl.Chem.,2005,266(2):285-287.
[17]You YW,Zhao H T,Vance G F.Adsorption of dicamba (3,6-dichloro-2-methoxy benzoic acid)in aqueous solution by calcined-layered double hydroxide[J].Appl.Clay Sci.,2002,21(5-6):217-226.
[18]Rives V,Characterisation of layered double hydroxides and their decomposition products[J].Mater.Chem.Phys.,2002,75(1-3):19-25.
[19]Izumi Y,Kiyototaki F,Minato T,et al.X-ray adsorption fine structure combined with fluorescence spectrometry for monitoring trace amounts of lead adsorption in the enviornmental conditions[J],Anal.Chem.,2002,74(15):3819-3823.
[20]Aisawa S,Ohnuma Y,Hirose K,et al.Intercalation of nucleotides into layered double hydroxides by ion exchange reaction[J].Appl.Clay Sci.,2005,28(1-4):137-145.
[21]武汉大学,吉林大学.无机化学[M].北京:高等教育出版社,1994.958.
Adsorption of Cr(VI) on Calcined M g-Al Layered Double Hydroxides
LIYan,LIChang-hao and YANG Guo-qing
(Department of Chemistry Changzhi University,Changzhi Shanxi 046000)
Mg-Al layered double hydroxides(LDHs)was prepared by coprecipitation method,and the LDHswas transformed into the Mg-A1-Omixed oxide type(LDO)by being calcined at 450℃.Mg-Al LDHs and LDO were characterized by TEM,XRD,FT-IR and particle size analysis,respectively.The adsorption behavior of Cr(VI)on Mg-A1 LDO was investigated.The results indicated that the adsorption kinetics and the adsorption isotherm of Cr(VI)on Mg-A1 LDO can be described by the pseudo-second order kinetic and Langmuir isotherm,respectively.The adsorption amounts of Cr(VI)decreased with the increasing pH in the initial pH rang of 5.00-11.00,the increasing temperature and the increasing electrolyte(NaCl)concentration.The adsorptionmechanism of Cr(VI) on Mg-A1 LDO was discussed.The LDO will be a new kind of highly effective adsorbent for Cr(VI)pollution.
Calcined layered double hydroxide;chromium(VI);adsorption;structure reconstruction
O647.3
A
1673-2014(2011)05-0012-06
2011—04—28
山西省高校科技开发项目(20091038)和2010年山西省普通高等本科学校大学生创新性实验项目资助。
李 燕(1975— ),女,河南沁阳人,博士,副教授,主要从事胶体与界面化学研究。
(责任编辑 王璟琳)
