废弃食用油脂生产单细胞蛋白的研究
2011-01-10聂麦茜
张 飞,聂麦茜
废弃食用油脂(Waste edible oils,WEOs)是指餐饮业、食品加工业在生产经营活动中产生的不能再食用的动植物油脂,包括油脂使用后产生的不可再食用的油脂(如炸制老油、火锅油等),含油脂废水经油水分离器或者隔油设施分离出的不可再食用的油脂[1]。近年来,废弃食用油脂流入食品市场所造成的危害已经引起人们的高度重视。单细胞蛋白(Single cell protein,SCP),亦称微生物蛋白或菌体蛋白,主要是指利用酵母、细菌、真菌和某些低等藻类等微生物,在适宜基质和条件下进行培养获得微生物菌体,然后从菌体中提取的蛋白质[2]。单细胞蛋白的开发与生产为解决动物饲料和人类食品问题开辟了新途径。因此,将废弃食用油脂生物转化成富含营养的单细胞蛋白,既可减轻环境压力,又能产生良好的经济效益。
1 材料与方法
1.1原料
废弃食用油脂由校学生食堂提供。试验前做预处理:将废弃煎炸油冷却至室温,沉淀48 h后,过滤以除去上层泡沫和下层固体杂质[3]。处理后的样品作为微生物利用的碳源。经测定,油密度为0.873 g/mL.
1.2 菌种来源与筛选
前期从陕北石油污染土壤中经富集、分离、纯化得到的石油烃降解菌,由本实验室保存。以废弃食用油脂为碳源,分别将菌株摇瓶培养,取3个平行样,测其培养前后发酵液的光密度(OD)差值,选取OD差值最大的菌种做后续研究。
1.3 SCP生产试验
1.3.1 培养基的制备
斜面培养基:牛肉膏蛋白胨固体培养基[4]。种子培养基:成分同斜面培养基,不加琼脂。
发酵培养基:无机盐培养基[5]成分如下:磷酸盐缓冲液:K2HPO4·3H2O 81.22 g,NaH2PO4· 2H2O 42.9 g,用NaOH调pH为7.5,蒸馏水定容至1 000 mL;1 mol/L MgSO4溶液;1 mol/L CaCl2溶液;取上述磷酸盐缓冲液25.0 mL,MgSO4溶液0.5 mL,CaCl2溶液 0.1 mL,微量元素溶液1.0 mL,1.0 g NH4NO3,定溶至1 000 mL。于121℃蒸汽灭菌20 min,备用。
1.3.2 培养过程
(1)种子扩大培养:挑取冷藏的斜面菌种,接种于装有100 mL种子培养基的250 mL锥形瓶内,于30℃、200 r/min摇床培养24 h,制成菌悬液备用。
(2)发酵培养:移取一定量种子菌悬液,接入50 mL发酵培养基中,纱布封口,于30℃、200 r/min摇床培养。每个条件采用3个平行样同时培养,测定值取平均值。
(3)菌体的收获:将发酵培养液于8 000 r/min下离心10 min,收集菌体用蒸馏水洗3次,105℃烘箱中烘干。
1.4 分析项目及方法
1.4.1 细胞产量的测定
以每升培养液细胞干质量表示[6]。取发酵培养液40 mL,于8 000 r/min下离心10 min,收集菌体,用蒸馏水洗涤3次,再离心,最后一次菌体用少量蒸馏水洗至已称重的坩埚内,105℃ 烘箱中烘至恒重,称量。
1.4.2 蛋白质含量的测定
采用常量凯氏定氮法[7]:称取菌体产品0.1 g置于500 mL凯氏烧瓶中,加入0.2 g硫酸铜(CuSO4·5H2O),6 g硫酸钾,10 mL浓硫酸和数粒玻璃珠。置通风柜内加热煮沸至产生三氧化硫白烟,待溶液变澄清且呈绿色后继续消解15 min,放冷,将消解液全部转入250 mL容量瓶中,用蒸馏水定容。量取100 mL消解液至凯氏瓶中,加入20 mL 40%氢氧化钠,迅速连接氮球和冷凝管,用50 mL 2%硼酸溶液(加2滴甲基红-亚甲基蓝混合指示剂)吸收,摇动凯氏烧瓶使溶液充分混合,加热蒸馏至冷凝管流出液为中性为止。馏出液用硫酸标准溶液(1/2H2SO4= 0.01 mol/L)滴定至绿色转变至淡紫色为止。
粗蛋白含量用下式计算:
式中:
V2——滴定样品时消耗硫酸溶液体积,mL;
V1——空白试验消耗硫酸溶液体积,mL;
C——经标定的硫酸溶液浓度,mol/L;
W——样品质量,g。
1.4.3 测试方法
1.5 发酵条件研究
1.5.1 单因素试验
分别考察了5种因素(培养基初始pH值、碳源投加量、氮源种类、发酵时间、碳氮比)对单细胞蛋白产量的影响,对每个因素进行了单因子试验。
1.5.2 正交试验
为了寻找试验菌种的最佳发酵条件,在单因素试验的基础上对pH值、碳源投加量、氮源及发酵时间进行了正交试验。每个因素设计了3个水平,采用L9(34)正交表进行试验,对发酵条件进行优化。
2 试验结果与讨论
2.1 菌种筛选
为筛选出能够较好利用废弃食用油脂的菌种,将本实验室保存的10株细菌进行摇瓶发酵培养,培养条件为:氮源NH4NO3浓度1 g/L,碳源投加量4%,培养基pH值7.5,30℃摇床培养48 h。测定培养液的OD差值,结果如表1所示。
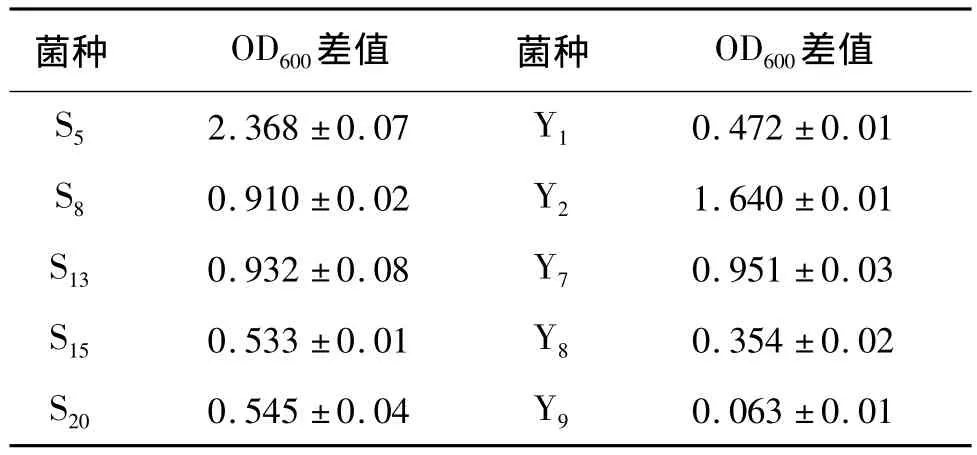
表1 细菌对废弃食用油脂的利用情况
从表1看,S5菌株细胞增殖最多,这说明S5菌株能够较好地利用废弃食用油脂生产单细胞蛋白。且从同课题组得知,S5菌株在生长过程中可产生鼠李糖脂生物表面活性剂,这种表面活性剂能使油脂较好地分散于培养体系中,促进细菌对碳源的利用。因此,选取S5菌株作为发酵生产单细胞蛋白的最适菌种。
不少家庭服务企业表示,河北省家政服务人员的输出,多采用“单兵作战”模式,河北与京津家庭服务企业间的合作较少,致使河北省家政服务人员的输出呈现“小、散、乱”的现象,就业不稳定,市场难规范。
2.2 单因素试验
2.2.1 碳源投加量对发酵过程中细胞产量的影响
碳源是发酵培养基中的主要成分,碳源投加量对细胞产量有一定影响。试验比较了体积分数为2%~10%的5种不同投加量的废弃煎炸油对细胞产量的影响,结果见图1。

图1 碳源投加量对细胞产量的影响
从图1可以看出,4%(约35 g/L)的碳源投加量可得到最高的细胞产量,这与之前Zhu等人的研究结果相近[3]。油的投加量过小,供微生物生长的碳源不足,投加量过大,过多的油脂造成培养液中的溶解氧含量降低,S5为好氧细菌,过低的溶解氧会抑制其生长。
2.2.2 发酵时间对发酵过程中细胞产量的影响
图2为S5菌株在培养过程中生物量随发酵时间的变化情况。由图2可知,菌体浓度在30 h至72 h趋于稳定,此时微生物生长处于静止期,72 h后进入衰亡期。为节省能源,可取48 h为最佳发酵时间。pH总体呈下降趋势,说明该发酵过程是一个产酸过程。

图2 发酵时间对细胞产量的影响
2.2.3 不同氮源对发酵过程中细胞产量的影响
氮源提供微生物合成蛋白质所需的原料。本试验对比了5种无机氮源对细胞产量的影响(图3),结果显示,氮源为硝酸钾时的细胞产量最大,且相比于铵态氮,硝态氮更有利于细菌生长。

图3 不同氮源对细胞产量的影响
2.2.4 培养基初始pH对发酵过程中细胞产量的影响
大多数细菌的pH适应范围在4~10之间,一般要求中性和偏碱性。从图4看,细菌S5在利用废弃食用油脂发酵生产单细胞蛋白时,在pH 6~10范围内均可生长,在pH 9时可获得最高的细胞产量。可见,S5的pH适应范围较大,在偏碱性和碱性条件下生长较好。

图4 初始pH对细胞产量的影响
2.2.5 碳氮比对发酵过程中细胞产量的影响
不同微生物细胞的元素组成比例不同,对各营养元素的比例要求也不同,这里主要指碳氮比(或碳氮磷比)。从图5看,细菌S5在C/N(废弃食用油与KNO3的质量比)为3∶1时细胞产量达到最大(此时硝酸钾浓度为11.6 g/L),可产生5.5 g/L的干细胞物质。因此,S5菌在以硝酸钾为氮源时,最佳C/N为3∶1。

图5 C/N对细胞产量的影响
2.3 正交试验
正交试验的设计见表2。正交试验结果及其统计学分析如表3所示。
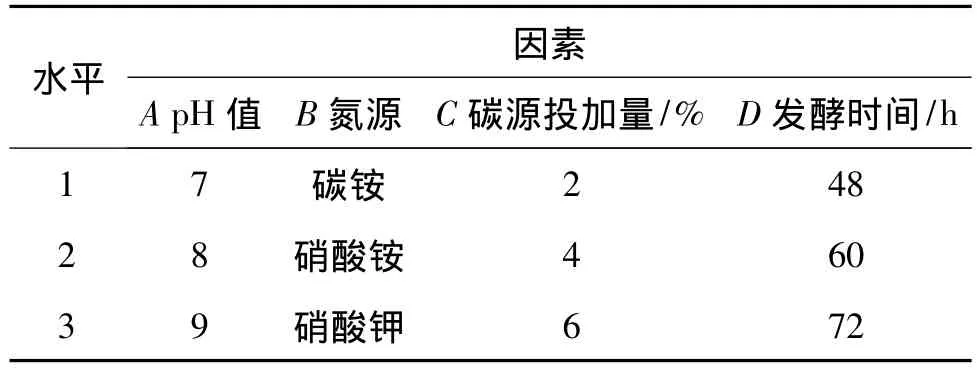
表2 正交试验水平与因素

表3 L9(34)正交试验结果
从表3可以看出,4个因素对S5菌株发酵生产单细胞蛋白影响的主次顺序为:氮源种类>碳源投加量>发酵时间>pH值。从中确定最优化组合为A3B3C2D1,即最优培养条件为:初始pH值9,氮源为硝酸钾,碳源投加量4%,发酵时间48 h。
2.4 蛋白质含量
单细胞蛋白可以被用来补充食物中的蛋白质,从而替代价格较高的传统蛋白质来源,如豆粉、鱼粉等,缓解蛋白质缺乏问题。有关文献表明,利用酵母菌生产的SCP的蛋白质含量为30%~60%,而利用细菌所产蛋白含量较高,可为50%~80%,氨基酸含量也较高[9-10]。
将不同氮源条件下培养得到的S5菌体烘干,采用凯氏定氮法测定粗蛋白含量,所得结果如表4所示。
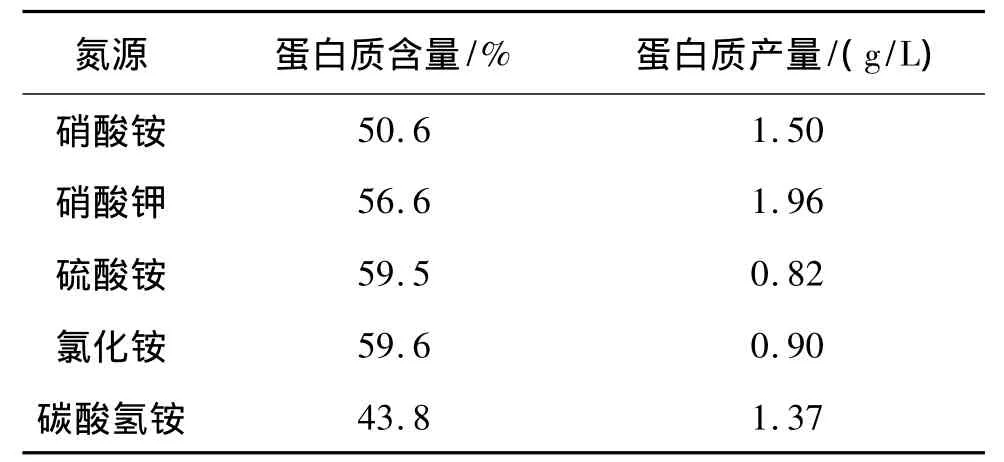
表4 S5在不同氮源条件下的粗蛋白含量
结果表明,S5菌以氯化铵和硫酸铵为氮源生产的SCP粗蛋白含量最高,分别为59.6%和59.5%。结合2.2.3结果,经计算得到这5种氮源生产的SCP的粗蛋白产量(表4),S5菌以硝酸钾为氮源时的蛋白质产量最高,虽然用氯化铵作氮源可以得到蛋白含量较高的SCP,但其细胞产量低,蛋白质产量也较低。
3 结论
S5菌株可作为利用废弃食用油脂发酵生产单细胞蛋白的最适菌种,最佳发酵条件为:培养基初始pH 9,碳源投加量4%(体积比),氮源为硝酸钾,C/N为3∶1,发酵时间48 h。细胞产量可达5.5 g/L,收获SCP产品的蛋白质含量为43.8%~59.6%。
[1]黄翔峰,陈旭远,刘佳,等.废弃食用油脂生物合成鼠李糖脂研究进展[J].微生物学通报,2009,36(11): 1738-1743.
[2]齐银霞,成坚,刘长海.利用废弃资源发酵生产单细胞蛋白的研究进展[J].食品工业科技,2009,30(5):366-368.
[3]Zhu Y,Gan J J,Zhang G L,et al.Reuse of waste frying oil for production of rhamnolipids using Pseudomonas aeruginosa zju.u1M[J].Journal of Zhejiang University-Science A,2007,8(9):1514-1520.
[4]周群英,高廷耀.环境工程微生物学[M].2版.北京:高等教育出版社,2000:124-126.
[5]王蕾,聂麦茜,王志盈.多环芳烃降解菌的筛选及其对芘的降解研究[J].环境科学与技术.2010,33(1):43 -47.
[6]李建政,张平,鲍立新,等.大豆乳清废水发酵生产单细胞蛋白的酵母[J].哈尔滨工业大学学报,2009,41 (2):48-52.
[7]马丹.凯氏定氮法测定食品中蛋白质含量[J].计量与测试技术,2008,35(6):57-58.
[8]付源,李建政,鲍立新,等.大豆蛋白废水生产单细胞蛋白的菌种选择及其培养条件[J].科技导报,2007,25 (11):9-13.
[9]梁耀相.利用工业废水、废渣开发饲用SCP的研究[J].宁波职业技术学院学报,2001(2):100-102.
[10]Anupama P Ravindra.Value-added food:Single cell protein[J].Biotechnology Advances,2000,18:459–479.
