一种中国南海枝网刺柳珊瑚次级代谢产物研究*
2011-01-10侯改芳李秀保邵长伦管华诗魏玉西王长云
赵 杰,侯改芳,李秀保,邵长伦,刘 洋,管华诗,魏玉西,王长云**
(1.中国海洋大学医药学院,海洋药物教育部重点实验室,山东青岛266003;2.中国科学院南海海洋研究所,广东广州510000;3.青岛大学生物系,山东青岛266071)
自从Weinheimer等人于1969年从柳珊瑚中发现丰富的具有独特结构和强烈生物活性的前列腺素类化合物以来[1],柳珊瑚化学成分的研究成为海洋天然产物研究的1个热点。近年来对柳珊瑚的研究仍很活跃,仅在2006—2008年3 a间,从不同种属的柳珊瑚中发现新化合物200余个[2-4],包括甾体、萜类、前列腺素类和生物碱等结构类型,大多数具有克生、抗炎、抗肿瘤、抗菌、抗氧化等活性。
枝网刺柳珊瑚Echinogorgia sassapo reticulata(Esper)属珊瑚虫纲(Anthozoa),八放珊瑚亚纲(Octocorallia),柳珊瑚目(Dendrophylliidae),类尖柳珊瑚科(Paramuriceidae),刺柳珊瑚属(Echinogorgia)。该属柳珊瑚化学成分的研究报道比较少[5-8]。目前为止,从Echinogorgia属中发现的化学成分主要有倍半萜、多羟基甾醇、酯类等。本研究组已对采自海南岛东岸万宁海域的枝网刺柳珊瑚E.sassapo reticulata的化学成分进行了研究[8],本文对采自海南岛西岸临高海域的同种柳珊瑚进行了进一步研究,从其提取物的乙酸乙酯相中分离得到13个单体化合物,包括3个核苷类化合物(1-3),1个碱基类化合物(4),2个甘油醚类化合物(5-6),1个倍半萜类化合物(7),2个苯衍生物类化合物(8-9),以及4个甾醇类化合物(10-13)。并对化合物1-3进行了活性测试。
1 材料与方法
1.1 材料与试剂
实验材料:枝网刺柳珊瑚Echinogorgia sassapo reticulata(Esper)样品于2006年采自海南临高新盈镇海域。由中国科学院南海海洋研究所黄晖研究员鉴定,样品(HN-LCJ-20060032)存于中国海洋大学海洋药用生物资源标本室。
实验试剂:石油醚(60~90℃)、氯仿、乙酸乙酯、丙酮、正丁醇、冰醋酸、二氯甲烷等均为分析纯,甲醇为分析纯和色谱纯。柱层析硅胶100~200目,200~300目;硅胶GF254为分析纯。
显色剂:香草醛-浓硫酸(15%浓硫酸的香草醛饱和溶液);10%硫酸的乙醇溶液;碘。
1.2 实验仪器
JEOLJNM-ECP600型核磁共振波谱仪(600 M Hz)(日本电子);M icromass Q-TOF型质谱仪(美国Waters公司);Agilent 6890GC/5973MS色质联用仪;ZF-I型三用紫外分析仪(上海顾村电光仪器厂);Nicolet Nexus 470型红外波谱仪(Thermo Electron公司);高效液相色谱仪(w aters公司)(1525泵,2996二极管阵列检测器,717自动进样器);Kromasil C18柱:7μm,10 mm×250 mm(瑞典Eka公司);LABOROTA 4000-efficient旋转蒸发仪(德国Heidoph公司);BP121S万分之一电子天平(Sarto rius公司);柱层析硅胶与正相薄层层析板(青岛海洋化工厂);反相RP-18层析硅胶板(德国Merck公司);Sephadex LH-20凝胶色谱填料(Amersham Pharmacia Biotech中国分装);层析用玻璃减压色谱柱(天津Synthw are公司)。
1.3 提取与分离
取冷冻枝网刺柳珊瑚样品(1 200 g)进行粉碎,用95%乙醇和氯仿-甲醇混合液(1∶1)各浸提3次,每次1 d并超声1 h。将提取液旋转蒸发至干,用10倍量的甲醇脱盐3次,减压浓缩得总浸膏(10.2 g)。浸膏用水稀释后,用二倍体积的乙酸乙酯萃取6次,减压浓缩萃取液得到乙酸乙酯相浸膏(4.0 g)。对乙酸乙酯相进行了卤虫致死活性及斑马鱼胚胎毒性测定,发现其具有弱的卤虫致死活性。
乙酸乙酯相先经正相减压硅胶柱层析(VLC),石油醚-乙酸乙酯梯度洗脱,得到8个组分(1~8)。经过硅胶、Sephadex L H-20、反相硅胶ODS柱层析,以及高效液相色谱分离,从组分4得到化合物7(4.5 mg)和13(25.4 mg);从组分5得到化合物5(6.7 mg);从组分6得到化合物6(5.5 mg),10(2.1 mg),11(2.3 mg)和12(2.8 m g);从组分7得到化合物1(15.7 mg),2(10.3 mg),3(8.9 mg)和4(7.8 mg);从组分8得到化合物8(3.5 mg)和9(2.8 m g)。
1.4 卤虫致死活性实验
卤虫致死活性实验依照Solis的改良法[9-10]。卤虫致死活性采用校正死亡率表示:
校正死亡率%=[(DM SO对照组存活率-样品组存活率)/DMSO对照组存活率]×100%。
空白对照组(海水)的情况用于观察自然条件下卤虫的状态,跟踪、判断实验情况。
1.5 斑马鱼胚胎毒性模型试验
斑马鱼胚胎毒性模型试验参照文献方法进行[11-12]。采用Excel 2003对实验数据进行处理;用SPSS17.0软件计算各化合物对受试生物的毒性。
2 结果与讨论
2.1 结构鉴定
化合物1 白色固体,香草醛硫酸溶液显色为橘红色,在紫外灯λ256 nm下有暗斑。ESI-M S m/z:245[M+H]+。IR谱显示分子中含有羟基或氨基(3 500~3 000 cm-1)、C=C双键(1 690 cm-1)、C=N双键(1 601 cm-1);结合1H NM R、13C NM R谱确定其分子式为C9H12N2O6,不饱和度为5。化合物的13C NM R谱和DEPT谱在δC164.5,151.7处显示2个季碳信号,在δC142.3,102.6处显示2个CH信号,连同1H NM R谱中可观测到的δH11.35(brs)处的1个H信号,δH7.87(d,J=7.8 Hz),5.63(d,J=7.8 Hz)2个相关的氢信号,可以推测化合物中含有尿嘧啶片段。1H NM R中δH4.01(dd,J=6.0,4.8 Hz),3.96(dd,J=4.8,4.2 Hz),3.83(1H,m),3.61(1H,m),3.55(1H,m)的连氧氢信号结合13C NMR中的δC88.6,85.5,74.3,70.5,61.4的连氧碳信号提示化合物中含有糖基片段。以上数据结合文献报道,鉴定该化合物为尿嘧啶核糖核苷(uridine)[13]。
化合物2 白色粉末,香草醛硫酸溶液显色为蓝色,在紫外灯λ256 nm下有暗斑。ESI-M S m/z:229[M+H]+。其氢谱与化合物1极为相似。与化合物1相比,化合物2缺少了δH4.01(dd,J=6.0,4.8 Hz)的氢信号,而多出了δH2.08(m)的2个氢信号,提示化合物的C-2’位没有被羟基取代。以上数据与文献对照,鉴定化合物为2’-脱氧尿嘧啶核苷(2’-de-oxyuridine)[14]。
化合物3 羽状无色结晶,香草醛硫酸溶液显色为蓝色,在紫外灯λ256 nm下有暗斑。ESI-MS m/z:243[M+H]+。其氢谱和碳谱都与化合物2极为相似。与化合物2相比,化合物3的13C NM R中δC12.3处多出1个甲基信号,而且双键上的碳信号由δC102.6的CH信号变化为δC109.4的季碳信号,说明化合物双键上C-5位的氢被甲基取代。1H NMR中化合物3比化合物2缺少了δH5.63(d,J=7.8 Hz)的氢信号,而多出了δH1.78(s)的1个甲基信号,验证了以上的推论。综合以上信息并与文献对照,鉴定化合物为2’-脱氧胸腺嘧啶核苷(2’-deoxythymidine)[15-17]。
化合物4 淡黄色固体,香草醛硫酸溶液无显色,在紫外灯λ256 nm下有暗斑。ESI-M S m/z:113[M+H]+。IR显示有NH(3 017 cm-1)、C=O(1 695 cm-1)、C=C(1 603 cm-1)。1H NMR中有δH11.0(brs),10.92(brs),表明化合物中含有2个连氮的氢;13C NM R中有δC164.5,151.6,表明化合物中含有羰基。将以上数据与文献报道的尿嘧啶比较,确定化合物为尿嘧啶(uracil)[13]。
化合物5 白色固体,香草醛硫酸溶液显色为紫红色。ESI-M S m/z:345[M+H]+。IR显示有2个OH(3 410,3 389 cm-1)。1H NM R中可观测到δH3.86(1H,m),3.71(dd,J=11.4,3.6 Hz),3.65(dd,J=11.4,5.4 Hz),3.53(dd,J=9.0,3.6 Hz),3.49(dd,J=9.0,6.6 Hz),3.45(m)的连氧的氢信号,推测化合物为有甘油的结构,且1个羟基被醚化。δH0.87(t,J=7.2 Hz)的三重甲基峰信号,以及δH1.26附近的CH2信号,表明化合物具有1个长链结构。以上数据提示化合物为单链被醚化的甘油醚,由δH1.26(m)的氢信号的积分值30,结合文献可推测化合物为batyl alcohol[18]。
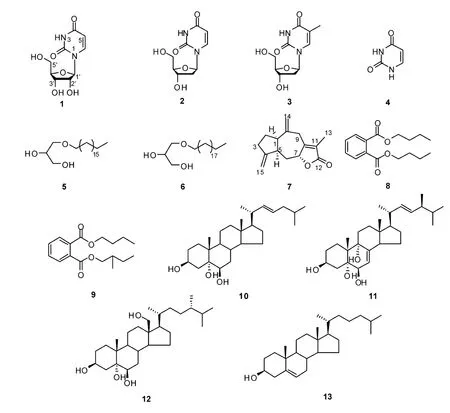
化合物6 白色固体,香草醛硫酸溶液显色为紫红色。ESI-M S m/z:373[M+H]+。NM R谱与化合物5极为相似,只是在δH1.25(m)的氢信号的积分值为34,可推测化合物6也为甘油醚类化合物,脂肪链的链长与化合物5不同。结合文献可推测化合物为1-O-eicosanylglycerol[19]。
化合物7 无色油状液体。香草醛硫酸溶液显色为黄色。ESI-M S m/z:231[M+H]+。其1H NMR谱在低场给出4个末端双键质子信号δH5.15(s),5.10(s),5.04(s),4.96(s),在高场给出1个甲基信号δH1.86(s)。结合文献报道,确定化合物为11,13-dihydro-7,11-dehydro-3-desoxy-zaluzalanin C[20]。
化合物8 无色油状物。香草醛硫酸溶液无明显显色,在紫外灯λ256 nm下有暗斑。ESI-M S m/z:301[M+Na]+。在1H NM R低场芳香区观测到2个质子信号δH7.72(dd,J=3.0,5.4 Hz),7.68(dd,J=3.0,5.4 Hz),可判断芳环为1,2-邻位取代且为对称结构。δH4.30(m)为与氧相连的CH2信号,δH0.96(t,J=7.8 Hz)为1个甲基信号。综合以上分析,并与文献对照,可确定化合物为邻苯二甲酸二丁酯[21]。
化合物9 无色油状物。香草醛硫酸溶液无明显显色,在紫外灯λ256 nm下有暗斑。ESI-M S m/z:315[M+Na]+。由在1H NMR低场芳香区观测到的2个质子信号δH7.73(dd,J=3.0,5.4 Hz),7.69(dd,J=3.0,5.4 Hz),可判断芳环为1,2-邻位取代。δH4.30(m)和4.21(m)为与氧相连的CH2信号,表明化合物不是对称结构,所连接的2条链不一样。δH0.96(t,J=7.2 Hz),0.92(t,J=7.2 Hz),0.86(d,J=7.2 Hz)为3个甲基信号;综合以上分析,并与化合物8比较,可确定化合物为邻苯二甲酸1-(2-甲基-丁基)酯-2-丁酯[22]。
化合物10 白色针状晶体,香草醛硫酸溶液显色为蓝绿色。ESI-MS m/z:419[M+H]+。1H NMR中在低场区有δH5.24(m)和5.17(m)2个双键氢信号。在δH3.78(m)和3.74(d,J=3.6 Hz)的连氧氢信号以及在高场区δH0.97(d,J=6.6 Hz),0.85(s),0.83(d,J=6.6 Hz),0.82(d,J=6.6 Hz),0.58(s)的甲基信号,均符合多羟基甾醇的特征。结合TLC以及文献推断该化合物为(22E)-5α-cholest-22-ene-3α,5α,6β-triol[23]。
化合物11 白色针状晶体,香草醛硫酸溶液显色为蓝绿色。ESI-M S m/z:469[M+H]+。IR显示羟基吸收(3 392 cm-1)。在低场区的δH5.19(m)及5.07(d,J=5.4 Hz)3个双键氢信号表明化合物中含有2个双键。由在高场区在δH0.98(d,J=6.6 Hz),0.90(s),0.88(d,J=6.6 Hz),0.79(d,J=6.6 Hz),0.81(d,J=6.6 Hz),0.54(s)的甲基信号以及在3.82(m)和3.50(brs)的连氧氢信号,可推测化合物为多羟基甾体类化合物。结合TLC及文献以推断该化合物为(22E,24S)-24-M ethyl-5α-cholesta-7,22-diene-3β,5α,6β,9-tetraol[24]。
化合物12 白色针状晶体,香草醛硫酸溶液显色为蓝绿色。ESI-MS m/z:473[M+Na]+。在低场区有δH4.69(d,J=11.4 Hz),3.40(d,J=11.4 Hz)的2个连氧氢信号,提示化合物中含有1个CH2OH,在δH3.93(m)和3.37(m)的连氧氢信号,在高场区的δH0.99(d,J=6.6 Hz),0.97(s),0.92(d,J=6.6 Hz),0.81(d,J=6.6 Hz),0.79(d,J=6.6 Hz)的甲基信号可推测化合物为甾体类化合物。结合TLC以及文献推断该化合物为(24S)-methylene cholestane-3β,5α,6β,18-tetrol[25]。
化合物13 白色针状晶体,香草醛硫酸溶液显色为紫红色。ESI-M S m/z:409[M+Na]+。1H NM R低场区的δH5.37(t,J=3.0 Hz)双键氢信号,δH3.54(m)的连氧氢信号,在高场区的δH1.03(s),0.94(d,J=6.6 Hz),0.88(d,J=6.6 Hz),0.70(s)的甲基信号,结合TLC以及文献推断该化合物为胆甾醇[26]。
对3个核苷类化合物1、2和3进行了卤虫致死活性及斑马鱼胚胎毒性的测试。化合物在50μg/m L下对卤虫的致死率分别为10%、5%、5%,而在50μg/m L浓度下对斑马鱼胚胎均无明显毒性。
本研究从枝网刺柳珊瑚中分离得到13个化合物,化合物3和13与从采自万宁海域的枝网刺柳珊瑚E.sassapo reticulata中的化合物相同[8],表明,来自不同海区的柳珊瑚所含化合物有显著差异。其他11个化合物为首次从该属柳珊瑚中分离得到。此外,化合物9此前仅从烟草的挥发油中检测到[22],本研究首次作为天然产物单体化合物分离得到,并首次报道其波谱数据。化合物12仅从软珊瑚Lobophy tum crassum中分离到过[25],此次为首次从柳珊瑚中分离得到。
2 物理常数与波谱数据
化合物1 ESI-M S m/z:245[M+H]+;IR(KBr)νmax3 500~3 000,1 690,1 601 cm-1;1H NM R(DM SO-d6,600 M Hz)δ:11.35(NH,brs),7.87(1H,d,J=7.8 Hz,H-6),5.78(1H,d,J=5.4 Hz,H-l’),5.63(1H,d,J=7.8 Hz,H-5),5.38(1H,d,J=4.8 Hz,OH),5.11(1H,d,J=4.8 Hz,OH),4.01(1H,dd,J=6.0,4.8 Hz,H-2’),3.96(1H,dd,J=4.8,4.2 Hz,H-3’),3.83(1H,m,H-4’),3.61(1H,m,H-5’),3.55(1H,m,H-5’);13CNMR(DMSO-d6,150 M Hz)δ:164.5(C,C-4),151.7(C,C-2),142.3(CH,C-6),102.6(CH,C-5),88.6(CH,C-1’),85.5(CH,C-4’),74.3(CH,C-2’),70.5(CH,C-3’),61.4(CH2,C-5’)。
化合物2 ESI-M S m/z:229[M+H]+;1H NMR(DMSO-d6,600 M Hz)δ:11.27(1H,brs,H-3),7.85(1H,d,J=7.8 Hz,H-6),6.15(1H,t,J=7.2 Hz,H-1’),5.63(1H,d,J=7.8 Hz,H-5),5.25(1H,d,J=4.8 Hz,OH),5.01(1H,t,J=4.8 Hz,OH),4.23(1H,m,H-3’),3.78(1H,dd,J=7.1,3.8 Hz,H-4’),3.55(2H,dd,J=12.0,3.6 Hz,H-5’),2.08(2H,m,H-2’)。
化合物3 ESI-M S m/z:243[M+H]+;1H NMR(DM SO-d6,600 M Hz)δ:11.28(1H,s,H-3),7.70(1H,s,H-6),6.17(1H,t,J=6.9 Hz,H-1’),5.25(1H,d,J=4.8 Hz,OH),5.04(1H,t,J=4.8 Hz,OH),4.24(m,1H,H-3’),3.77(1H,q,J=3.6 Hz,H-4’),3.56(2H,m,H-5’),2.06(2H,m,H-2’),1.78(3H,s,H-7);13C NM R(DM SO-d6,150M Hz)δ:163.8(C,C-4),150.5(C,C-2),136.2(CH,C-6),109.4(C,C-5),87.3(CH,C-4’),83.8(CH,C-1’),70.5(CH,C-3’),61.4(CH2,C-5’),39.6(CH2,C-2’),12.3(CH3,C-7)。
化合物4 ESI-M S m/z:113[M+H]+;IR(KBr)νmax3 017,1 695,1 603 cm-1;1H NMR(DM SO-d6,600 M Hz)δ:11.0(1H,brs,NH),10.92(1H,brs,NH),7.39(1H,d,J=7.8 Hz,H-6),5.42(1H,d,J=7.8 Hz,H-5);13C NMR(DMSO-d6,150M Hz)δ:164.4(C,C-4),151.1(C,C-2),142.4(CH,C-6),100.3(CH,C-5)。
化合物5 ESI-M S m/z:345[M+H]+;IR(KB r)νmax3 410,3 389 cm-1;1H NM R(CDCl3,600 M Hz)δ:3.86(1H,m,H-2),3.71(1H,dd,J=11.4,3.6 Hz,H-1),3.65(1H,dd,J=11.4,5.4 Hz,H-1),3.53(1H,dd,J=9.0,3.6 Hz,H-3),3.49(1H,dd,J=9.0,6.6 Hz,H-3),3.45(2H,m,H-1’),1.60(2H,m,H-2’),1.26(30H,m,H-3’~H-17’),0.87(3H,t,J=7.2 Hz,H-18’)。
化合物6 ESI-M S m/z:373[M+H]+;1H NM R(CDCl3,600 M Hz)δ:3.87(1H,m,H-2),3.72(1H,dd,J=11.4,3.6 Hz,H-1),3.64(1H,dd,J=11.4,5.4 Hz,H-1),3.52(1H,dd,J=9.0,3.6 Hz,H-3),3.48(1H,dd,J=9.0,6.6 Hz,H-3),3.43(2H,m,H-1’),1.59(2H,m,H-2’),1.25(34H,m,H-3’~H-19’),0.88(3H,t,J=7.2 Hz,H-20’)。
化合物7 ESI-MS m/z:231[M+H]+;IR:1 763,1 670,1 640,900 cm-1。1H NMR(CDCl3,600 M Hz)δ:5.15(1H,brs,H-15),5.10(1H,brs,H-15),5.04(1H,brs,H-14),4.96(1H,brs,H-14),4.68(1H,d,J=2.4 Hz,H-6),2.94(1H,d,J=13.2 Hz,H-5),2.86(1H,m,H-1),2.56(2H,m,H-9),2.51(2H,m,H-3),2.24(1H,t,J=12.6 Hz,H-8),2.03(2H,m,H-2),1.85(1H,m,H-8),1.86(3H,s,H-13)。
化合物8 ESI-M S m/z:301[M+Na]+;IR(KBr)νmax3 046,2 960,2 929,2 876,1 730,1 520,1 382,1 122,1 073 cm-1;1H NM R(CDCl3,600 M Hz)δ:7.72(1H,dd,J=3.0,5.4 Hz,H-3),7.68(1H,dd,J=3.0,5.4 Hz,H-4),4.30(2H,m,H-5),1.63(1H,m,H-6),0.96(3H,t,J=7.8 Hz,H-11)。
化合物9 ESI-M S m/z:315[M+Na]+;1H NMR(CDCl3,600 M Hz)δ:7.73(2H,dd,J=3.2,5.4 Hz,H-2,2’),7.69(2H,dd,J=3.2,5.4 Hz,H-3,3’),4.30(2H,m,H-5),4.21(2H,m,H-5’),1.63(2H,m,H-6,6’),0.96(3H,t,J=7.2 Hz,H-11),0.92(3H,t,J=7.2 Hz,H-11’),0.86(3H,d,J=7.2 Hz,H-12)。
化合物10 ESI-M S m/z:419[M+H]+;1H NMR(DM SO-d6,600 M Hz)δ:5.24(lH,m,H-23),5.17(lH,m,H-22),4.30(IH,d,J=4.8 Hz,OH),4.15(1H,d,J=4.8 Hz,OH),3.78(1H,m,H-3),3.74(1H,d,J=3.6 Hz,H-6),3.63(1H,brs,OH),2.10(1H,m,H,-4),1.95(1H,m,H-20),1.88(1H,m,H-24),1.72(1H,m,H-4),1.61(1H,m,H-25),0.97(3H,d,J=6.6 Hz,H,-21),0.85(3H,s,H-19),0.83(3H,d,J=6.6 Hz,H-26),0.82(3H,d,J=6.6 Hz,H-27),0.58(3H,s,H-18)。
化合物11 ESI-M S m/z:469[M+H]+;IR(KBr)νmax3 392 cm-1;1H NM R(DM SO-d6,600 M Hz)δ:5.19(2H,m,H-22,H-23),5.07(1H,d,J=5.4 Hz,H-7),4.52(1H,d,J=4.8 Hz,OH),4.25(1H,d,J=4.8 Hz,OH),3.82(1H,m,H-3),3.62(1H,brs,OH),3.39(1H,brs,OH),3.50(1H,brs,H-6),2.20(1H,ddd,J=12.6,3.6,3.6 Hz,H-1),2.01(1H,m,H-20),1.95(1H,dd,J=13.2,14.4 Hz,H-4),1.90(2H,s,H-24),1.84(1H,m,H-2),1.66(1H,dd,J=13.2,6.0 Hz,H-4),1.62(1H,d,J=4.8 Hz,H-24),1.61(1H,m,H-15),1.54(1H,m,H-15),1.54(1H,m,H-2),1.47(1H,m,H-25),1.31(1H,m,H-1),0.98(3H,d,J=6.6 Hz,H-21),0.90(3H,s,H-19),0.88(3H,d,J=6.6 Hz,H-28),0.81(3H,d,J=6.6 Hz,H-26),0.79(3H,d,J=6.6 Hz,H-27),0.54(3H,s,H-18)。
化合物12 ESI-M S m/z:473[M+Na]+;1H NMR(DMSO-d6,600 M Hz)δ:4.69(1H,d,J=11.4 Hz,H-18),4.40(1H,d,J=11.4 Hz,H-18),4.30(1H,d,J=4.8 Hz,OH),4.16(1H,d,J=4.8 Hz,OH),3.76(1H,m,H-3),3.73(1H,m,H-6),3.62(1H,brs,OH),0.99(3H,d,J=6.6 Hz,H-21),0.97(3H,s,H-19),0.92(3H,d,J=6.6 Hz,H-28),0.81(3H,d,J=6.6 Hz,H-27),0.79(3H,d,J=6.6 Hz,H-26)。
化合物13 ESI-MS m/z:409[M+Na]+;1H NMR(CDCl3,600 M Hz)δ:5.37(1H,t,J=3.0 Hz,H-6),3.54(1H,m,H-3),1.03(3H,s,H-19),0.94(3H,d,J=6.6 Hz,H-21),0.88(6H,d,J=6.6 Hz,H-26,H-27),0.70(3H,s,H-18)。
[1] Weinheimer A J,Sp raggins R L.Chemistry of coelenterates.XV.The occurrence of two new p rostaglandin derivatives(15-epi-PGA 2 and its acetate,methyl ester)in the gorgonian Plexaura homomalla[J].Tetrahedron Lett.,1969,59:5185-5188.
[2] Blunt JW,Copp B R,Hu W P,et al.Marine natural p roducts[J].Nat Prod Rep,2008,25:35-94.
[3] Blunt JW,Copp B R,Hu W P,et al.Marine natural p roducts[J].Nat Prod Rep,2009,26:170-244.
[4] Blunt JW,Copp B R,Munro M H G,et al.Marine natural p roducts[J].Nat Prod Rep,2010,27:165-237.
[5] Tillekeratne L M V,De Sikva E D,Mahindaratne MPD,et al.Xanthyletin and xanthoxyletin f rom a gorgonian,Echinogorgia sp.[J].J Nat Prod,1989,52(6),1303-1304.
[6] Tanaka J I,Miki H,Higa T.Echinofuran,a new furanosesquiterpene from the gorgonian Echinogorgza praelonga[J].J Nat Prod,1992,55(10):1522-1524.
[7] Qiu Y,Qi S,Zhang S,et al.New polyoxygenated steroids from the South China Sea gorgonian Echinogorgia aurantiaca[J].Pharmazie,2006,61(7):645-647.
[8] 郭奇,魏玉西,王长云,等.枝网刺柳珊瑚Echinogorgia sassapo reticulata(Esper)的化学成分研究[J].中国海洋药物,2010,29(1):32-35.
[9] Solis PN,Wright CW,Anderson M M,et al.Amicro well cytotoxicity assay using A rtimiasalina(brine shrimp)[J].Planta Medica,1993,59(3):250-252.
[10] Meyer B N,Ferrigni N R,Putnam J E,et al.Brine shrimp:a convenient general bioassay for active plant constituents[J].Planta Medica,1982,45:31-34.
[11] Schulte C,and Nagel R.Testing acute toxicity in the embryo of zebra fish Brachy daniorerio.as an alternative to the acute fish test:Preliminary results[J].A TLA,1994,22:12-19.
[12] Strmac M,Braunbeck T.Effects of triphenyltin acetate on sur-vival,hatching success,and liver ultrastructure of early life stages of zebrafish(Daniorerio)[J].Ecotoxicol Environ Saf,1999,44(1),25.
[13] 周淑梅,周琨,肖定军.南海小束格海绵中的天然含氮化合物[J].中国海洋药物,2005,24(4):31-35.
[14] 邹峥嵘,易杨华,姚新生,等.海地瓜化学成分研究[J].中国天然药物,2004,2(6):348-350.
[15] 林文翰,马爱英,季宇彬.中国南海软珊瑚化学成分Sinularia sp.的研究[J].哈尔滨商业大学学报:自然科学版,2006,22(2):1-3.
[16] 廖小建,徐石海,黄启昌,等.海绵Callyspongia fibrosa的化学成分研究(I)[J].光谱实验室,2005,22(2):281-283.
[17] 饶志刚,邓松之,李凤英.南海软珊瑚Sarcophytonmolle化学成分的研究(一)[J].广州化学,1994,19(3):13-16.
[18] Radhika P,Rao V L,Laatsch H.Chemical constituents of amarine soft coral of the genus Lobophytum[J].Chem Pharm Bull,2004,52(11):1345-1348.
[19] Ouijano L,Cruz F,Navarrete I,et al.Alkyl glycerol monoethers in themarine sponge Desmapsamma anchorata[J].Lipids,1994,29(10):731-734.
[20] Bohlmann F,Van N L.Neue Guajanolide aus Podachaenium eminens[J].Phytochemistry,1977,16:1304-1306.
[21] 石瑛,田黎,王婧,等.海洋放线菌Micromonospora sp.与细菌Oceanospirillum sp.发酵液中化学成分的研究[J].中国海洋药物杂志,2006,25(1):6-10.
[22] Leffingwell J C,Alford ED.Volatile constituents of Perique tobacco[J].Electron J Environ Agric Food Chem,2005,4(2):889-915.
[23] Notaro G,Piccialli V,Sica D.3β,5α,6β-trihydroxylated sterols with a saturated nucleus from two populations of the marine sponge Cliona copiosa[J].J Nat Prod,1991,54(6):1570-1575.
[24] Migliuolo A,OtaroI,Piccialli V,et al.New Tetrahydroxylated sterols from the marine sponge Spongia officinalis[J].J Nat Prod,1990,53(6):1414-1424.
[25] Venkateswarlu Y,Rao R M,Ramesh P.A new polyhydroxy sterol from the soft coral Lobophytum crassum[J].J Nat Prod.1997,60:1301-1302.
[26] 黄建设,李庆欣,吴军,等.粗吻海龙的化学成分研究[J].中草药,2004,35(5):485-487.
