不同强度有氧运动对糖尿病大鼠肝脏炎症状态的影响
2011-01-02林文弢李品芳翁锡全
林文弢,李品芳,翁锡全
(广州体育学院,广东 广州 510500)
不同强度有氧运动对糖尿病大鼠肝脏炎症状态的影响
林文弢,李品芳,翁锡全29
(广州体育学院,广东 广州 510500)
为探讨不同强度有氧运动对糖尿病大鼠肝脏炎症状态的影响,为糖尿病的治疗提供新思路。通过高脂饲料喂养并注射链脲佐菌素的方法,建立SPF级雄性SD大鼠糖尿病模型,将造模成功后的43只大鼠随机分为:糖尿病安静对照组(DMC)10只,糖尿病运动1组(DME1)、糖尿病运动2组(DME2)、糖尿病运动3组(DME3)各11只。运动组大鼠分别在跑台上进行10、15和20 m/min的有氧运动,1 h/d,5 d/周,持续运动6周。实验第6周末检测糖代谢相关指标、血清与肝脏游离脂肪酸,以及反映炎症状态的肿瘤坏死因子(TNF-α),并对各指标进行 Person相关性分析。结果发现:各运动组FBG均出现极显著性下降(P<0.01);DME1、DME2组GSP下降具有统计学意义(P<0.05、P<0.01);DME3组FINS的上升具有显著性意义(P<0.05),且DME1、DME2与DME3组间差异也存在显著性(P<0.05);DME1、DME2组IRI出现显著性下降(P<0.05),而DME3组却显示上升(P>0.05),并且显著性或极显著性高于 DME1、DME2组(P<0.05、P<0.01);各运动组肝脏TNF-α均出现不同程度的下降,但只有DME2组具有统计学意义(P<0.01)。经Person相关性分析,肝脏TNF-α与FPG、IRI正相关。结果说明:6周的有氧运动能够降低糖尿病大鼠肝脏TNF-α含量,改善肝脏炎症状态,同时改善糖尿病大鼠的糖代谢紊乱和胰岛素抵抗,缓解糖尿病的发展。其中,中等强度有氧运动干预效果较好。
运动生物化学;糖尿病;肝脏炎症状态;肿瘤坏死因子-α;有氧运动;大鼠
近年研究表明,糖尿病患者机体存在低度慢性炎症[1],糖尿病慢性并发症与炎症因子增加密切相关[2]。大量的流行病学资料、临床试验、基础研究均证实慢性炎症参与了糖尿病发生、发展,并认为糖尿病不仅是一种高血糖疾病,也是一种炎症性疾病。抗炎治疗成为监测、预防和治疗糖尿病及其并发症的新策略。肝脏可产生多种炎症因子,是系统炎症介质的靶器官。糖尿病患者肝脏会出现以 TNF-α为代表的炎症因子的增多,导致肝脏炎症状态的出现。目前,关于运动抗炎作用的研究逐渐成为研究的热点,本研究通过不同强度有氧运动对糖尿病大鼠肝脏炎症状态的影响,探讨运动的抗炎症作用,为糖尿病的治疗提供新思路。
1 材料与方法
1.1 实验材料
本实验选取SPF级雄性SD大鼠87只,8周龄,体质量(190±15) g,购于广东省医学实验动物中心,许可证号SCXK(粤)2003-2002,粤监证字2007A003。实验大鼠分笼饲养,每笼5只,室温保持在(23±2)℃,空气相对湿度40%~60%,自然昼夜节律变化,大鼠饲养室保持通风。高脂饲料由广东省医学动物实验中心新鲜配制(质量分数):基础饲料64.55%、猪油10.00%、白糖 20.00%、蛋黄粉 5.00%、胆盐 0.20%、维生素0.05%、矿物质0.20%。
1.2 实验方法
实验大鼠在实验室适应环境1周后全部使用高脂饲料喂养,至第6周末,禁食12 h,称空腹体质重,于左下腹一次性注射20 mg/mL链脲佐菌素-柠檬酸缓冲液(按30 mg/kg空腹体重的剂量,30 min内注射完毕)。糖尿病大鼠造模成功的判断标准[3]:注射链脲佐菌素-柠檬酸缓冲液3 d后进行尿糖定性检测,目测尿糖连续3 d +++~++++,且第7天测试大鼠尾静脉全血血糖,血糖值大于16.7 mmol/L(300 mg/dL)。造模成功的大鼠随机分为 4组:糖尿病安静对照组(DMC)10只,糖尿病运动组1组(DME1)、糖尿病运动2组(DME2)、糖尿病运动3组(DME3)各11只。运动组大鼠在跑台上进行有氧耐力运动,根据 Bedford等[4]研究:DME1进行 10 m/min(相当于 30%VO2max)的小强度有氧运动;DME2进行15 m/min(相当于50%VO2max)的中强度有氧运动;DME3进行20 m/min(相当于70%VO2max)的大强度有氧运动。每组每周运动5 d,每天运动1 h。由于高血糖、运动等原因,最终各组大鼠采样数量为:DMC组10只、DME1组10只、DME2组9只、DME3组10只。实验过程中对动物处置符合动物伦理学要求。
1.3 标本采集
实验大鼠进行6周的不同强度有氧运动干预,采样前大鼠禁食12 h,采样时大鼠注射质量分数为10%水合氯醛300 mg/kg,麻醉大鼠,取腹主动脉血,血样于室温静置60 min后以3 500 r/min离心10 min,分离血清,EP管分装,置-70℃冰箱中保存,待测指标。取血后,剥离出大鼠完整肝脏组织,用预冷生理盐水洗净血液,滤纸吸干组织表面水分,再用无菌锡泊纸包裹后置于液氮中(一部分用 OCT包埋),保存于-70℃冰箱中。
1.4 测试指标方法
采用 GT-1640超级血糖仪测定空腹血糖(FBG),血糖试剂条由日本京都公司提供;采用S22PC分光光度计测定糖化血清蛋白(GSP),试剂盒由美国 ADL公司提供;采用S22PC分光光度计测定血清游离脂肪酸(FFA),试剂盒由南京建成生物工程研究所提供;采用RT-2100C型多功能酶标仪测定胰岛素(FINS),并计算胰岛素抵抗指数(IRI),试剂盒由美国ADL公司提供。使用切割式匀浆器对肝组织进行匀浆,制成10%肝组织匀浆液;通过RT-2100C型多功能酶标仪测定肝脏TNF-α含量,试剂盒由美国 ADL公司提供;采用S22PC分光光度计测定肝脏游离脂肪酸(FFA)含量,试剂盒由南京建成生物工程研究所提供。
1.5 统计学分析
所有数据均用SPSS 15.0进行统计,计算均值±标准差,采用单因素方差分析和两样本均数的t检验进行统计处理,P<0.05为显著性水平,P<0.01为非常显著性水平。
2 结果及分析
2.1 运动干预6周后各组大鼠血糖、胰岛素及相关指标变化
由表1可见,经过6周的运动干预,各运动组FBG均出现极显著性下降(P<0.01),同时 GSP也出现不同程度下降,但只有 DME1、DME2组具有统计学意义(P<0.05、P<0.01);各运动组FINS皆有上升,但只有DME3组的上升具有显著性意义(P<0.05),且与DME1、DME2组间差异也存在显著性(P<0.05);DME1、DME2组IRI出现显著性下降(P<0.05),而DME3组却显示上升(P>0.05),并且显著性或极显著性高于DME1、DME2组(P<0.05、P<0.01)。说明3种不同强度的有氧运动均能不同程度地改善DM大鼠高血糖、IR症状,其中中、小强度有氧运动效果较好。
表1 运动干预6周后各组大鼠血糖、胰岛素及相关指标变化(±s)
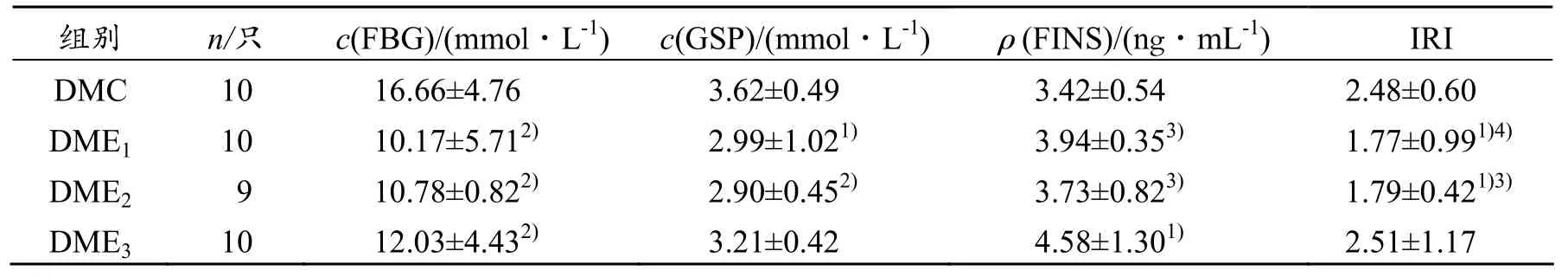
表1 运动干预6周后各组大鼠血糖、胰岛素及相关指标变化(±s)
与DMC组相比,1)P<0.05,2)P<0.01;与DME3组相比,3)P<0.05,4)P<0.01
组别 n/只 c(FBG)/(mmol·L-1) c(GSP)/(mmol·L-1) ρ(FINS)/(ng·mL-1) IRI DMC 10 16.66±4.76 3.62±0.49 3.42±0.54 2.48±0.60 DME1 10 10.17±5.712) 2.99±1.021) 3.94±0.353) 1.77±0.991)4) DME2 9 10.78±0.822) 2.90±0.452) 3.73±0.823) 1.79±0.421)3) DME3 10 12.03±4.432) 3.21±0.42 4.58±1.301) 2.51±1.17
2.2 运动干预6周后各组大鼠血清和肝脏FFA变化
运动干预6周后,与DMC组比较,DME1、DME2组血清FFA出现显著性下降(P<0.05),DME3组则出现极显著下降(P<0.01),DME1、DME2、DME3组肝脏FFA均有下降趋势,但无统计学意义(P>0.05),说明在运动干预下,FFA均有下降趋势,肝脏FFA变化没有血清中FFA变化明显(见表2)。
2.3 运动干预6周后各组大鼠肝脏TNF-α变化
实验结果显示,运动干预 6周后各运动组肝脏TNF-α均出现不同程度的下降,但只有DME2组的下降具有统计学意义(P<0.01)。
2.4 相关性分析
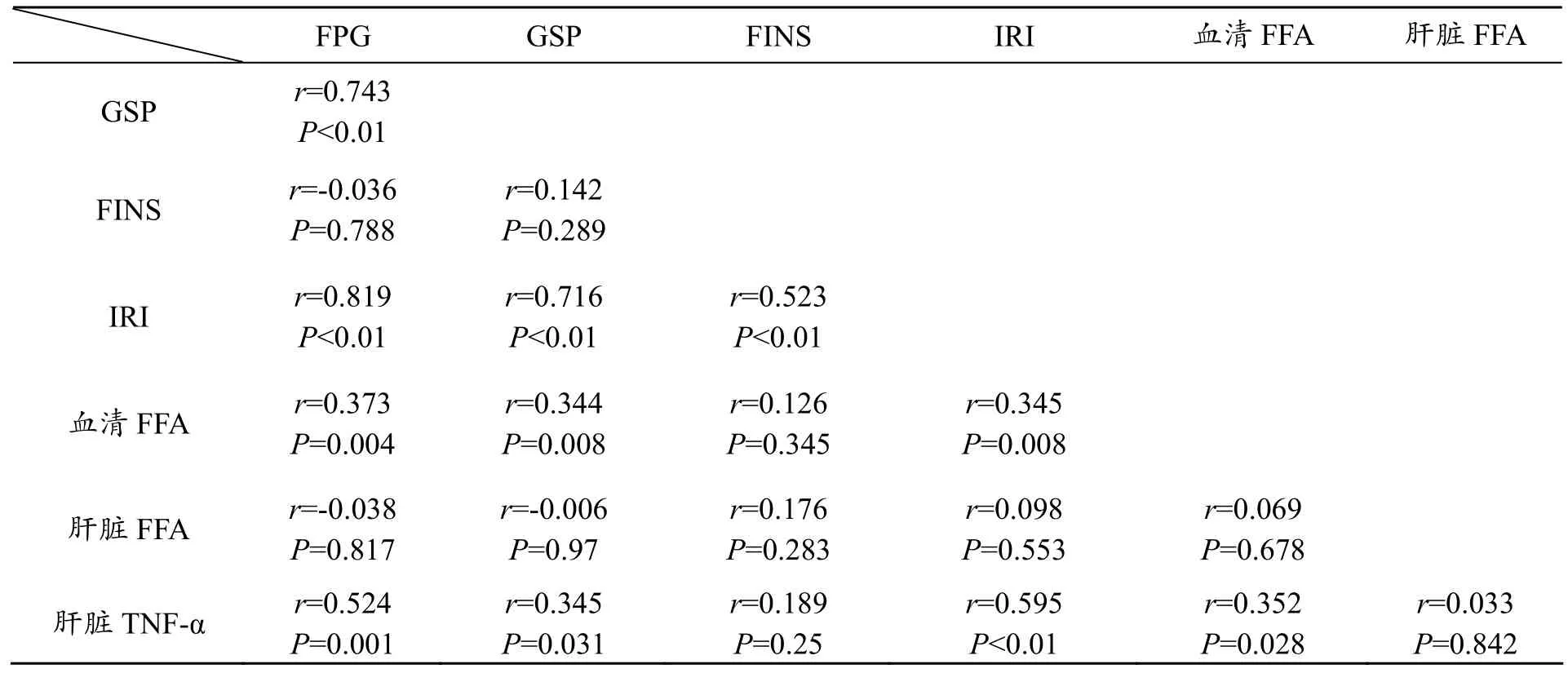
表3 大鼠肝脏TNF-α、NF-κB与其他指标相关性分析
经Person相关性分析,肝脏TNF-α与FPG、GSP、IRI、血清FFA正相关关系(见表3)。
表2 运动干预6周后各组大鼠血清和肝脏FFA变化(±s) mmol/L
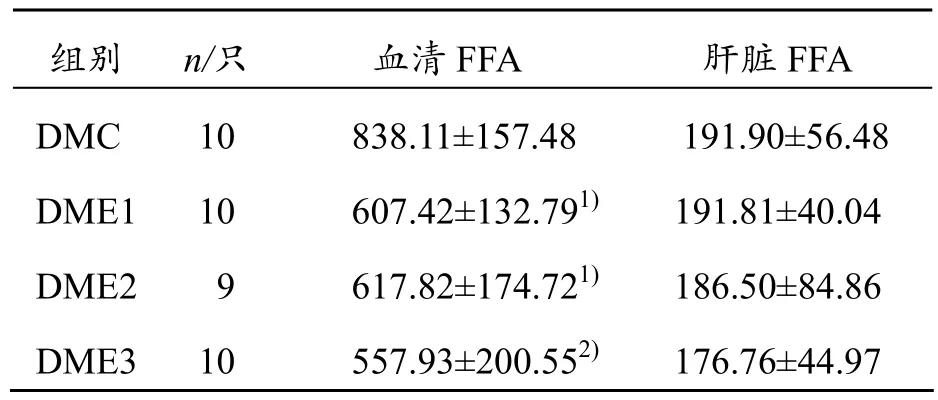
表2 运动干预6周后各组大鼠血清和肝脏FFA变化(±s) mmol/L
与DMC组相比,1) P<0.05,2) P<0.01
组别 n/只 血清FFA 肝脏FFA DMC 10 838.11±157.48 191.90±56.48 DME1 10 607.42±132.791) 191.81±40.04 DME2 9 617.82±174.721) 186.50±84.86 DME3 10 557.93±200.552) 176.76±44.97
3 讨论
糖尿病的病因与发病机制尚未完全阐明。糖尿病的“并发症”可遍及全身多个器官,不同患者可能出现各种不同的组合,形成了一个非常庞大且机理复杂的疾病构成[5]。肝脏是糖、脂代谢的重要器官,同时肝脏可产生多种炎症因子,是系统炎症介质的靶器官。大量研究发现,糖尿病患者肝脏会出现以 TNF-α为代表的炎症因子的增多,导致肝脏炎症状态的出现。
TNF-α在许多炎症反应中都有他们的活化和表达,是机体炎症和免疫损伤的重要炎症因子。TNF-α与IR和β细胞损伤关系密切,参与了糖尿病的发生和发展。许多研究发现糖尿病患者或糖尿病动物模型TNF-α水平出现异常变化,并认为TNF-α可能在糖尿病发病和IR过程中起着重要的作用[6]。TNF-α通过多种途径导致糖尿病的发生[7]:(1)直接作用于胰岛β细胞,生成环磷酸鸟苷,损伤细胞DNA;(2)与其他细胞因子协同作用,诱导NO的形成,并抑制葡萄糖诱导的胰岛素分泌;(3)抑制胰岛素受体和胰岛素受体底物 1(IRS-1)的酪氨酸残基磷酸化,影响胰岛素信号传导;(4)抑制葡萄糖转运因子4(GLUT4)基因转录,并使GLUT4 mRNA降解加速;(5)激活IKK,进而促进TNF-α转录,形成低度炎症的正反馈环,加重IR;(6)TNF-α降低PPARγ的mRNA的表达,减少PPARγ的产生;(6)抑制其他脂肪细胞因子如脂联素的合成及增加FFA的释放等。
本研究也显示,6周的不同强度有氧运动后糖尿病大鼠“三多一少”症状均有所减轻,糖、脂代谢紊乱现象有所改善。关于运动与 TNF-α的关系,前人已有大量的研究。尽管一直认为 TNF-α是急性期反应的主要诱发因子,但目前大量的实验结果表明运动后即刻 TNF-α外周循环浓度无变化或变化很小,反而出现延迟性增加。一些研究在运动后检测不到TNF-α,另外一些报道运动后 TNF-α浓度升高[8-9]。采用RT-PCR法测定7名男性受试者进行最大跑台运动应激实验后外周末梢血中直系 TNF-α的基因表达水平显著下降[10],这与以前在血清水平或离体实验中观察到的结果相反。8周步行锻炼使口服普伐他汀药物期的血脂异常患者运动后血清TNF-α水平显著降低[11]。目前有关运动对TNF-α的影响的研究结果尚不一致,存在较大的争议,这可能与各研究所选用的实验对象、运动强度、持续时间和运动形式不同有关。
根据“炎症学说”理论,“抗炎治疗”已经成为防治糖尿病及其并发症的新思路[7]。目前,在国外,学者们已开始认可运动的抗炎症作用。然而,在国内文献中,还极少看到运动具有抗炎症反应的提法和文献研究[12]。在探讨运动的抗炎症反应作用时,TNF-α被认为是和抗炎反应密切相关的细胞因子,运动很有可能是通过抑制 TNF-α产生而发挥抗炎症作用的[12]。本研究的实验对象为高脂合并 STZ诱导产生的糖尿病大鼠,通过6周的有氧运动锻炼后,运动组大鼠肝脏TNF-α浓度均出现了不同程度的下降,肝脏的炎症状态有所改善。从抗炎症的效果来看,只有糖尿病运动2组TNF-α的下降具有统计学意义(P<0.01),说明中等强度的有氧运动改善DM大鼠肝脏炎症状态的效果较好。
目前,关于运动抗炎机制,研究最多的就是TNF-α和IL-6[12]。但是在炎症反应过程中,介导炎症的细胞因子有很多种,如IL-6、IL-1、TNF-α、CRP、纤维蛋白原、PAI-1、细胞间黏附因子等。不同细胞因子对运动的反应结果不一致,说明运动抗炎症作用的机制目前还不清楚,有待于进一步的研究。
[1] Nam J S,Cho M H,Lee G T,et al. The activation of NF-kappaB and AP-1 in peripheral blood mononuclear cells isolated from patients with diabetic nephropathy[J]. Diabetes Res Clin Pract,2008,81(1):25-32.
[2] Lewis A,Steadman R,Manley P,et al. Diabetic nephropathy,inflammation,hyaluronan and interstitial fibrosis[J]. Histol Histopathol,2008,23(6):731-739.
[3] 余臣祖,张朝宁. 实验性2型糖尿病动物模型研究进展[J]. 医学综述,2006,12(1):41-42.
[4] Bedford T G,Charles M T,Noela C W,et al. Maximum oxygen consumption of rats and its changes with various experimental procedures[J]. J Appl Physiol,1979,47(6):1278-1283.
[5] 高桦,邱明才. 应加强对部分2型糖尿病患者多器官免疫损伤的研究[J]. 中华医学杂志,2005,85(12):793-795.
[6] Hotamisligil G S,Arner P,Caro J F,et al. Increased adipose tissue expression of tumor necrosis factor-alpha in human obesity and insulin resistance[J]. J Clin Invest,1995,95:2409-2415.
[7] 石巧荣,田文进,王丽英. 2型糖尿病与炎症及抗炎治疗进展[J]. 实用医学杂志,2007,23(15):2289-2291.
[8] Frank Z,Jessica W R,Dan N,et a1. Constitutive pro-and anti-inflammatory cytokine and growth factor response to exercise in leukocytes[J]. J Appl Physiol,2006,100:1124-1133.
[9] Rhind S G,Gannon G A,Shephard R J,et a1. Indomethacin modulates circulating cytokine responses to strenuous exercise in humans[J]. Cytokine,2002,l9(3):l53-158.
[10] Natelson B H,Zhou X,Ottenweller J E,et a1. Effect of acute exhausting exercise on cytokine gene expression in men[J]. Int J Sports Med,1996,l7(4):299-302.
[11] 刘大男,何作云. 运动锻炼对血脂异常患者血清黏附分子、细胞因子水平的影响[J]. 中华物理医学与康复杂志,2004,26(11):678-681.
[12] 唐晖,谢敏豪. 肥胖与运动研究进展——慢性炎症反应学说[J]. 体育科学,2008,28(8):54-59.
Effect of different intensity exercise to liver inflammatory state of rats with diabetic mellitus
LIN Wen-tao,LI Pin-fang,WENG Xi-quan
(Guangzhou Sport University,Guangzhou 510500,China)
This study is to discuss the anti-inflammatory effect of different intensity exercise, providing new ideas for the treatment of diabetes. Rat model of diabetes were established by high-fat diet with low-dose streptozotocin intraperitoneally injected, and randomly divided into diabetes control group (DMC), and 3 exercising groups (DME1, DME2, DME3). After adapting to treadmill exercise, exercise groups underwent treadmill training at the speed of 10 m/min (DME1)、15 m/min(DME2)and 25 m/min(DME3), 1 h/d, 5 d/week, continuous training for 6 weeks. After 6 weeks, the histopathologic changes of livers were evaluated.the serum ALT, AST, the liver NF-κB content were tested. Results: The exercise group FBG were significant decrease (P<0.01); DME1, DME2group of GSP decreased significantly (P<0.05, P<0.01); FINS was increase significantly in DME3Group (P<0.05), and DME1, DME2and DME3group there was significant difference (P<0.05); DME1, DME2group IRI were decreased (P<0.05), while the DME3groups was increased significantly (P>0.05), and significantly than DME1, DME2group (P<0.05, P<0.01); the exercise group suffered from hepatic TNF-α decreased to different extent, but only DME2group was decrease significantly (P<0.01). The Person correlation analysis, liver TNF-α and FPG, IRI is related.Conclusion: Medium-intensity exercise may be better to control blood glucose levels of diabetes and decrease the levels of TNF-α in the liver, thereby improving the status of inflammation in the liver of diabetes, and it is better to prevent and treat diabetic osteoporosis, but its mechanism remains to be further studied.
exercise biochemistry;diabetes mellitus;liver inflammatory state;TNF-α;treadmill exercise;rats
G804.7
A
1006-7116(2011)03-0136-04
2010-12-09
广东省自然科学基金项目(9151008901000079)。
林文弢(1957 -),男,教授,硕士研究生导师,研究方向:运动生物化学。
