NaCl胁迫对菊芋幼苗生长和叶片光合作用参数以及体内离子分布的影响
2010-12-31叶慧君耿守保黄增荣隆小华刘兆普
陆 艳,叶慧君,耿守保,黄增荣,隆小华,刘兆普
盐碱土是陆地上广泛分布的土壤类型之一,约占全球陆地总面积的 25%。中国的盐碱地面积有3 300多万公顷,因盐碱导致大量的土地荒废。对于中国这样一个耕地资源日趋减少的人口大国而言,充分利用盐碱地,实现经济效益、环境保护和可持续发展相结合,具有十分广阔的应用前景。
菊芋 (HelianthustuberosusL.)又名洋姜,属菊科(Compositae)向日葵属 (HelianthusL.)多年生草本植物[1],是目前在中国沿海滩涂推广种植的主要海涂耐盐高效植物之一[2]。菊芋集耐贫瘠、耐寒、耐旱、抗病虫、分布广及适应性强等特点于一体,生物产量较高[3],是一种不可多得的生态经济型植物。一方面,其块茎能够加工成生物燃料,通过生物炼制生产各类生物基化学品;另一方面,由其加工成的生物保健产品市场容量大、销路广泛,其叶片中生物活性物质 (如氯原酸[4]等)含量丰富,市场开发潜力较大。
利用盐碱地种植菊芋可以产生明显的社会效应和经济效益,充分挖掘沿海滩涂、盐碱荒地及不适宜粮食种植的土地资源的生产潜力,就能够做到不与农作物争地、将生态治理与环境保护相结合及将中低产田改造与农业结构调整相结合的目的。
作者研究了不同浓度NaC l胁迫对菊芋幼苗生长指标、叶片光合作用参数以及体内 Na+、K+和 C l-分布的影响,并分析了菊芋的耐盐性,以期为菊芋耐盐机制的研究及推广种植提供一定的参考依据。
1 材料和方法
1.1 材料
实验于 2009年 4月在南京农业大学温室内进行。供试菊芋取自江苏盐城大丰试验田。菊芋块茎先后用自来水及蒸馏水冲洗干净后,经体积分数为0.05%的杀真菌剂进行表面灭菌;将已灭菌的具有1个芽眼的菊芋块茎的切块 (直径约 0.5 cm)播种于装有石英砂且下部有孔的塑料盆 (直径 17 cm、高14 cm)中,置于自然光照条件下进行培养。待块茎萌发后,用 1/2Hoagland营养液浇灌。待菊芋幼苗长至 3叶期时进行疏苗,每盆保留 1株,共 36盆,备用。
1.2 方法
1.2.1 NaC l胁迫处理方法 待菊芋幼苗长至 6叶1心期时进行 NaCl胁迫处理。分别用 NaC l终浓度为 0(CK)、50和 100mmol·L-1的 1/2Hoagland营养液进行胁迫处理。为了避免盐冲击效应,NaC l浓度每天递增 50mmo l·L-1,直至达到预定浓度为止[5]。之后,每隔 2天分别用 NaC l浓度相同的 1/2Hoagland营养液进行浇灌。每处理 12株幼苗,处理15 d后分别采集菊芋植株的地上部分和地下部分,供分析。
1.2.2 生长指标的测定方法 用去离子水洗净菊芋幼苗表面的砂粒,吸干水分后按单株分开,分别称取每一单株地上部分和地下部分的鲜质量;然后将地上部分和地下部分分别装入干燥纸袋内,110℃杀青 10m in后,于 60℃烘干至恒质量,分别称量每一单株地上部分和地下部分的干质量,并计算干物质积累率。每一样品各重复称量 4次,结果取平均值。
1.2.3 光合作用参数的测定方法 在胁迫处理结束的当天,取菊芋植株中部 7~9叶位的叶片,避开大叶脉,于上午 8:00至 10:00用美国L I-COR公司生产的L i-6400型光合测定仪测定叶片的净光合速率、胞间 CO2浓度、大气 CO2浓度和蒸腾速率等参数。测定时以生物效应灯为光源,叶室温度25℃,光照强度 1 000μmo l·m-2·s-1,CO2浓度 350μmo l· mo l-1,相对湿度 58%~65%,叶室面积 6 cm2。每个参数均重复测定 3次,结果取平均值。
1.2.4 离子含量的测定方法 菊芋植株地上部分与地下部分分别经过烘干、研磨后过 30目筛,各称取粉末样品 50m g,参照 Hunt的方法[6],用WGH-1火焰光度计(上海电子光学技术研究所制造)测定样品中的Na+和 K+含量,用滴定法[7]测定样品中的 C l-含量。重复测定 3次,结果取平均值。
1.3 数据处理与分析
菊芋幼苗地上部分和地下部分的干物质积累率按公式:干物质积累率 =(干质量/鲜质量)×100%进行计算。水分利用效率和气孔限制值的计算公式分别为:水分利用效率 (WUE)=净光合速率 (Pn)/蒸腾速率 (Tr);气孔限制值 =1-〔胞间 CO2浓度(Ci)/大气 CO2浓度 (Ca)〕[8-9]。
运用 SPSS统计分析软件对实验数据进行统计和分析。
2 结果和分析
2.1 NaC l胁迫对菊芋幼苗生长的影响
在不同浓度NaC l胁迫条件下,菊芋幼苗单株地上部分和地下部分的鲜质量及干质量以及全株的鲜质量及干质量见表 1。
由表 1可见,在 0~100mmo l·L-1NaCl胁迫条件下,菊芋幼苗单株地上部分的鲜质量和干质量以及全株的鲜质量和干质量均呈显著下降的趋势 (P< 0.05);地下部分的鲜质量及干质量也呈下降的趋势,但对照组和 50mmo l·L-1NaC l处理组间以及 50和 100mmol·L-1NaC l处理组间的差异不显著 (P>0.05),而对照和 100mmol·L-1NaCl处理间差异显著(P<0.05)。表明NaCl胁迫处理对菊芋幼苗地下部分生长的影响远小于地上部分。
表 1 不同浓度 NaC l胁迫条件下菊芋幼苗单株平均鲜质量和平均干质量的比较(±SE)1)Tab le 1 Com par ison of average fresh weight and average dry weigh t of ind iv idua l of H elian thus tuberosus L.seed ling under NaC l stressw ith d ifferen t concen tra tion s(±SE)1)

表 1 不同浓度 NaC l胁迫条件下菊芋幼苗单株平均鲜质量和平均干质量的比较(±SE)1)Tab le 1 Com par ison of average fresh weight and average dry weigh t of ind iv idua l of H elian thus tuberosus L.seed ling under NaC l stressw ith d ifferen t concen tra tion s(±SE)1)
1)同列中不同的小写字母表示在 5%水平上差异显著 D ifferent small letters in same colum n indicate the significant difference at5%level.
NaC l浓度/mmol·L-1 Conc. ofNaC l单株平均鲜质量/g Average freshweightof individual地上部分Above-ground part地下部分Under-ground part全株W hole seedling单株平均干质量/g Average d ryweightof individual地上部分Above-ground part地下部分Under-ground part全株W hole seed ling 0(CK)30.38±0.85a 5.57±0.08a 35.95±0.92a 2.99±0.28a 0.46±0.08a 3.45±0.36a 50 16.81±0.09b 3.60±0.05ab 20.41±0.04b 2.16±0.09b 0.24±0.02ab 2.40±0.11b 100 8.53±0.73c 1.95±0.78b 10.48±0.05c 1.12±0.08c 0.16±0.03b 1.28±0.05c
根据表 1中全株的鲜质量和干质量计算得出 0 (CK)、50及 100 mmo l·L-1NaC l胁迫条件下菊芋幼苗单株的平均干物质积累率分别为 9.60%、11.76%和 12.21%,50和 100mmo l·L-1NaC l胁迫处理组菊芋幼苗全株的干物质积累率分别为对照组的 1.23和1.27倍,表明 50和 100mmo l·L-1NaC l胁迫处理对菊芋植株的生长有一定的影响,也可能是由于在NaC l胁迫条件下菊芋植株的渗透压增加,引起植物细胞脱水所致。
2.2 NaC l胁迫对菊芋幼苗光合作用参数的影响
在不同浓度 NaC l胁迫条件下,菊芋幼苗叶片的净光合速率、水分利用效率、气孔导度和气孔限制值见表2。
由表 2可见,在菊芋幼苗叶片的 4个光合作用参数中,除 100mmo l·L-1NaC l胁迫处理组菊芋幼苗叶片的净光合速率显著低于对照组 (P<0.05)外,不同浓度NaC l处理组间这 4个参数的差异均不显著(P> 0.05)。
在实验浓度范围内,菊芋幼苗叶片净光合速率与气孔导度具有相似的变化趋势,即随着 NaC l浓度的提高递减;在 50和 100mmo l·L-1NaC l胁迫条件下,菊芋幼苗叶片的净光合速率分别为对照的 85.6%和44.9%、气孔导度分别为对照的 67.9%和 57.1%。菊芋幼苗叶片的水分利用效率与气孔限制值则随NaC l胁迫浓度的提高递增;在 50和 100 mmo l·L-1NaC l胁迫条件下,菊芋幼苗叶片的水分利用效率分别为对照的 1.25和 1.54倍、气孔限制值分别为对照的1.57和 1.64倍。
可见,随NaC l胁迫浓度的提高,菊芋幼苗叶片的净光合速率受到抑制,这可能是由于 NaC l胁迫导致叶片气孔导度下降,造成CO2供应受阻,从而对菊芋幼苗叶片的光合作用产生一定的抑制作用。
表 2 不同浓度 NaC l胁迫条件下菊芋幼苗叶片 4个光合作用参数的比较(±SE)1)Tab le 2 Com par ison of four photosyn thetic param etersof leaf of H elian thus tuberosus L.seed ling under NaC l stressw ith d ifferen t concen tra tion s (±SE)1)
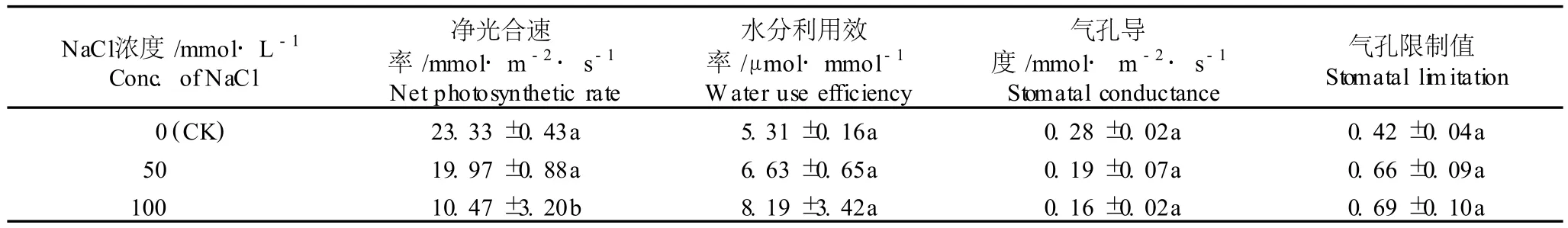
表 2 不同浓度 NaC l胁迫条件下菊芋幼苗叶片 4个光合作用参数的比较(±SE)1)Tab le 2 Com par ison of four photosyn thetic param etersof leaf of H elian thus tuberosus L.seed ling under NaC l stressw ith d ifferen t concen tra tion s (±SE)1)
1)同列中不同的小写字母表示在 5%水平上差异显著 D ifferent small letters in same colum n indicate the significant difference at5%level.
NaC l浓度/mmo l·L-1 Conc.ofNaC l净光合速率/mmo l·m-2·s-1 Netphotosynthetic rate水分利用效率/μmo l·mmo l-1 W ater use efficiency气孔导度/mmo l·m-2·s-1 Stomatal conductance气孔限制值Stomatal lim itation 0(CK)23.33±0.43a 5.31±0.16a 0.28±0.02a 0.42±0.04a 50 19.97±0.88a 6.63±0.65a 0.19±0.07a 0.66±0.09a 100 10.47±3.20b 8.19±3.42a 0.16±0.02a 0.69±0.10a
2.3 NaC l胁迫对菊芋幼苗体内 C l-、Na+和 K+分布的影响
在不同浓度〔0(CK)、50和 100mmo l·L-1〕NaC l胁迫处理条件下,菊芋幼苗地上部分与地下部分的C l-、Na+和 K+含量见表 3。
由表 3可见,菊芋幼苗地上部分和地下部分的C l-含量随NaC l胁迫浓度提高而增加;50mmo l·L-1NaC l处理组的菊芋幼苗地上部分和地下部分的 Cl-含量与对照组差异不显著 (P>0.05),分别是对照组的 1.16和 1.06倍;而 100mmol·L-1NaC l处理组菊芋幼苗地上部分和地下部分的 C l-含量则显著高于对照组(P<0.05),分别为对照组的 2.59和 1.60倍。相比之下,各处理组与对照组菊芋幼苗地上部分的C l-含量均高于地下部分,说明菊芋幼苗地下部分吸收的 C l-大部分被转移并积累在地上部分。
由表 3还可知,菊芋幼苗地上部分和地下部分的Na+含量均随NaC l胁迫浓度的提高而增加,各处理组间差异显著,且地上部分较地下部分变化更显著。在100mmo l·L-1NaC l胁迫条件下,菊芋幼苗对 Na+的吸收量最大,地上部分的Na+含量分别是对照组和 50 mmo l·L-1处理组的 7.10和 2.69倍,而地下部分的Na+含量则分别是对照组和 50 mmol·L-1处理组的 2.98和 1.46倍。由于对照组及各处理组菊芋幼苗地上部分与地下部分Na+含量的比值均大于 1,说明通过菊芋幼苗根系吸收的 Na+多数被转移并积累在其幼苗的地上部分。
在不同浓度 NaCl胁迫处理条件下,菊芋幼苗地上部分和地下部分 K+含量的变化趋势与Na+和 C l-含量的变化趋势完全相反,即:菊芋幼苗地上部分和地下部分的 K+含量随NaC l胁迫浓度的提高而减少,但不同处理组间的差异均不显著 (P>0.05)。此外,0(CK)、50、100mmo l·L-1NaC l胁迫处理组菊芋幼苗地上部分与地下部分的 K+含量之比分别为 2. 08、1.89和 2.95,均大于 1,说明菊芋幼苗吸收的 K+多数被转移并积累在其幼苗的地上部分。
在0(CK)、50和100mmo l·L-1NaC l胁迫处理条件下,菊芋幼苗地上部分的 Na+/K+比分别为 0. 26、0.83和 2.39,地下部分的Na+/K+比分别为 0. 51、1.16和 2.83,可见,随着 NaC l胁迫浓度的提高,菊芋幼苗地上部分与地下部分的 Na+/K+比均呈现递增的趋势。表明随 NaC l胁迫浓度的提高,菊芋幼苗吸收的Na+逐渐增多而 K+的吸收量逐渐减少,使菊芋幼苗体内Na+/K+比不能维持正常水平,从而影响菊芋幼苗体内的离子平衡。
表 3 不同浓度 NaC l胁迫条件下菊芋幼苗地上部分和地下部分 C l-、Na+和 K+含量的比较(±SE)1)Tab le 3 Com par ison of C l-,Na+an d K+con ten ts in above-ground and under-ground par ts of H elian thus tuberosus L.seed ling under NaC l stressw ith d ifferen t concen tra tions(±SE)1)
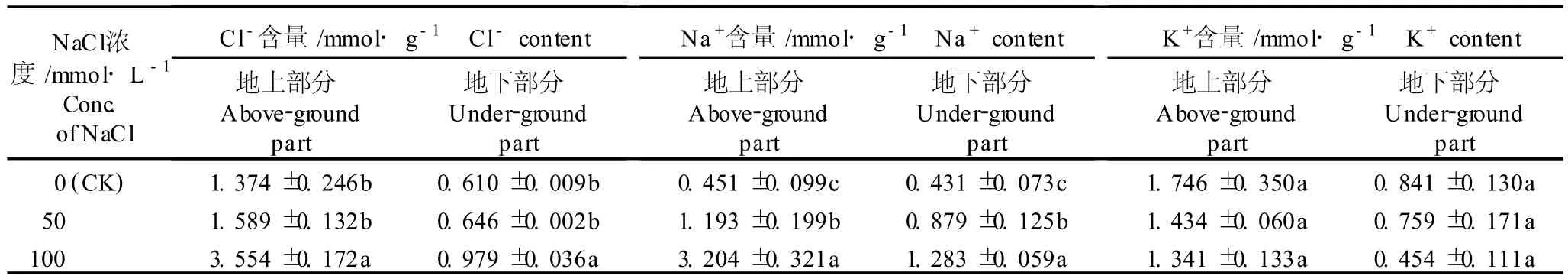
表 3 不同浓度 NaC l胁迫条件下菊芋幼苗地上部分和地下部分 C l-、Na+和 K+含量的比较(±SE)1)Tab le 3 Com par ison of C l-,Na+an d K+con ten ts in above-ground and under-ground par ts of H elian thus tuberosus L.seed ling under NaC l stressw ith d ifferen t concen tra tions(±SE)1)
1)同列中不同的小写字母表示在 5%水平上差异显著 D ifferent sm all letters in sam e co lum n indicate the significant difference at5%level.
NaC l浓度/mmo l·L-1 Conc. ofNaC l Cl-含量/mmo l·g-1 C l-content地上部分Above-ground part地下部分Under-ground part Na+含量/mmol·g-1 Na+content地上部分Above-ground part地下部分Under-ground part K+含量/mmol·g-1 K+content地上部分Above-ground part地下部分Under-ground part 0(CK)1.374±0.246b 0.610±0.009b 0.451±0.099c 0.431±0.073c 1.746±0.350a 0.841±0.130a 50 1.589±0.132b 0.646±0.002b 1.193±0.199b 0.879±0.125b 1.434±0.060a 0.759±0.171a 100 3.554±0.172a 0.979±0.036a 3.204±0.321a 1.283±0.059a 1.341±0.133a 0.454±0.111a
3 讨论和结论
一般认为,植物耐盐性的大小由遗传性决定,不同植物及同种植物不同发育阶段的耐盐性有差异[10]。中性盐 (NaC l)胁迫的伤害作用主要通过离子本身的毒性效应、高浓度盐的渗透效应和营养亏缺效应来实现[11-12]。其中,离子毒性效应包括过量的Na+和 C l-对植物细胞膜系统的伤害,导致细胞膜透性增大、电解质外渗以及由此引起的细胞代谢失调;渗透效应是指由于根系环境中盐分浓度的提高、水势下降而引起的植物吸水困难;营养亏缺效应则是指在植物根系吸收过程中,高浓度的 Na+和 C l-的存在干扰了植物对营养元素 K、Ca和 N的吸收,造成植物体内营养元素缺乏,最终影响植物的生长发育[13]。
在盐胁迫条件下,过多的 Na+对植物是有害的,会影响植物光合产物的积累,从而影响植物的生物产量[14]。本实验结果表明,在 50和 100 mmo l·L-1NaC l胁迫条件下,菊芋幼苗的地上部分与地下部分的生物量均受到不同程度的影响,且均随着 NaC l浓度的提高而减少,尤以高浓度(100mmol·L-1)NaC l胁迫的影响最为显著,但菊芋幼苗地下部分对 NaC l胁迫的敏感程度低于地上部分。
在盐胁迫条件下,随NaC l浓度的增高,植物叶片的叶绿素含量下降,从而影响植物的光合作用[15]。而光合作用的改变可能受到气孔导度的限制,气孔导度的大小又与植物的光合速率密切相关。在大多数情况下,气孔导度下降将造成 CO2供应受阻进而使植物的光合速率下降[16]。本实验结果表明,低浓度NaC l胁迫对菊芋幼苗叶片光合作用参数的影响小于高浓度NaCl胁迫,随 NaCl浓度的提高,菊芋叶片细胞内的渗透压不断增加,使细胞含水量降低,从而影响光合作用和水分利用效率,即净光合速率明显下降。水分利用效率即水分生产率,是显示作物水分吸收利用过程效率的一个指标[17]。盐胁迫条件下,植株脱水严重,为适应此逆境,植株水分利用效率及气孔限制值增加,以达到减少水分散失的目的,在一定程度上有利于缓解水分失衡,从而提高植株的耐盐性[18]。
在植物体内,Na+是没有活化作用的阳离子,生物体内积累过多的 Na+会使参与机体代谢的酶形成无活性的蛋白构成物进而毒害植物[19];而 K+是具有活化作用的一价阳离子,是保证植物正常代谢的关键离子,提高植物体内的 K+含量有利于维持细胞内的离子平衡,在植物对逆境的适应中起着十分关键的作用[20];植物叶片的 Na+/K+比通常被认为是评价植物耐盐性的重要指标之一[21]。汪贵斌等[13]的研究结果显示,随盐胁迫的增强,叶片中的 Na+浓度和 Na+/ K+比均随之增高。本实验结果表明,在低浓度 NaCl胁迫条件下,菊芋幼苗地上部分与地下部分的Na+含量和 K+含量相对稳定,当 NaC l浓度达 100 mmol· L-1时,菊芋幼苗对 Na+的吸收明显增加,并减少了对K+的吸收,不能维持菊芋体内正常的 Na+/K+比,破坏了植株体内的离子平衡,超过了菊芋的耐盐负荷,植株的代谢功能受阻。
综上所述,NaC l胁迫处理对菊芋幼苗生长和叶片光合作用等生长和生理过程均有一定的影响。在NaC l胁迫条件下,随NaC l浓度的提高,过多的Na+导致细胞渗透压增加、细胞含水量降低,从而影响植物的光合作用、降低光合产物的积累,且在高浓度NaCl胁迫条件下菊芋幼苗不能维持体内正常的 Na+/K+比,导致植株生长发育受到抑制,最终使其生物产量降低。
[1]Chen K,Hu GQ,Keutgen N,et al.Effects of NaC l salinity and CO2enrichment on pep ino(SolanummuricatumA it.):II.Leaf photosynthetic p roperties and gas exchange[J].Scientia Horticulturae,1999,81(1):43-56.
[2]刘兆普,隆小华,刘 玲,等.海岸带滨海盐土资源发展能源植物资源的研究[J].自然资源学报,2008,23(1):9-14.
[3]周珠扬,朱 磊,杨 杰.菊芋的功能及开发利用前景[J].西藏科技,2009(6):73-75.
[4]李淑媛,常翠青.氯原酸的生物活性与人体健康[J].卫生研究,2005,34(6):762-764.
[5]薛延丰,刘兆普.不同浓度NaC l和Na2CO3处理对菊芋幼苗光合及叶绿素荧光的影响[J].植物生态学报,2008,32(1): 161-167.
[6]Hunt J.D ilute hydrochloric acid extraction of p lantm aterial for routine cation analysis[J].Communications in Soil Science and PlantAnalysis,1982,13(1):49-55.
[7]於丙军,罗庆云,刘友良.盐胁迫对盐生野大豆生长和离子分布的影响[J].作物学报,2001,27(6):776-780.
[8]廖建雄,王根轩.谷子叶片光合速率日变化及水分利用效率[J].植物生理学报,1999,25(4):362-368.
[9]张邦定.菊芋的开发与栽培[J].四川农业科技,1997,6(5): 39-40.
[10]马翠兰,刘星辉,陈中海.果树对盐胁迫的反应及耐盐性鉴定的研究进展[J].福建农业大学学报,2000,29(2):161-166.
[11]赵可夫.植物抗盐生理[M].北京:中国科学技术出版社, 1993:13-20.
[12]Ruiz D,M artinez V,CerdáA.Demarcating specific ion(NaC l, C l-,Na+)and osmotic effects in the response of two citrus rootstocks to salinity[J].Scientia Horticulturae,1999,80(3/4): 213-224.
[13]汪贵斌,曹福亮,游庆方,等.盐胁迫对 4树种叶片中 K+和Na+的影响及其耐盐能力的评价[J].植物资源与环境学报, 2001,10(1):30-34.
[14]M acRobbie E A C.Signalling in guard cells and regulation of ion channel activity[J].Journal of Experimental Botany,1997,48: 515-528.
[15]尹增芳,何祯祥,王丽霞,等.NaC l胁迫下海滨锦葵种子萌发和幼苗生长过程的生理特性变化[J].植物资源与环境学报, 2006,15(1):14-17.
[16]张乃华,高辉远,邹 琦.Ca2+缓解 NaC l胁迫引起的玉米光合能力下降的作用[J].植物生态学报,2005,29(2):324-330.
[17]赵耕毛,刘兆普,陈铭达,等.海水养殖废水灌溉条件下山东滨海盐土溶质迁移及其平衡研究[J].水土保持学报,2005, 19(3):80-82,109.
[18]王建绪,刘兆普,隆小华,等.海水浇灌对菊芋生长、光合及耗水特征的影响[J].土壤通报,2009(3):606-610.
[19]杨敏生,李艳华,梁海永,等.盐胁迫下白杨无性系苗木体内离子分配及比较[J].生态学报,2003,23(2):271-277.
[20]郑青松,刘 玲,刘友良,等.盐分和水分胁迫对芦荟幼苗渗透调节和渗调物质积累的影响[J].植物生理与分子生物学学报,2003,29(6):585-588.
[21]杨晓英,章文华,王庆亚,等.江苏野生大豆的耐盐性和离子在体内的分布及选择性运输 [J].应用生态学报,2003,14 (12):2237-2240.
