野生及栽培盾叶薯蓣 (D ioscorea zingiberensis)的性别特征观察
2010-12-31王筱璐吴宝成周义峰杭悦宇
王筱璐,吴宝成,周义峰,杭悦宇
〔江苏省·中国科学院植物研究所(南京中山植物园),江苏 南京 210014〕
盾叶薯蓣 (DioscoreazingiberensisC.H.W right)隶属薯蓣科 (D iosco reaceae)薯蓣属 (DioscoreaL.)根状茎组(Sect.StenophoraU line),为中国特有种[1],主要分布在河南南部、湖北、湖南、陕西秦岭以南、甘肃天水以及四川等省海拔 100~1 800m的平地和高山区域。盾叶薯蓣花单性,雌雄异株,由于其根状茎内含有薯蓣皂苷元,因此,被认为是重要的甾体激素药源植物[2]。
已有研究证实,盾叶薯蓣根状茎内的薯蓣皂苷元含量与其性别具有明显相关性,如:栽培盾叶薯蓣同年生和 2年生雄株的薯蓣皂苷元含量显著高于雌株[3-4];雌雄同株的薯蓣皂苷元含量介于雌株和雄株之间且更接近于雄株[4]。由于性别与薯蓣皂苷元含量间具有一定的相关性,因而,对盾叶薯蓣的性别类型进行研究具有非常重要的意义。符策等[5]观察到产自广西的 1年生栽培盾叶薯蓣的开花植株有 4种性别类型,即雌株、雄株、雌雄同株异序和雌雄同序异花,其中雌株占 16.6%,雄株占 82.7%。盾叶薯蓣在产业化栽培过程中完全以地下根状茎进行无性繁殖,因此,栽培盾叶薯蓣性别的多样化究竟是栽培过程中引起的变异还是物种固有的特性?在栽培过程中性别是否会发生变化且如何变化?这一系列的问题目前尚未见研究报道。
作者以盾叶薯蓣野生资源保存较好的湖北武当山区为研究区域,观察了野生盾叶薯蓣植株的性别表型特征,同时对栽培于江苏省·中国科学院植物研究所实验地内的盾叶薯蓣的性别特征进行了连续 3年的观察,并比较了母根状茎和子根状茎的性别特征差异,以探索盾叶薯蓣在自然生境中的性别特点及栽培过程对盾叶薯蓣性别的影响,为薯蓣属植物繁育系统的研究提供基础研究资料,也为盾叶薯蓣的产业化生产提供科学依据。
1 研究地概况和研究方法
1.1 野生盾叶薯蓣样地自然概况
目前,野生盾叶薯蓣的主要分布地[6-7]为湖北武当山区,因此,本研究选择武当山分布的野生盾叶薯蓣进行性别特征观察。武当山地处北纬 32°23′、东经110°68′,主峰海拔 1 612 m。据记载[8],海拔 900 m以上的高山地带年均温 9.7℃,极端最高温 34.1℃,极端最低温 -18℃,≥10℃的年积温 2 831℃,无霜期 183 d,年降雨量 1 125mm;海拔 155m的汉水河谷地带年均温 15.9℃,极端最高温 41.5℃,极端最低温 -12.4℃,≥10℃的年积温 4 926.7℃,无霜期250 d,年降雨量 850mm。
1.2 实验材料
于 2006年 6月 30日至 7月 7日 (盛花期)在武当山共划定了具有典型性的6个样地(包括 4个样带和 2个样方)观察野生盾叶薯蓣的性别特征,样地多位于林间小径两旁及公路两旁山坡上,各样地的具体状况见表1。
供试栽培盾叶薯蓣则于 2003年秋引自湖北武当山,共 153株。挖取根状茎并栽培于江苏省·中国科学院植物研究所实验地内,株距 0.8m、行距 1m,地力均匀,采取正常的田间管理措施。
1.3 观察方法
1.3.1 野生盾叶薯蓣性别特征观察 于 2006年 6月 30日至 7月 7日分别对湖北武当山 6个样地内的全部 717株野生盾叶薯蓣进行观察,并对开花植株的性别特征进行观察及统计。

表1 湖北武当山野生盾叶薯蓣样地概况Tab le 1 Plot survey of w ild D iosco rea zingiberensis C.H.W r igh t in W udangM oun ta in of HubeiProv ince
1.3.2 栽培盾叶薯蓣性别特征观察 2004年至2006年连续 3年于每年的 3月份进行盾叶薯蓣栽种,每年 12月份起出盾叶薯蓣的根状茎越冬贮藏,在每年的花期对植株的性别进行观察和统计,并计算 2005年和 2006年的性别变异率。其中,2005年的变异率统计以 2004年相应性别的基株数为基数,2006年统计时仍以 2004年相应性别的基株数为基数,并计算增加的变异率。在统计过程中,将死亡的植株视为未发生变异,不计入变异数进行统计。
另外,在每年起出盾叶薯蓣的根状茎时,将子根状茎(新生的 1年生根状茎)另行贮藏并栽种,观察子根状茎萌发植株的性别,并与母根状茎萌发植株的性别进行比较。在进行盾叶薯蓣的性别观察和统计时,将引种的每个根状茎和每年新长出或断下并另行栽种的所有子根状茎以及其地上部分作为 1个基株(genet,以下简称株)进行统计。
2 结果和分析
2.1 野生盾叶薯蓣的性别特征
湖北武当山区野生盾叶薯蓣的每个根状茎约有8~10个指状分支,但通常仅有 1个分支能长出缠绕茎。在野生状况下,武当山区的盾叶薯蓣常呈片状分布,但各分布区域相距较远,约几十至几百米,在分布区域内盾叶薯蓣的密度通常较小,以其中 2个样地 (2号样带和 5号样方)的数据为参照进行估算,在 100 m2面积内约有 2~14株。
由武当山野生盾叶薯蓣的性别表型特征统计结果(表 2)可见,调查区域内共有野生盾叶薯蓣 717株,但仅有 155株开花,约占观察植株总数的 21.6%。在 155株开花盾叶薯蓣植株中仅有 1株为雌雄同株,并且位于同一根缠绕茎上,其余均为雌雄异株。此外,各样地雌雄株比例为 1∶1~1∶3,平均雌雄株比例为 1∶1.57。

表 2 湖北武当山野生盾叶薯蓣性别特征的观察结果Tab le 2 O bserva tion resu lt of sex character of w ild D ioscorea zingiberensis C.H.W r igh t in W udangM oun ta in of HubeiProv ince
2.2 栽培盾叶薯蓣的性别特征及变异
2.2.1 栽培盾叶薯蓣的性别特征 连续 3年在盛花期对 153株栽培盾叶薯蓣进行性别特征观察和统计,结果见表3。
由表 3可见,2004年,雄株有 78株,占基株总数的 50.98%;雌株有 62株,占基株总数的 40.52%;雌雄同株有 13株,仅占基株总数的 8.50%;每个基株的缠绕茎数仅为 1~2支。2005年,雄株和雌株数量大幅度减少,分别只有 35和 19株;雌雄同株的数量则大幅度增加,达到 88株,占基株总数的 57.52%,比上一年的雌雄同株基株数量增加了近 6倍;同时,有 11株没有开花;每个基株的缠绕茎数略有增加,为 5~6支。2006年,有 16株在冬季保存过程中死亡,故未栽种,其余 137株成活植株中雄株数量略有上升,为 38株;而雌株数量则继续下降,仅剩 9株;雌雄同株 33株;由于 2006年未开花的基株数量明显增多 (57株),因而雌雄同株占基株总数的比例降至 21.57%,但仍占开花植株数的 41.25%;每个基株缠绕茎数与2005年相近,为 5~6支。

表 3 2004年至 2006年栽培盾叶薯蓣性别特征的观察结果Tab le 3 O bserva tion resu lt of sex character of cu ltiva ted D iosco rea zingiberensis C.H.W r igh t from 2004 to 2006
2.2.2 栽培盾叶薯蓣的性别变异 栽培盾叶薯蓣成活基株的性别变异状况详见图 1。结果表明,在栽培条件下,盾叶薯蓣基株的性别随栽培年限的增长发生一定的变异,且变异幅度较大。
由图 1可见,2004年栽培的盾叶薯蓣中有 78株为雄株,至 2005年其中 22株仍为雄株,8株转变为雌株,40株转变为雌雄同株,2005年的总变异率达到61.54%。到了 2006年,2005年未产生变异的雄株中又有 2株转变为雌雄同株,变异率增加了 2.56%;而在 2005年转变为雌株的盾叶薯蓣中又有 2株返变为雄株,变异率又增加了 2.56%;2005年变为雌雄同株的基株中分别有 8株和 3株转变为雄株和雌株,变异率分别增加了 10.26%和 3.85%。
由图 1还可以看出,2004年栽培的盾叶薯蓣中有62株为雌株,到 2005年其中 10株仍为雌株,而有 11株转变为雄株、38株转变为雌雄同株,2005年的总变异率高达 79.03%。在 2006年,2005年未变异的 10株雌株中又有 2株转变为雄株、1株转变为雌雄同株,变异率总计增加了 4.84%;而在 2005年变为雄株的基株中又有3株转变为雌雄同株,变异率增加了4.84%;在 2005年变为雌雄同株的基株中分别有 5株和 2株转变为雄株和雌株,变异率分别增加了8.06%和 3.23%。
图 1的统计结果还显示,2004年栽培的盾叶薯蓣中雌雄同株的基株为 13株,到 2005年其中的 2株转变为雄株、1株转变为雌株,2005年的总变异率为23.07%;2005年未变异的 10株雌雄同株基株在2006年又各有 1株分别转变为雄株和雌株,变异率总体上增加了 15.38%。此外,2005年转变为雄株的基株中有 1株在 2006年又返变为雌雄同株,变异率增加了7.69%。
总体而言,2005年存活并开花的盾叶薯蓣基株中共有 100株发生了变异,但在 2006年有 13株返变回原性别,有 26株保持了 2005年变异的性别,有 11株变异为第 3种性别。统计结果显示,栽培 3 a后,盾叶薯蓣雄株的总变异率达到 80.77%,雌株的总变异率达到 100.00%,雌雄同株的总变异率达到 46.14%。
2.2.3 栽培盾叶薯蓣母根状茎及子根状茎的性别变异 在 2004年起出栽培盾叶薯蓣根状茎时,从 52个根状茎上断下 1年生根状茎作为子根状茎,保存越冬后,于次年进行种植。在 2005年盾叶薯蓣的花期观察子根状茎萌发植株的性别表型并与对应的母根状茎萌发植株的性别进行比较,结果见表 4。
由表 4可见,共有 26个子根状茎萌发植株的性别与其母根状茎萌发植株有差异,总体变异率达到约50%。其中,母根状茎萌发植株为雄株的,其子根状茎萌发植株的总变异率最高,达到 59.09%;母根状茎萌发植株为雌株的,其子根状茎萌发植株的总变异率也较高,达到 50.00%;母根状茎萌发植株为雌雄同株的,其子根状茎萌发植株的总变异率相对较低,仅为41.67%。

图 1 2004年至 2006年栽培盾叶薯蓣成活基株性别变异状况F ig.1 Sex var ia tion sta tus of surv iva lgenets of cu ltiva ted D iosco rea zingiberensis C.H.W r igh t from 2004 to 2006
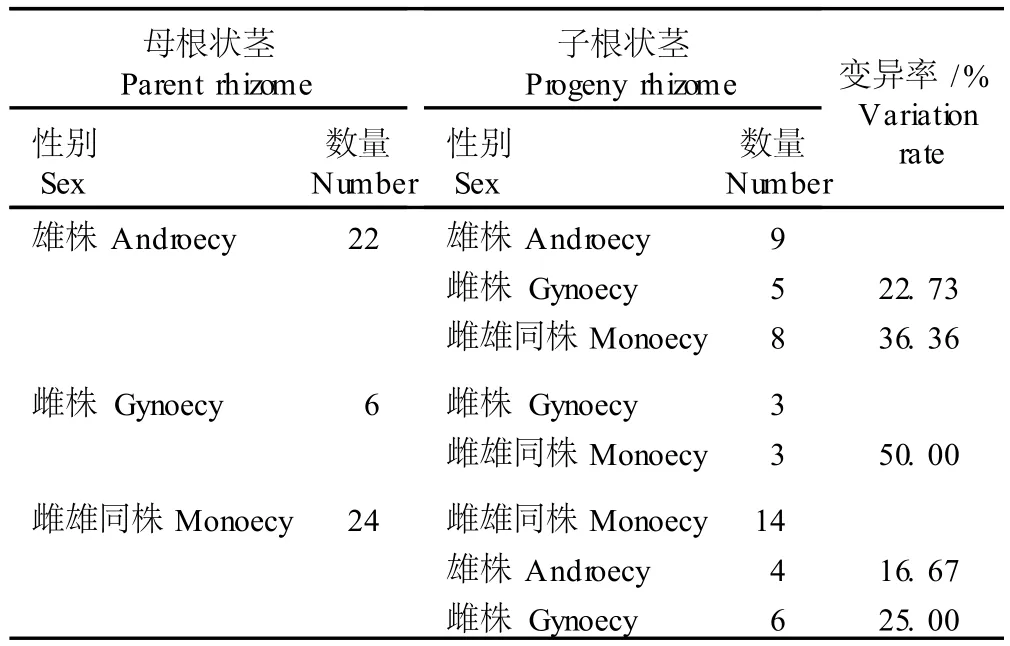
表 4 栽培盾叶薯蓣同一基株母根状茎及子根状茎的性别变异状况Tab le 4 Survey of sex var ia tion between paren t rh izom e and progeny rh izom e from sam e genet of cu ltiva ted D iosco rea zingiberensis C.H. W r igh t
3 讨 论
通常情况下,野生盾叶薯蓣的分布密度较低,雌雄植株分布较均匀;根状茎呈不规则指状生长,延伸广度远小于地上部分的平均株距;1个根状茎只生长出 1支缠绕茎,没有出现由于根状茎逐年增生而在 1个基株上生长出多个单株的情况,因此,有性繁殖是野生盾叶薯蓣的主要繁殖方式。薯蓣科是比较原始的单子叶植物,在薯蓣科中演化较原始的属 (如AvetraPerrier.等)具有两性花[9],而野生盾叶薯蓣所在的根状茎组在薯蓣属中的演化地位最原始[10],也有两性花向单性花过渡的种类,如马肠薯蓣 (D.simulansPrain etBurkill)[11],因此,在野生状况下盾叶薯蓣出现极少量的雌雄同株个体可认为是残存的原始性状。
野生盾叶薯蓣性型表达明确、性系统简单,而栽培盾叶薯蓣与野生盾叶薯蓣相比出现了明显不同的性别表型。随着生长年限的增加,栽培盾叶薯蓣同一根状茎的地上缠绕茎数明显增加,平均可达 5~6支,形成一个较大的分支系统,性别表达也由原来的单性别表达逐年转变,出现同株内 (包括同一基株内和母根状茎与子根状茎间)很高比例的性别转变:雌雄单性异株向雌雄同株转变的较多,其反向转变却较少,雌株和雄株间的相互转变逐年减少,特别应该注意的是雌性基株数量减少较多。
植物的性别表达是一个极其复杂的、受到许多内在因素和外界因子共同影响的基因表达调控的过程。目前,相关专家已在水稻 (OryzasativaL.)[12]、玉米(ZeamaysL.)[13]和拟南芥〔Arabidopsisthaliana(L.) Heynh.〕[14]等多种植物中找到特异的性别表达基因。有学者对环境因子影响瓜类性别表现进行了研究,结果显示:较低的温度(尤其是夜温)和较短的日照能够促进瓜类的雌花分化,而较高的温度和较长的日照则能够促进雄花分化;此外,土壤中的养分、水分和空气中的气体成分也会影响瓜类作物的性别表现[15]。如果不考虑自然条件下发生频率极低的体细胞遗传突变,盾叶薯蓣同一基株的母根状茎与子根状茎间以及不同年份同一基株的性别表现,理论上应该是完全相同的[16],但在栽培条件下却出现了复杂的性系统及大幅度的性别变异,这些变异可能是由于外界环境中生物或非生物因子的影响导致性别分化与表达的不稳定而造成的,但是这些生物或非生物因子中哪一种或哪几种起决定性作用?是否导致栽培盾叶薯蓣在遗传结构上也发生了变异?这些问题仍需进一步深入的研究和探讨。
[1]D ing Z Z,GilbertM G.D ioscoreaceae[M]∥W u Z Y,Raven PH. Flora of China:Vol.24.Beijing:Science Press,St.Louis:M issouriBotanical Garden Press,2000:276-297.
[2]丁志遵,王意成,周雪林,等.甾体激素原料植物——盾叶薯蓣的单株筛选[M]∥南京中山植物园.南京中山植物园研究论文集:1980.南京:江苏科学技术出版社,1981:81-86.
[3]谭远友,余展深,齐迎春,等.栽培盾叶薯蓣中皂甙元含量与质量的动态变化[J].湖北民族学院学报:自然科学版,2000,18 (1):17-18.
[4]曹玉芳,王太霞,胡正海.盾叶薯蓣根状茎不同部位和不同生长期薯蓣皂苷元含量的差异性研究[J].中草药,2004,35(5): 562-566.
[5]符 策,陆祖正,周 婧,等.盾叶薯蓣开花结果调查[J].广西热带农业,2005(1):10-12.
[6]李军超,李向民,郭晓思,等.盾叶薯蓣研究进展[J].西北植物学报,2003,23(10):1842-1848.
[7]徐成基.中国薯蓣资源 [M].成都:四川科学技术出版杜, 2000:1-349.
[8]朱延钧,杨立华,张国才.武当山盾叶薯蓣生态环境及其分布规律[J].资源开发与市场,1998,14(3):124-125,142.
[9]万金荣,丁志遵,秦慧贞.薯蓣科植物地理学的研究[J].西北植物学报,1994,14(2):128-135.
[10]杭悦宇,徐珞珊,史德荣,等.中国薯蓣属植物地下茎淀粉粒形态特征及其分类学意义[J].植物资源与环境学报,2006, 15(4):1-8.
[11]杭悦宇.中药萆薢类的基源、鉴定及质量评价研究[D].南京:中国药科大学生药学院,2007:30-34.
[12]陈 锐,高之桢,詹树萱,等.2个水稻花发育相关MADS-box基因的全序列 cDNA克隆及结构分析[J].复旦学报:自然科学版,2003,42(4):570-575.
[13]Schm id t R J,Veit B,M andelM A,et al.Identification and molecular characterization ofZAG1,the m aize homolog of theArabidopsisfloral homeotic gene AGAMOUS[J].The PlantCell, 1993,5:729-737.
[14]Tzeng T Y,Chen H Y,Yang C H.Ectop ic exp ression of carpelspecificMADS box genes fromLilyandLisianthuscauses sim ilar homeotic conversion of sepal and petal inArabidopsis[J].Plant Physio logy,2002,130(4):1827-1836.
[15]邵宏波,姜恩来,初立业.高等植物的性别表达及其调控:外界因子对植物性别表达的影响[J].四川师范大学学报:自然科学版,1992,13(4):275-279.
[16]Vance R R.C lonalorganism s:popu lation biology and evolution of clonalorganism s[J].Science,1987,235:1264.
