绿豆多肽的制备工艺及抗氧化作用
2010-12-27亮何倩陈勇孙颖莺
傅 亮何 倩陈 勇孙颖莺
(1.暨南大学食品科学与工程系,广东 广州 510632;2.佛山市广粮饮料食品有限公司,广东 佛山 528137)
绿豆多肽的制备工艺及抗氧化作用
傅 亮1何 倩1陈 勇2孙颖莺2
(1.暨南大学食品科学与工程系,广东 广州 510632;2.佛山市广粮饮料食品有限公司,广东 佛山 528137)
以绿豆蛋白为原料,研究碱性蛋白酶酶解制备绿豆多肽的工艺,以水解度(DH%)为指标,得到酶解最佳条件为:酶与底物比([E]/[S])3.5%,温度55℃,pH 值9.0,底物浓度为2%,酶解时间为120min。抗氧化试验结果表明:绿豆多肽有良好的还原能力,其对羟自由基和超氧阴离子的清除作用的IC50分别是13.96,12.67mg/mL,抗脂质过氧化能力的IC50为15.77mg/mL。绿豆多肽在4种抗氧化体系中均表现出较强的抗氧化性。
绿豆;多肽;抗氧化
绿豆是一种豆科、蝶形花亚科豇豆属植物,富含蛋白质、糖类、多种微量元素和人体必需维生素,其中蛋白质含量高达19.5%~33.1%,是蛋白质的良好来源之一[1]。而且绿豆蛋白具有良好的起泡性和泡沫稳定性,以及乳化性等功能特性[2~3]。中国绿豆资源十分丰富。但大多数生产厂家都侧重于绿豆淀粉的加工生产,而忽略绿豆蛋白的开发[4]。
天然抗氧化肽由于具有很高的安全性和强抗氧化性,在医药、食品等行业的应用中已显示出它的优势,已经成为国内外的研究热点。目前已通过酶解大豆蛋白、大米蛋白、罗非鱼皮胶原蛋白等各种不同来源的蛋白质得到抗氧化肽[5~8],但利用绿豆蛋白制备抗氧化肽的研究未见报道。本试验研究碱性蛋白酶酶解制备绿豆多肽的工艺,通过考察绿豆多肽的体外抗氧化性,为制备绿豆抗氧化肽提供理论和试验基础,同时为开发绿豆蛋白开拓新思路,深化绿豆的综合利用。
1 材料和方法
1.1 材料与试剂
绿豆蛋白:绿豆蛋白含量为77.85%,本实验室自制;
Alcalase碱性蛋白酶(粉末状):酶活力为2×105U/g,广州齐云生物科技有限公司;
氢氧化钠、盐酸、三氯化铁、抗坏血酸、过氧化氢、磷酸氢二钠、磷酸二氢钠、铁氰化钾、水杨酸、三氯乙酸、硫酸亚铁、硫代巴比妥酸(TBA):国产分析纯。
1.2 仪器
冷冻干燥机:FD-1型,北京博医康试验仪器有限公司;
胶体磨:DJM50L,上海东华高压均质机厂;
pH计:PHS-3C型,上海精密科学仪器有限公司;
低速离心机:KDC-12型,科大创新股份有限公司;
紫外可见光分光光度计:UV-9600型,北京瑞利分析仪器有限公司;
高速乳化搅拌机:JRJ-300-1型,上海标本模型厂;
集热式磁力加热搅拌器:DF-Ⅱ型,江苏省金坛市医疗仪器厂。
1.3 试验方法
1.3.1 绿豆蛋白的制备 绿豆种子洗净去杂,加水浸泡12h,去皮后匀浆,调pH至9,搅拌20min后以3 000r/min离心20min,取上清液调pH至4,再次离心后取沉淀冷冻干燥,即得绿豆分离蛋白[9]。
1.3.2 粗蛋白质含量的测定 凯氏定氮法(GB/T 5009.5——2003)。
1.3.3 蛋白水解度的测定方法 pH-stat法[10]。按式(1)计算水解度:

式中:
B—— 消耗碱量,mL;
Nb——NaOH摩尔浓度,mol/L;
Mp—— 底物中蛋白质质量,g;
htot——每克蛋白质底物具有的肽键毫摩尔数,绿豆的htot为7.9meq/g;
α——α-的平均解离度。
1.3.4 绿豆多肽制备工艺优化的试验设计 称取适量绿豆蛋白溶于去离子水中,混匀。将溶液放置入酶解反应器中,将混合液调节到反应的温度和pH范围内,缓慢搅拌的同时加入适量Alcalase碱性蛋白酶,分别改变底物浓度1%~6%(pH为9.0,[E]/[S]为3.0%,温度为50℃,时间为60min)、pH值7.5~10.0(底物浓度为2.0%,[E]/[S]为3.0%,温度为50℃,时间为60min)、[E]/[S]为1.5%~4.0%(底物浓度为2.0%,pH为9.0,温度为50℃,时间为60min)、温度40~65℃ (底物浓度为2.0%,pH 为9.0,[E]/[S]为3.0%,时间为60min)、时间30~360min(底物浓度为2.0%,[E]/[S]为3.0%,pH为9.0,温度为50℃),考察对水解度的影响。在单因素试验的基础上利用4因素3水平L9(34)正交分析方法设计试验,得出最优工艺条件。
1.3.5 绿豆多肽抗氧化性的测定
(1)绿豆多肽还原力的测定:在25mL比色管中先加入1mL不同浓度的样品,再加2.5mL,1%的 K3Fe(CN)6溶液及2.5mL,pH 6.6的0.2mol/L磷酸盐缓冲液,混匀,50℃下保温20min,之后加入2.5mL,10%的 TCA,再次混匀后3 000r/min离心10min,取2.5mL上清液,然后加入2.5mL去离子水及0.5mL,0.1%的FeCl3溶液,混匀后在700nm测A值[11]。
(2)绿豆多肽对羟基自由基的清除作用:利用Fenton反应产生羟基自由基(·OH),水杨酸能够有效捕捉·OH,生成有色物质2,3-二羟基苯甲酸,其在510nm处有强吸收。
在25mL的比色管中依次移取5mL,2mmol/L硫酸亚铁溶液和5mL,6mmol/L双氧水溶液,混合均匀后用6mmol/L水杨酸溶液定容至刻度,摇匀后立即测Ao值。在Ao值测定体系中,加入1mL不同浓度样品溶液,摇匀后立即在510nm测A1值[12]。绿豆多肽浓度设计:0.10,0.50,1.00,5.00,10.00,15.00,20.00,25.00mg/mL。清除率按式(2)进行计算:

(3)绿豆多肽对超氧阴离子的清除作用:邻苯三酚在弱碱条件下发生自氧化反应产生O2-·,O2-·能加速邻苯三酚自氧化速率,O2-·抑制剂减缓其氧化速率,从而使氧化产物在325nm下的吸收峰减小。
依次取2.25mL,pH 8.34的50mmol/L磷酸盐缓冲液,去离子水2mL,0.25mL,10mmol/L的邻苯三酚在25mL比色管中,混匀后25℃下保温,准确计时3min后,立即加入1滴10mol/L盐酸使反应中止。在325nm测得A0值。在A0的测定体系中,加入2mL样液代替去离子水,即可测得绿豆多肽浓度设计:0.10,0.50,1.00,5.00,10.00,15.00,20.00,25.00mg/mL。清除率按式(3)进行计算:

(4)绿豆多肽抗脂质氧化作用:脂质体的制备参考文献[14]的方法并进行改良:新鲜卵黄加入 pH 7.4的 PBS(0.1mol/L)配成10% (V/V)悬浮液,在冰浴下高速乳化剪切10min,4℃超声波处理20min,4℃密封保存。使用前,磁力搅拌5min。
在25mL比色管中依次加入0.5mL脂质体,0.1mL一定浓度的样品,加去离子水至1mL,再加入0.05mL FeSO4(70mmol/L)后37℃恒温水浴0.5h。然后加入0.5mL TCA(10%)与1mL硫代巴比妥酸(1%),沸水中水浴10min后4 000r/min离心15min,上清液532nm处测定吸光度A1。对照管用去离子水代替样品测定吸光度A0[15]。绿豆多肽浓度设计:0.10,0.50,1.00,5.00,10.00,15.00,20.00,25.00mg/mL。抑制率按式(4)进行计算:
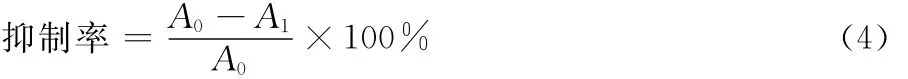
1.3.6 统计分析 所有数据用EXCEL软件分析处理,用平均数±标准差来表示,并采用二阶多项式进行拟合,但只适用于已知数据范围内的计算,不能外推。
2 结果与分析
2.1 正交试验设计优化碱性蛋白酶酶解条件
根据前期单因素结果,选择温度为50~60℃、pH为8~9、底物浓度为2%~4%,[E]/[S]为2.5%~3.5%进行4因素3水平(L9(34))的正交试验。水解时间为120min。因素和水平的取值及结果分析见表1~2。

表1 Alcalase碱性蛋白酶正交试验的因素水平设计Table 1 Design of factors and levels of orthogonal experiment for Alcalase protease

表2 Alcalase碱性蛋白酶正交试验结果Table 2 Results of the orthogonal experiment of Alcalase protease
由表2可知,影响水解反应的主次关系为C>B>A>D,即[E]/[S]>温度>pH>底物浓度;最优组合为C3B2A3D1。碱性蛋白酶水解绿豆蛋白的最佳条件为[E]/[S]3.5%,温度55℃,pH值9.0,底物浓度为2%,酶解时间为120min。照此条件进行验证实验,水解度达到23.90%。优于正交试验的9组试验结果。
2.2 绿豆多肽的抗氧化作用
2.2.1 绿豆多肽的还原能力 由图1可见,绿豆多肽样品随着浓度的增加,A700值增大,表明还原能力随之增大,还原力与其浓度成量效关系。在试验剂量范围内绿豆多肽还原能力比VC低。25.00mg/mL浓 度 的 绿 豆 多 肽A700值 为0.413±0.011,还原能力相当于0.38mg/mL浓度的VC。

图1 绿豆多肽和VC的还原力Figure 1 The reductive activity of mung bean polypeptide and VC
2.2.2 绿豆多肽对羟自由基的清除作用 由图2可知,绿豆多肽对羟自由基的清除能力随着浓度增加而增大,在25.00mg/mL时清除率达到57.33%±1.25%。其回归方程为y= -0.112 9x2+4.847 9x+4.329 2,R2=0.983 9,求得绿豆多肽的IC50是13.96mg/mL,表现出对羟自由基良好的清除效果。

图2 绿豆多肽对·OH的清除效果Figure 2 The·OH scavenging effects of mung bean polypeptide
2.2.3 绿豆多肽对超氧阴离子的清除作用 由图3可知,在0.10~25.00mg/mL的浓度范围内,绿豆多肽对超氧阴离子表现出良好的清除效果,并随浓度的增加,清除率增大。在25.00mg/mL时达到65.79%±2.34%。其回归方程为y= -0.104 2x2+5.137 4x+1.636 3,R2=0.994 4,求得IC50是13.96mg/mL,表明绿豆多肽对超氧阴离子有较强的清除作用。
2.2.4 绿豆多肽的抗脂质氧化能力 由图4可知,绿豆多肽对脂质过氧化的抑制率都随浓度的增加不断变大,且抑制率与浓度呈明显的量效关系。在25.00mg/mL时达到53.16%±2.5%,其回归方程为y= -0.107 3x2+4.515 2x+5.480 2,R2=0.989 1,得IC50为15.77mg/mL,表明绿豆多肽对脂质氧化有较强的抑制作用。
3 结论
通过正交试验设计优化Alcalase碱性蛋白酶酶解绿豆蛋白工艺,得到制备绿豆多肽的最佳工艺为[E]/[S]3.5%,温度55℃,pH 值9.0,底物浓度为2%,酶解时间为120min。在此条件下试验,水解度达到23.90%。

图4 绿豆多肽的抗脂质氧化能力Figure 4 The antioxidant effects on lipids of mung bean polypeptide
本试验考察了绿豆多肽在4种化学体系中的体外抗氧化作用,25.00mg/mL浓度的绿豆多肽还原能力相当于0.38mg/mL浓度的VC,绿豆多肽对羟自由基和超氧阴离子的清除作用的IC50分别为13.96,12.67mg/mL,对脂质过氧化抑制作用的IC50为15.77mg/mL。在此4种体系中,绿豆多肽均证明了其良好的抗氧化能力。将试验制备的绿豆多肽与其他蛋白来源制备的抗氧化肽对比,其还原能力要高于大豆肽[3],但低于罗非鱼皮胶原肽[6];对·OH 的清除率却高于罗非鱼皮胶原肽以及大米蛋白肽[5],但低于大豆肽[3];对 O2-·的清除率高于大豆肽[4],低于大米蛋白肽[5];对脂质过氧化的抑制率高于罗非鱼皮胶原肽[6]。绿豆多肽在这4种体系中表现出不同的抗氧化能力,其具体原因仍有待研究。
1 徐娟,袁艳娟,屠春燕.胃蛋白酶水解绿豆分离蛋白的工艺[J].生物加工过程,2008,6(4):31~35.
2 刘冬儿,吕天喜.绿豆分离蛋白的制备及其功能特性的研究[J].食品科技,2007,14(2):27~30.
3 梁丽琴,袁道强.绿豆分离蛋白功能特性研究[J].郑州轻工业学院学报(自然科学版),2005,20(1):50~55.
4 刘咏,杨柳.绿豆蛋白质提取工艺的优化[J].食品科学,2008,29(8):272~274.
5 荣建华,李小定,谢笔钧.大豆肤体外抗氧化效果的研究[J].食品科学,2002,23(11):118~120.
6 王莉娟,陶文沂.大豆肽体外抗氧化活性研究[J].生物加工过程,2008,6(4):69~73。
7 陈升军,熊华,周侃,等.米蛋白短肽抗氧化活性研究[J].食品科技,2008,33(12):177~180.
8 刘小玲,林莹,尹秀华,等.罗非鱼皮胶原肽的制备及抗氧化活性研究[J].食品与机械,2007,23(3):92~95.
9 张恒,佘纲哲.绿豆分离蛋白的提取和应用[J].中国粮油学报,1990,5(3):2~5.
10 李积华,郑为完,张斌,等.绿豆蛋白的酶法水解-工艺研究[J].食品研究与开发,2007,28(3):69~73.
11 Yen-hun He,Fereidoon Shahidi.Antioxidant activity of green tea and its catechins in a fish meat model system[J].Journal of Agric ulture Food Chemistry,1997(45):4 262~4 265.
12 尹艳,高文宏,于淑娟,等.水溶性大豆多糖对羟基自由基抑制作用的研究[J].食品工业科技,2009,30(8):83~87.
13 贾之慎,杨贤强.茶多酚(TP)清除活性氧自由基O2-·和·OH的分光光度法研究[J].中国茶叶,1993,19(1):25~27.
14 Kuppusamy U R,Indran M,Balraj B R S.Antioxidant effects of local fruits and vegetable extracts[J].Journal of Tropical Medicinal Plants,2002,3(1):47~53.
15 Maelinda Daker,Noorlidah Abdullah,S Vikineswary,et al.Antioxidant from maize and maize fermented by marasmiellus sp.as stabiliser of lipid-rich foods[J].Food Chemistry,2008(107):1 092~1 098.
Preparation and effects of antioxidant activity of mung bean polypeptides
FU Liang1HE Qian1CHEN Yong2SUN Ying-ying2
(1.Dept.of Food Science and Engineering,Jinan University,Guangzhou,Guangdong510632,China;2.Foshan Guangliang Drink and Food Inc.,Foshan,Guangdong528137,China)
Mung bean polypeptides were produced by Alcalase hydrolysis mung bean protein.The degree of hydrolysis(DH%)was used as the indicators to determine the optimum enzymolysis conditions.The results showed:enzyme to substrate ratio([E]/[S])is 3.5%,temperature is 55℃,pH value is 9.0,mung bean protein concentration is 2%and hydrolysis time is 120min.The antioxidant activity of mung bean polypeptides were as follows:mung bean polypeptides had good reductive activity,theIC50of hydroxyl radicals scavenging,hydrogen peroxide scavenging and liposome peroxide were 13.96mg/mL,12.67mg/mL and 15.77mg/mL respectively.Mung bean polypeptides showed strong antioxidant capacity in the four antioxidant experiments.
mung bean;polypeptide;antioxidant activity
10.3969 /j.issn.1003-5788.2010.06.001
傅亮(1968-),男,暨南大学副教授。E-mail:fuliang@188.com
何倩
2010-05-30
