海滨锦葵茎尖组织培养再生体系的优化
2010-12-27阮成江
刘 野,李 群,李 贺,阮成江
(1.辽宁师范大学生命科学学院,辽宁大连 116029;2.大连民族学院生物技术与资源利用国家民委教育部重点实验室,辽宁大连 116605;3.沈阳农业大学生物科学技术学院,沈阳 100161)
海滨锦葵茎尖组织培养再生体系的优化
刘 野1,2,李 群3,李 贺2,阮成江2
(1.辽宁师范大学生命科学学院,辽宁大连 116029;2.大连民族学院生物技术与资源利用国家民委教育部重点实验室,辽宁大连 116605;3.沈阳农业大学生物科学技术学院,沈阳 100161)
以茎尖为外植体,对海滨锦葵 (Kosteletzkya virginica)再生体系的优化进行了研究,结果表明:茎尖萌发的最适培养基为MS+ IAA0.3 mg·L-1+ZT0.3 mg·L-1,萌发率为 91.11%;继代增殖最适培养基为 MS+ IAA0.1 mg·L-1+KT0.5 mg·L-1,增殖系数为 4.67;生根培养基为MS(蔗糖 3%、琼脂 0.6%、pH值 5.8),生根率为 90%。炼苗移栽后,成活率可达 60%。
海滨锦葵;茎尖;组织培养;植株再生
海滨锦葵 (Kosteletzkya virginica)为锦葵科多年生草本植物,自然分布于美国含盐沼泽地带,1992年作为发展盐土农业的盐生植物从美国引进中国,已在山东、辽宁、江苏等沿海滩涂试种成功,是一种优良的耐盐油料植物[1],油脂含量与重要的经济作物大豆不相上下[2],作为生物柴油原料[3-4],具有很大的发展潜力。为进一步提高其种子中油脂的含量,使其成为理想的生物柴油原料,可通过转基因育种来进行遗传改良,而建立高效的植株再生体系则是转基因育种成功的前提条件之一[5]。本实验以海滨锦葵茎尖为外植体,在不同的培养基上进行茎尖萌发诱导、芽的继代增殖以及植株再生培养,以期获得高频再生体系。
1 材料与方法
1.1 材料
海滨锦葵种子于 2008年秋采自大连民族学院海滨锦葵试验地。
1.2 方法
1.2.1 无菌材料的获得
海滨锦葵茎尖取自 3日龄的无菌苗,用镊子和解剖刀除去子叶,以充分暴露被幼叶包裹着的茎尖分生组织 (显微镜下呈白色半透明圆锥状)[6],切除茎尖顶端的生长点后取 0.5~1.0 mm的茎尖,用于离体培养。
1.2.2 培养方法
以 MS(蔗糖 3%、琼脂 0.8%、pH值 5.8)[7]培养基为基本培养基,附加不同浓度的 IAA,ZT,KT,6-BA先诱导茎尖萌发,再进行继代增殖,之后将高约 2.5~3 cm的增殖苗转移到不加任何激素的MS培养基上,诱导生根。激素类物质均过滤灭菌,在基本培养基高温高压灭菌后加入[7]。
1.2.3 培养条件
培养温度:(26±1)℃;相对湿度:70%~80%;光照:14 h·d-1;光强:2 000lx[7]
1.2.4 炼苗移栽
当幼苗的根长到 2 cm左右时去除封口膜,在室内自然光下炼苗 3 d。然后取出并漂洗黏附于根上的培养基和松散的愈伤组织,立即移植到含水量 60%的营养土 (V(腐殖土)∶V(珍珠岩)=3∶1)中,并保持营养土表面湿润[7]。培养 5 d左右移入花盆并转至室外培养,15 d后统计成活率。
1.2.5 计算方法
萌发率 =(萌发生长的外植体数 /接种外植体数)×100%;
褐化率 =(褐化的外植体数/接种外植体数)×100%;
增殖系数 =(增殖芽数 /接种芽数)×100%;
生根率 =(生根苗数 /接种的苗数)×100%;
成活率 =(成活苗/移栽的组培苗总数)×100%。
2 结果与分析
2.1 接种发芽率
海滨锦葵的茎尖接种到附加不同浓度的I
AA,KT,ZT和 6-BA培养基上诱导萌发,5~8 d茎尖分生组织开始萌动 (如图 1、图 2),其中有的在基部形成愈伤组织,有的芽开始伸长,随后芽生长速度加快。诱导 15 d结果显示 (见表 1),5种培养基对茎尖的萌发有极显著差异 (F=50.75,P<0.01)。第二种处理对茎尖的萌发效果最好,萌发率为 91.11%。

图 1 萌动的茎尖

图 2 诱导 15 d后萌发的茎尖
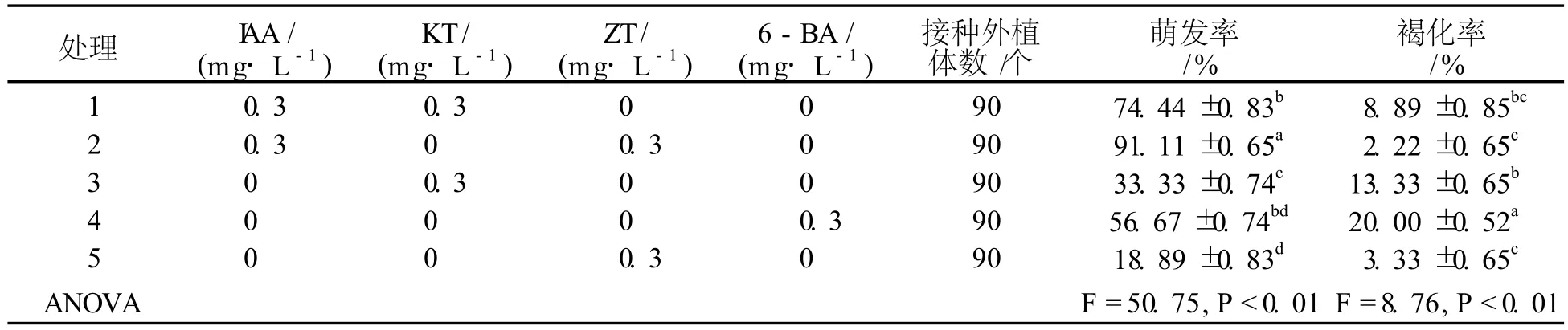
表 1 IAA,KT,ZT与 6-BA对海滨锦葵茎尖诱导分化的影响
2.2 继代增殖培养及植株再生
继代增殖 15 d后统计芽增殖情况 (如图 3),结果表明,第一种处理对芽诱导效果最好,增殖系数为 4.67(见表 2),生长旺盛且多为 3个以上丛生芽。生根培养 10 d左右可产生不定根,15 d后生根率为 90%,小苗生根速度快,茎粗壮,叶片生长旺盛,根系非常发达 (如图 4)。炼苗移栽时要注意保持营养土表面湿润,控制室内湿度在 70%~80%,温度在 25℃左右,培养 5 d后移栽入花盆[7],转至室外培养。统计幼苗成活率为 60%(如图 5)。
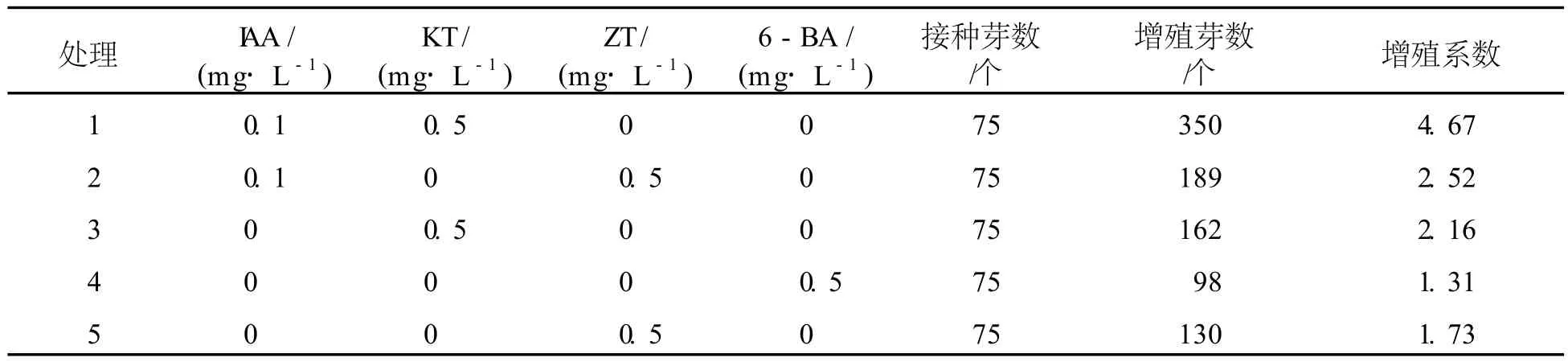
表 2 IAA,KT,ZT与 6-BA对海滨锦葵茎尖继代增殖的影响

图 3 芽的增殖

图 4 生根培养基上的生根情况

图 5 再生植株
3 讨 论
茎尖萌发的过程中出现了不同程度的褐化现象,可以在培养基中添加一些抗氧化物质,如添加PVP[8]、活性炭[9]来解决褐化问题。海滨锦葵组织培养过程中的重点和难点是芽的继代增殖。外植体的选择、激素的选择尤其是细胞分裂素的选择都是至关重要的。本实验选取苗高 2.5~3.0 cm,芽粗壮,长有真叶且颜色嫩绿的茎尖进行继代增殖,取得了较好的效果。Cook等[10]、郑熙等[7]和郭予琦等[11]分别使用 1.0 mg·L-1NAA和 10 mg·L-12-iP、0.1 mg·L-1IAA和 0.5 mg·L-1L ZT、1.0 mg·L-1NAA和 10 mg·L-12-iP组合成功的诱导出海滨锦葵不同部位的愈伤组织不定芽;郭予琦等[11]在实验中指出,KT对诱导海滨锦葵茎段愈伤组织不定芽的作用极弱;但是张宝红等[12]在棉花茎尖分生组织培养实验中指出,KT的添加对芽的增殖和生长是有利的,棉花和海滨锦葵同属于锦葵科植物。本实验以海滨锦葵茎尖为外植体 ,利用 0.1 mg·L-1IAA、0.5 mg·L-1KT组合,芽的增殖系数达到了 4.67,首先表明了相同的激素对不同的外植体的作用效果不同;其次表明当细胞分裂素与生长素浓度比例处于较高水平时有利于芽的增殖[13],细胞分裂素在诱导芽的增殖时起主导作用[14]。郑熙等[7]、郭予琦等[11]和Cook等[10]的植株再生实验整个周期分别用了约130,120,93 d,而本实验只用了 65 d,从很大程度上缩短了海滨锦葵植株再生的周期。
4 结 语
本实验以海滨锦葵茎尖为外植体进行植株再生,茎尖萌发最适培养基为MS+ IAA0.3 mg·L-1+ZT0.3 mg·L-1,萌发率为 91.11%;继代增殖最适培养基为 MS+ IAA0.1 mg·L-1+KT0.5 mg·L-1,增殖系数为 4.67;生根培养基为 MS(蔗糖 3%、琼脂 0.6%、pH值 5.8),生根率为 90%。并进行了温室炼苗与移栽等技术研究,幼苗成活率达到 60%。实验过程成功地优化了海滨锦葵茎尖组织培养再生体系,对进一步利用转基因方法培育海滨锦葵优良新品系具有重要的意义。
[1]RUAN C J,Q IN P,CHEN J W,et al.Analysis of nutritive compositions in the seeds of Kosteletzkya virginica[J].Acta AgronSin,2004,30:901-905.
[2]阮成江,钦佩,陈景文,等.海滨锦葵种子成分分析[J].作物学报,2004,30(9):901-905.
[3]郭予琦,田曾元,赵福庚,等.耐盐能源植物海滨锦葵(Kostelezkya virginica)再生体系的建立 [J].南京大学学报:自然科学版,2007,43(2):127-133.
[4]杨庆利,禹山林,秦松.超临界 CO2流体萃取海滨锦葵籽油的工艺条件优化 [J].农业工程学报,2009,25(5):253-257.
[5]林荣双,梁丽琨,肖显华,等.花生幼叶为外植体的植株再生系统的建立[J].植物学通报,2003,20:307-312.
[6]李晓.棉花基因转化的研究及其在纤维品质改良中的应用[D].浙江大学:作物遗传育种,2002.
[7]ZHENG XI,WANG Xueying,SHAN Ying,et al.Callus induction and plant regeneration from embryo exes ofKosteletzkya virginica[J].Chin Bull Bot,2007,24:194-199.
[8]姚洪军,罗晓芳,田砚亭.植物组织培养外植体褐变的研究进展[J].北京林业大学学报,1999,21:78-84.
[9]刘用生,李友勇.植物组织培养中活性炭的使用[J].植物生理学通讯,1994,30:214-217.
[10]DEBORAH A C,DEBRA M D,JOHN L G.Regeneration ofKosteletzkya virginica(L.)Presl.(SeashoreMallow)form callus cultures[J].Plant Cell Tissue Organ Cult,1989,17:111-119.
[11]郭予琦,田曾元,赵福庚,等.海滨锦葵的组织培养和植株再生[J].植物生理学通讯,2007,43(2):317-318.
[12]张宝红,李秀兰,李付广,等.棉花茎尖分生组织培养再生植株[J].中国棉花,1993,4:13-16.
[13]李进进,许继勇.生长调节剂在植物生长发育中的作用[J].广东轻工职业技术学院学报,2005,4(3):10-12.
[14]李贵,李志辉,童方平,等.椿叶花椒组织培养及植株再生[J].中国农学通报,2008,24(6):44-47.
Optim ization of Tissue Culture Regeneration System ofM eristem ofKosteletzkya virginica
L IU Ye1,2,L I Qun3,L I He2,RUAN Cheng-j iang2
(1.College ofLife Science,LiaoningNormalUniversity,Dalian Liaoning 116029,China;2.KeyLaboratory ofBiotechnology&Bio-ResourcesUtilization,State Ethnic Affairs Commission andMinistry of Education,Dalian NationalitiesUniversity,Dalian Liaoning 116605,China;3.College ofBiological Science and Technology,ShenyangAgriculturalUniversity,ShenyangLiaoning 100161,China)
We studied optimization of the regeneration system ofKosteletzkya virginicausingmeristem as the explant.The results showed thatMS+ IAA0.3 mg·L-1+ZT0.3 mg·L-1was the best culture medium for ger mination with a germination rate of 91.11%;the best subculture medium wasMS+ IAA0.1 mg·L-1+ZT0.5 mg·L-1,with a multiplication factor of 4.67;the bestmedium for rootingwasMS(sucrose at3%,agar at0.6%and pH at 5.8)with a 90%rooting rate.The survival rate of hardened-off seedlingswas up to 60%after being transplanted.
Kosteletzkya virginica;meristem;tissue culture;plant regeneration
Q943.1
A
1009-315X(2010)01-0009-04
2009-10-25
国家“十一五”科技支撑计划重大项目子专题 (2006BAD09A04);中国博士后科学基金特别资助项目(200801371);中国博士后科学基金资助项目 (20070420990);江苏省博士后基金资助项目 (0702018C)。
刘野 (1981-),男,辽宁兴城人,辽宁师范大学生命科学学院硕士研究生,主要从事植物生物技术研究。
阮成江 (1972-),男,河南新县人,教授,博士,学校优秀学科带头人,硕士生导师,主要从事植物进化适应和遗传育种研究,E-mail:ruan@dlnu.edu.cn。
(责任编辑 邹永红)
