2α,3β-二羟基齐墩果烷 -12-烯 -28β-醛的合成、表征及抗肿瘤活性研究
2010-12-27赵龙铉宋蕾蕾周晓琳赵德千田明珠贺兴隆
赵龙铉,宋蕾蕾,周晓琳,赵德千,田明珠,贺兴隆
(1.辽宁师范大学化学化工学院,辽宁 大连 116029;2.辽宁师范大学生物技术与分子药物研发辽宁省重点实验室,辽宁 大连 116029)
2α,3β-二羟基齐墩果烷 -12-烯 -28β-醛的合成、表征及抗肿瘤活性研究
赵龙铉1,2,*,宋蕾蕾1,周晓琳1,赵德千1,田明珠1,贺兴隆1
(1.辽宁师范大学化学化工学院,辽宁 大连 116029;2.辽宁师范大学生物技术与分子药物研发辽宁省重点实验室,辽宁 大连 116029)
以具有一定抗肿瘤活性的齐墩果酸为先导化合物,通过对 C-2位、C-3位和 C-28位进行结构修饰,得到具有抗肿瘤活性的五环三萜类化合物 2α,3β-二羟基齐墩果烷 -12-烯 -28β-醛。并通过IR、H NMR和13C NMR对其结构进行表征。研究其对MCF-7(人乳腺癌细胞)和 Hela(人宫颈癌细胞)的抑制作用。结果表明中间体和目标产物对两种癌细胞抑制作用均优于齐墩果酸。
齐墩果酸;三萜类;合成;抗肿瘤
1 引言
齐墩果酸 (oleanolic acid,简称 OA)是多种天然产物的主要功能成分,属于有机三萜酸[1],在自然界中分布广泛,显示出抗肿瘤[2]、抗炎[3]、降血糖[4]等多种药理作用。
Tokuda等[5]测试齐墩果酸和熊果酸的体内抗癌活性的结果表明,齐墩果酸和熊果酸能够显著抑制由 TPA诱导的小鼠皮肤肿瘤的生长,而且熊果酸对肿瘤生长的抑制作用可能与齐墩果酸、维甲酸略有不同。Ukiya[6]发现熊果酸二醇、三醇萜类化合物具有较好的抑制肿瘤生长的作用。Nishino[7]等对五环三萜类衍生物构效关系的研究中发现 18β-齐墩果烷 -12-烯 -3β,23α,28β-三醇具有很强的抑制由病毒引起的肿瘤生长的效果。据此我们以 OA为起始物质经九步合成了目标产物 2α,3β-二羟基齐墩果烷 -12-烯 -28β-醛,并对该化合物及中间体进行了肿瘤细胞体外抑制试验。
2 实验部分
2.1 仪器和试剂
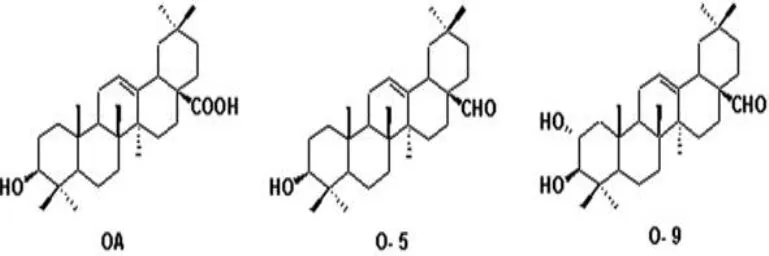
图 1 齐墩果酸、齐墩果醛 (O-5)和 2α,3β-二羟基齐墩果烷 -12-烯 -28β-醛 测 定
红外测定使用WGH-30型双光束红外分光光度计,KBr压片;1H NMR和13C NMR使用Varian-400MHz,Bruker Avance-500MHz核磁共振仪,T MS为内标,CDCl3为溶剂;熔点测定使用 X-5显微熔点测定仪 (控温型),温度未经校正;所用试剂均为分析纯或化学纯。
2.2 3β -羟基齐墩果烷 -12-烯 -28β-羧酸甲酯 (O-1)的合成

图 2 2α,3β-二羟基齐墩果烷 -12-烯 -28β -醛的合成路线
在一个 250mL的烧瓶内加入 10g(21.90mmol)OA、7.56g(55mmol)无水碳酸钾和100mL N,N-二甲基甲酰胺,搅拌下加入 2.80mL(43.80mmol)碘甲烷。室温下搅拌 6个小时。反应混合物用乙酸乙酯提取,合并有机相并用饱和氯化钠洗涤。分出有机相,用无水硫酸镁干燥。过滤除去干燥剂,减压蒸馏除去溶剂得白色固体。用乙酸乙酯/石油醚 (1:5,v:v)作洗脱剂进行色谱分离,得到白色固体 O-1。产量:10g,产率:97%,熔点:197.1-198℃。 IR(KBr):3348,2948,1728,1462cm-1;1H NMR (400 MHz,CDCl3):5.27(t,J = 3.6Hz,1H,H-12),3.61 (s,3H,OCH3),3.20(dd,J=10.4Hz,5.2Hz,1H,H-3),2.85(dd,J=14.0Hz,4.0Hz,1H,H-18),1.12,0.98,0.92,0.90,0.89,0.77,0.72(s,each 3H)。
2.3 3β -苄氧基齐墩果烷 -12-烯 -28β-羧酸甲酯 (O-2)的合成
在一个 250mL的烧瓶内,加入 5g(10.62mmol)O-1、0.50g四丁基碘化铵 (TBA I)和50mL四氢呋喃,搅拌下加入 4.25g(106.22mmol)60%的氢化钠。向此反应体系中加入3.80mL(31.87mmol)苄基溴,加热回流 2h。反应混合物在减压下蒸馏除去四氢呋喃,向残留物质中加入少量水,用乙酸乙酯提取,合并有机相并用饱和氯化钠洗涤。分出有机相,用无水硫酸镁干燥。过滤除去干燥剂,减压蒸馏除去溶剂得白色固体。用乙酸乙酯 /石油醚 (1:10,v:v)作洗脱剂进行色谱分离,得到纯净的白色固体 O-2。产量:4.6g,产率:77%,熔点:170.2-172.3℃。 IR (KBr):3448,2940,1728,1460,1386 cm-1;1H NMR(400MHz,CDCl3):7.28-7.37(m,5H,Ph-),5.29(t,J=3.6Hz,1H,H-12),4.67(d,J=11.6Hz,1H,O--Ph),4.43(d,J=11.6Hz,1H,O--Ph),3.63(s,3H,OCH3),2.93(dd,J=11.6Hz,4.4Hz,1H,H-3),2.86(dd,J=13.6Hz,4.4Hz,1H,H-18),1.13,0.99,0.93,0.92,0.90,0.84,0.73(s,each 3H);13C NMR(100MHz,CDCl3):178.49,144.02,139.73,128.38,127.64,127.40,122.62,86.73,71.56,55.96,51.74,47.85,46.98,46.11,41.87,41.53,39.54,39.11,38.59,37.23,34.08,33.33,32.91,32.61,30.91,28.52,26.16,23.86,23.67,23.29,22.94,18.49,17.07,16.84,15.53。
2.4 3β-苄氧基齐墩果烷 -12-烯 -28β-醇 (O-3)的合成
将 1.55g(2.76mmol)O-2溶于四氢呋喃溶液中,在室温下加入到 0.16g(4.15mmol)氢化铝锂的四氢呋喃溶液中,回流 1小时。反应混合物在减压下蒸馏除去四氢呋喃。加入乙酸乙酯及 1NHCl过滤以除去氢氧化铝和氢氧化锂沉淀,残留液用水洗至中性再用乙酸乙酯提取,合并有机相并用饱和氯化钠洗涤。分出有机相,用无水硫酸镁干燥。过滤除去干燥剂,减压蒸馏除去溶剂得浅黄色油状物。用乙酸乙酯/石油醚(1:20,v:v)作洗脱剂进行色谱分离,得到纯净的白色固体 O-3。产量:4.2g,产率:70.7%,熔点:228~228.9℃。 IR(KBr):3444,2944,2360,1460,1384 cm-1;1H NMR (400MHz,CDCl3):δ7.24-7.38(m,5H,Ph-),5.20(t,J=3.6Hz,1H,H-12),4.67(d,J=11.6Hz,1H,OCH2-Ph),4.43(d,J=11.6Hz,1H,O-CH2-Ph),3.56(d,J=10.8Hz,1H,H-28),3.22(d,J=10.8Hz,1H,H-28),2.94(dd,J=11.6Hz,4.4Hz,1H,H-3),1.17,1.01,0.96,0.95,0.90,0.89,0.86(s,each 3H);13C NMR(100MHz,CDCl3):δ144.43,139.70,128.38,127.62,127.39,122.59,86.69,71.56,69.86,55.88,47.78,46.67,42.54,41.92,40.03,39.13,38.73,37.13,37.10,34.30,33.41,32.79,31.23,31.16,28.49,26.15,25.74,23.80,23.78,22.96,22.21,18.50,16.95,16.84,15.74。
2.5 3β-苄氧基齐墩果烷 -12-烯 -28-醛 (O-4)的合成
在一个 50mL圆底烧瓶内加入 2.09g(5.55mmol)PDC、0.19mL乙酸酐和 20mL二氯甲烷搅拌 30分钟。在室温下向此反应体系中缓慢加入 3.70g(6.94mmol)O-3和 10mL二氯甲烷的混合溶液,回流 2h。反应混合物用乙酸乙酯稀释后过滤除去沉淀,残留液用水稀释后再用乙酸乙酯提取,合并有机相并用饱和氯化钠洗涤。分出有机相,用无水硫酸镁干燥。过滤除去干燥剂,减压蒸馏除去溶剂得浅褐色固体。用乙酸乙酯/石油醚 (1:20,v:v)作洗脱剂进行色谱分离,得到纯净的白色产品 O-4。产量:2.4g,产率:65.2%,熔点:148.3-150.6℃。 IR(KBr):3444,2944,1722,1456 cm-1;1H NMR(400MHz,CDCl3):δ9.40(s,1H,-CHO),7.25-7.37(m,5H,Ph-),5.34(t,J=3.6Hz,1H,H-12),4.67(d,J=11.6Hz,1H,O-CH2-Ph),4.43(d,J=11.6Hz,1H,O-CH2-Ph),2.93(dd,J=11.6Hz,4.8Hz,1H,H-3),2.63(dd,J=13.6Hz,4.8Hz,1H,H-18),1.17,0.99,0.92,0.91,0.89,0.84,0.74(s,each 3H);13C NMR(100MHz,CDCl3):δ207.75,143.22,139.73,128.39,127.65,127.41,123.53,86.71,71.56,55.95,49.32,47.79,45.84,41.94,40.66,39.85,39.13,38.66,37.21,33.40,33.30,33.00,30.87,28.54,27.98,26.97,25.78,23.70,23.66,22.35,18.47,17.27,16.85,15.59。
2.6 3β -羟基齐墩果烷 -12-烯 -28β-醛 (O-5)的合成
将 300mg(0.57mmol)O-4溶于 30mL无水乙醇中,在搅拌下加入 50mg 10%Pd/C,在氢气中搅拌 24h。过滤除去不溶物,滤液在减压下蒸馏得到粗产品。用乙酸乙酯/石油醚 (1:5,v:v)作洗脱剂进行色谱分离,得到纯净的白色产品 O-5。产量:205mg,产率:82.3%,熔点:168.5~170.2℃。 IR(KBr):3516,2944,1714,1462 cm-1;1H NMR (400MHz,CDCl3):δ9.40(s,1H,H-28),5.34(t,J=3.6Hz,1H,H-12),3.20(dd,J=10.8Hz,5.2Hz,1H,H-3),2.63(brd,J=14.0Hz,1H,H-18),1.14,0.98,0.92,0.91,0.90,0.78,0.73(s,each 3H);13C NMR(100MHz,CDCl3):δ207.78,143.23,123.48,79.21,55.41,49.30,47.77,45.82,41.92,40.63,39.78,38.96,38.70,37.22,33.37,33.27,32.95,28.32,27.95,27.40,26.95,25.75,23.63,22.31,18.50,17.22,15.77,15.54。
2.7 3β -甲基磺酰氧基齐墩果烷 -12-烯 -28β-醛 (O-6)的合成
将 200mg(0.45mmol)O-5溶解在二氯甲烷 (3mL)中加入 0.63mL三乙胺。冰浴下,向混合液中滴加 0.35mL(4.50mmol)甲基磺酰氯,控制温度在 0℃左右,混和液搅拌 3h。过滤,滤液以盐酸洗涤至微酸性,再水洗至中性。用乙酸乙酯提取,合并有机相并用饱和氯化钠洗涤。分出有机相,用无水硫酸镁干燥,过滤除去干燥剂,减压蒸馏除去溶剂得白色固体。用乙酸乙酯/石油醚 (1:10,v:v)做洗脱剂进行色谱分离,得到白色粉末状固体 O-6。产量:188mg,产率:80.5%,熔点:196.4-197℃。 IR (KBr):3444,2944,2360,1722,1466cm-1;1H NMR(400MHz,CDCl3):δ9.28(s,1H,H-28),(t,J=3.6Hz,1H,H-12),4.31(m,1H,H-3),2.98(s,3H,-SO2CH3),0.99,0.93,0.92,0.85,0.84,0.83,0.73(s,each,3H)。
2.8 齐墩果烷 -2,12-二烯 -28β-醛 (O-7)的合成
将 180mg(0.35mmol)O-6溶解在 4mL N,N-二甲基乙酰胺中并加入 51mg(1.03mmol)碳酸锂,混合液搅拌回流 15min。反应完毕后,混合物用乙酸乙酯提取,合并有机相并用饱和氯化钠洗涤。分出有机相,用无水硫酸镁干燥,过滤除去干燥剂,减压蒸馏除去溶剂得浅黄色油状物,用乙酸乙酯 /石油醚 (1:10,v:v)做洗脱剂进行色谱分离,得浅黄色固体 O-7产量:125mg,产率:84.5%,熔点:135.4~137.5℃。 IR(KBr): 3428, 1728, 1464cm-1;1H NMR(400MHz,CDCl3):δ9.42(s,1H,H-28),5.37~5.41(m,3H,H-2,H-3&H-12),2.64(dd,J=14.0Hz,4.0Hz,1H,H-18),0.92(s,6H),1.15,0.95,0.94,0.88,0.78(s,each 3H);13C NMR(100MHz,CDCl3):δ207.77,143.02,138.17,123.71,121.59,52.24,49.38,46.39,46.28,45.83,45.78,41.00,40.81,36.38,34.68,33.42,33.29,32.43,32.02,30.87,27.99,26.92,25.60,23.64,23.55,23.00,22.43,19.71,17.04,15.82。
2.9 2α,3α -环氧齐墩果烷 -12-烯 -28β -醛 (O-8)的合成
将 170mg(0.4mmol)O-7溶于 2mL二氯甲烷中,加入 76mg(0.44mmol)mCPBA,室温下搅拌 6h。反应完毕后,用饱和碳酸氢钠将 pH调节至微碱性,再水洗至中性。水相用二氯甲烷提取,合并有机相并用饱和氯化钠洗涤。分出有机相,用无水硫酸镁干燥,过滤除去干燥剂,减压蒸馏除去溶剂得白色固体。用乙酸乙酯/石油醚(1:10,v:v)做洗脱剂进行色谱分离,得白色固体 O-8。产量:88mg,产率:50.3%,熔点:204.1-206℃。 I R (KBr):2952,2708,2360,1722,1464,1376,1304cm-1;1H NMR (500MHz,CDCl3):δ9.39(s,1H,H-28),5.35(t,J=3.6Hz,1H,H-12),3.16-3.18(dd,J=6.2Hz,4.0Hz,1H,H-2),2.79(d,J=3.8Hz,1H,H-3),2.63(dd,J=14.0Hz,4.0Hz,1H,H-18,1.11,1.09,1.00,0.91,0.90,0.70(s,each 3H)。
2.10 2 α,3β-二羟基齐墩果烷 -12-烯-28β-醛 (O-9)的合成将 120mg(0.27mmol)O-8溶于 1mL四氢呋喃中,滴加入浓硫酸 2滴和 0.20mL水,回流下搅拌 1h。反应混合物用水稀释,用乙酸乙酯提取,合并有机相并用饱和氯化钠洗涤。分出有机相,用无水硫酸镁干燥。过滤除去干燥剂,减压蒸馏除去溶剂得白色固体。用乙酸乙酯 /石油醚 (1:10,v:v)做洗脱剂进行色谱分离,得白色固体 O-9。产量:45mg,产率:36%,熔点:202.5-205℃。 IR (KBr):3424,2928,1728,1464,1384,cm-1;1H NMR(500MHz,CDCl3):δ9.38(s,1H,H-28),5.36(t,J=3.6Hz,1H,H-12),3.75(m,1H,H-2),3.64(d,J=10.4Hz,1H,H-3),2.62(dd,J=14.0Hz,4.0 Hz,1H,H-18),1.14,1.09,1.00,0.92,0.91,0.73(s,each 3H)。13C NMR(125MHz,CDCl3):δ207.43,142.94,123.34,78.25,69.04,51.03,49.17,48.20,45.55,41.97,40.63,39.87,37.36,33.23,33.08,32.24,30.67,29.72,27.76,26.66,25.52,23.93,23.42,23.40,23.26,22.16,20.93,19.87,16.76。
3 对肿瘤细胞的抑制试验
3.1 药品及试剂
小牛血清 Hyclone,NewZealand
RPM I1640 Hyclone,NewZealand
DMEM Hyclone,NewZealand
胰蛋白酶 北京拜尔迪生物公司
MTT Ameresco
二甲基亚砜(DMSO)Solarbio
3.2 细胞株
人宫颈癌细胞(Hela) 中国协和医科大学
人乳腺癌细胞(MCF-7) 中国协和医科大学
3.3 仪器
B IORAD 550型酶标仪
3.4 试验方法
四氮唑盐【3,(4,5-dimethylthiazol-2-yl)-2,5-diphenyl-tetrazolium bromide,MTT】还原法。收集生长良好的肿瘤细胞,用含 10%小牛血清的 RPM I1640培养基配制成 1X104/ml细胞悬液,于 96孔培养板内接种,每孔 200μl,置37℃,5%CO2温箱内培养 24小时后加药,试验设空白对照,受试样品设四个浓度,每个浓度 4个平行孔,置 37℃,5%CO2温箱内培养 24小时。弃去上清液,每孔加入 DMSO 200μl溶解Fomazan颗粒,轻度震荡后,用 550型酶标仪在检测波长 540nm下测定 OD值。以药物的不同浓度及对细胞的抑制率,从中求出半数抑制浓度(I C50)。
3.5 数据处理
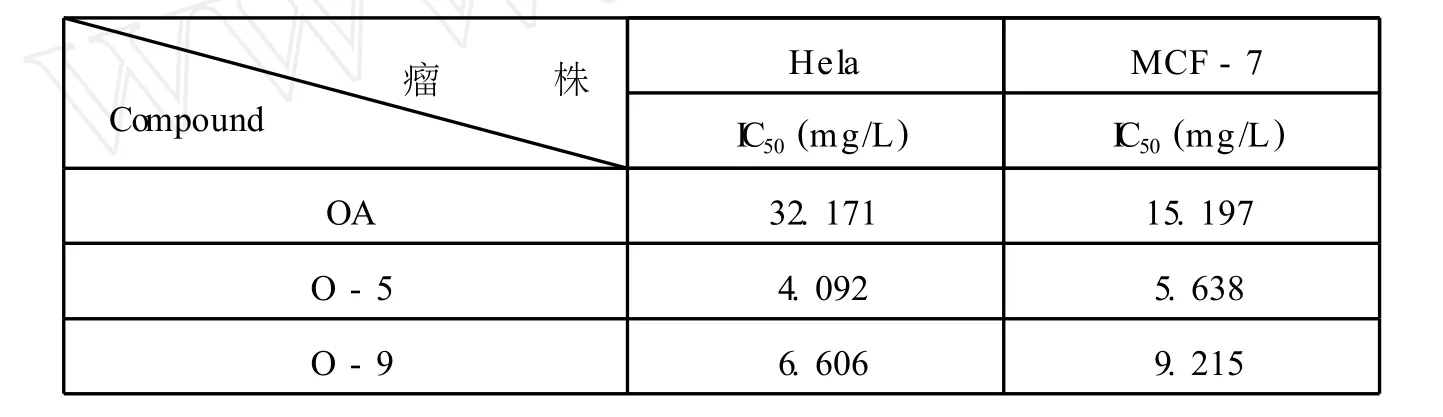
表 1 化合物 OA、O-5及 O-9对癌细胞的抑制作用
4 结果与讨论
齐墩果酸衍生物具有多种生物活性,近年来,它们的抗肿瘤活性研究备受关注。为了详细研究齐墩果酸及其衍生物的结构与抗肿瘤活性之间的关系,我们做了以下工作:(1)首先以 OA为原料,DMF做溶剂,在碳酸钾存在下,加入碘甲烷得到 C-28位的羧基甲酯化的产物。此甲酯化产物,在 NaH和 TBA I存在下,加入苄基溴得到 3β-苄氧基齐墩果烷 -12-烯 -28β-羧酸甲酯,进一步用 LiAlH4还原得到 3β-苄氧基齐墩果烷 -12-烯 -28β-醇。(3)以此中间体为基础,通过 PDC氧化将 C-28位变成醛基。再以 10%Pd/C做催化剂,用氢气还原得到中间体齐墩果醛 (O-5);在该产物的 C-3位导入离去基团 -OMs后,再以 DMAP为溶剂 Li2CO3存在下加热回流得到化合物 O-7:齐墩果烷 -2,12-二烯 -28β-醛。(3)进一步用 mCPBA将 C-2,C-3位双键氧化,最后在浓硫酸条件下水解得到最终产物 O-9:2α,3β -二羟基齐墩果烷 -12-烯 -28β-醛。(4)合成的中间体和最终产物进行了对人宫颈癌细胞 (Hela)和人乳腺癌细胞 (MCF-7)的抑制作用的测试,所得数据见表 1,结果显示 O-5及 O-9对 Hela、MCF-7两种癌细胞的抑制作用均优于OA。
5 结论
本文以齐墩果酸为起始物,通过 9步反应共合成包括目标产物在内的 9个化合物,其中未见报道的化合物 4个。使用 I R、1H NMR和13C NMR等波谱数据对相关化合物的结构进行了表征。运用 MTT比色法对 O-5、O-9及 OA进行了抗肿瘤活性测试,结果显示 O-5及 O-9对Hela,MCF-7两种癌细胞均有良好的抑制作用,且优于母体OA的抑制作用。
[1]李开泉,陈武,熊筱娟等,乌索酸的化学、药理及临床应用进展[J].中成药,2002,24(9):709-711.
[2]YOSHIKAWA M.,MATSUDA H.Antidiabetogenic activity of oleanolic acid glycosides from medicinal foodstuffs[J].Biofactors,2000,13:231-237.
[3]王兵,蒋朝晖,齐墩果酸的研究 [J].中国药学杂志,1992,27(7):393-397.
[4]张纬江,潘德济,张罗修,等.雷公藤三萜成分研究[J].药学学报,1986,21(8):592-598.
[5]TOKUDAH.,OHIGASHI H.,KOSH IM IZU,ITO Y.,Inhibitory effect of ursolic and oleanolic acid on skin tumor promotion by 12-O-tetradecanoylphorbol-13-acetate[J].CancerLett.,1986,33(3):279-285.
[6]UKIYA M,AKIHISA T,TOKUDA H,et al.Constituents of compositae plants III.Anti- tumor promoting effects and cytotoxic activity against human cancer cell lines of triterpene diols and triols from edible chrysanthemum flowers[J].Cancer Lett.,2002,177(l):7-12.
[7]NISH INO H,N ISH INO A,TAKAYASU J,et al.Inhibition of the tumor-promoting action of 12-O-tetra-decanoylphorbol-13-acetate by some oleanane-type triterpenolde compounds[J].Cancer Res.,1988,48(18):5210-5215.
Synthesis and Characterization of 2α,3β -D ihydroxylUrsa-12-en-28β-aldehyde and Prel im inary Study on Anti-tumor Activities
ZHAO Long-xuan1,2,SONGLei-lei1,ZHOU Xiao-lin1,ZHAO De-qian1,T IAN Ming-zhu1,HE Xing-long1
(1.College of Chemistry and Chemical Engineering,LiaoningNormalUniversity,Dalian116029,China)(2.Liaoning Provincial KeyLaboratory ofBiotechnology and DrugDiscovery,LiaoningNormalUniversity,Dalian116029,China)
In order to develop petacyclic triterpenoidswith potential anti-tumor activities,we take the natural product oleanolic acid which with anti-tumor activity as the lead compounds formodifying their structures in this paper.2,3-DihydroxylUrsa-12-en-28-aldehyde were synthesized through modification at C-2,C-3 and C-28 of oleanolic acid.The structures of the compoundswere confir med by IR,1H NMR and 13C NMR.Finally,anti-tumor activities comparison among the new derivatives and OA was carried out.The result shows that the activation of targetmaterial and one of the intermediate was superior to oleanolic acid in anti-tumor.
oleanolic acid;triterpenoids;synthesis;anti-tumor
O624.33 < class="emphasis_bold">文献标识码:A文章编号:
1008-2395(2010)06-0028-06
2009-10-23
赵龙铉 (1967-),男,教授,Email:lxzhao@lnnu.edu.cn
